Neoadjuvante systemische Therapie beim Mammakarzinom: Vorteile und Herausforderungen
Komm. Stv. Direktorin der Landesfrauenklinik<br>Leiterin der Senologie und des Brustzentrums <br>Landesfrauenklinik<br>HELIOS Universitätsklinikum Wuppertal<br>Universität Witten/Herdecke<br>E-Mail: vesna.bjelic-radisic@helios-gesundheit.de
Seit der Einführung der neoadjuvanten Chemotherapie in den 1970er-Jahren hat sich das Konzept der neoadjuvanten systemischen Therapie (NST) – damals als „experimentelles“ Tumorkonzept mit dem Ziel, große Tumormassen zu reduzieren und inoperable Tumoren „operationstauglich“ zu machen bzw. eine brusterhaltende Therapie (BET) bei lokal fortgeschrittenen Karzinomen zu ermöglichen – inzwischen als Standard etabliert und ist ein fixer Bestandteil der multimodalen Therapie beim Mammakarzinom geworden. Mittlerweile kommt der NST allerdings eine weitaus größere Bedeutung zu als „nur“ die Verkleinerung des Tumors.
Das ursprüngliche Ziel einer neoadjuvanten Chemotherapie (NACT), die Tumormasse zu verkleinern, ist inzwischen nur ein Puzzleteil des gesamten Spektrums der „Aufgaben“ geworden. Vielmehr ist die NST heutzutage mit der Möglichkeit der Beurteilung des Tumoransprechens auf die Therapie, der Messung der Wirksamkeit der Therapie in vivo, den Möglichkeiten der Verkürzung der Therapiedauer und schnelleren Einführung der zielgerichteten Therapie in die klinische Praxis verbunden. Alle diese „Aufgaben“ und die Möglichkeit, eine Antwort auf die gestellten Fragen im Rahmen einer NST zu bekommen, haben zum Ziel, das Outcome zu verbessern sowie das Gesamtüberleben (OS) und das krankheitsfreie Überleben (DFS) zu verlängern.
Die pathologische komplette Remission als Surrogatmarker
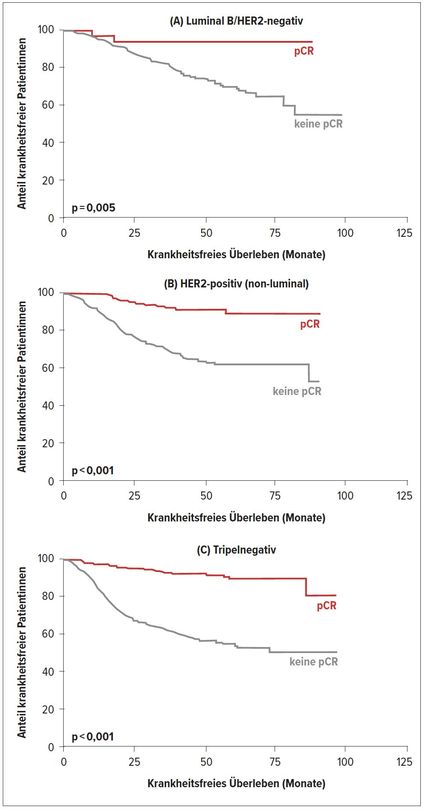
Als anerkannter Surrogatmarker für das OS in den Luminal B/HER2-negativen, HER2-positiven („non-luminal“) und tripelnegativen Mammakarzinomen (TNBC) gilt eine pathologische komplette Remission (pCR) (Abb. 1).1 Auch die Food and Drug Administration (FDA) hat bereits die pCR als validen Endpunkt in Studien für eine beschleunigte Genehmigung der neuen Medikamente anerkannt.
Abb. 1: Pathologische komplette Remission (pCR) als Surrogatmarker bei (A) luminal-B/HER2-negativen, (B) HER2-positiven (non-luminal) und (C) tripelnegativen Mammakarzinomen (nach von Minckwitz G et al.)21
Mit der Anerkennung der pCR als Surrogatmarker für das OS hat die NST einen wesentlichen Vorteil im Vergleich mit der gleichartigen adjuvanten Therapie. Sie ermöglicht, das Ansprechen auf die Therapie zu beurteilen sowie eine Verbesserung der Prognose durch die Individualisierung der Therapie im postneoadjuvanten Setting. Um nur ein Beispiel zu nennen: Man blicke auf die Daten der CREATE-X-Studie bzw. einer Metaanalyse über die zusätzliche Gabe von Capecitabin in der Erstlinien-Chemotherapie.2,3 Die Metaanalyse von 10 Studien mit über 12000 Patientinnen hat gezeigt, dass die Kombination von Capecitabin mit der Erstlinien-Chemotherapie im Vergleich zu keiner zusätzlichen Gabe von Capecitabin sowohl das DFS (HR: 0,84; p=0,000) als auch das OS verlängert (HR: 0,84; p=0,001). Die Resultate dieser Studien haben zu einer Änderung der Leitlinien geführt. Dementsprechend wird die Verabreichung von Capecitabin im postneoadjuvanten Setting für Patientinnen mit TNBC, welche keine pCR erreicht haben, in aktuellen Leitlinien empfohlen und so auch in der Praxis gelebt.4
Postneoadjuvante zielgerichtete Therapie
Eine postneoadjuvante individualisierte zielgerichtete Therapie wurde auch bei Patientinnen mit HER2/neu-positivem Mammakarzinom in die klinische Praxis übernommen. Die KATHERINE-Studie zeigte, dass Trastuzumab-Emtansin (T-DM1) bei Patientinnen mit HER2/neu-positivem Mammakarzinom, die nach einer neoadjuvanten Chemotherapie mit Taxanen (mit oder ohne Antrazyklinen) und Trastuzumab keine pCR erreicht hatten, im adjuvanten Setting zu einer 50%igen Reduktion eines invasiven Rezidivs, verglichen mit Trastuzumab alleine, führt.5
Ein typisches Beispiel der Einführung der zielgerichteten Therapie in die klinische Praxis als Resultat der durchgeführten Studien im neoadjuvanten Setting ist die Anwendung der dualen Blockade aus Pertuzumab und Trastuzumab bei HER2/neu-positivem Mammakarzinom. Eine 2014 publizierte Metaanalyse zeigte an 10 Studien und mehr als 2247 Patientinnen, dass eine duale Blockade in der Kombination mit der Chemotherapie, verglichen mit der einfachen Blockade durch Trastuzumab und Chemotherapie, zu einer höheren Rate der pCR führte (p=0,02).6–8
Steigerung der brusterhaltenden Therapie
Das ursprüngliche Ziel, durch die Anwendung der neoadjuvanten Therapie die Rate einer brusterhaltenden Therapie (BET) bei einer lokal fortgeschrittenen Erkrankung zu steigern, wurde bereits in mehreren Studien bestätigt. In der Metaanalyse der Early Breast Cancer Trialists’Collaborative Group (EBCTGC) über das Outcome von Patientinnen mit Mammakarzinom im Frühstadium (EBC) bei Anwendung einer neoadjuvanten Chemotherapie versus adjuvante Chemotherapie wurden die Daten von 4756 Patientinnen mit einem Follow-up von 9 Jahren analysiert. Die BET wurde bei den 65% der Patientinnen, die eine NACT erhalten haben, durchgeführt, im Vergleich zu 49% der Patientinnen, die die gleiche Therapie im adjuvanten Setting erhalten haben. Allerdings war die Lokalrezidivrate im NACT-Setting mit 21,4% vs. 15,9%höher. Es gab keinen Unterschied in der krankheitsspezifischen Mortalität, Fernmetastasierung und allgemeinen Mortalitätsrate. Die Autoren fassen zusammen, dass die Senkung der höheren Lokalrezidivrate bei der NACT weiterhin eine Herausforderung darstellt. Durch die adäquate Strahlentherapie, eine bessere und umfangreichere pathologische Aufarbeitung des Präparats und bessere Lokalisation des Tumorbetts soll diese höhere Lokalrezidivrate vermieden werden.9
Deeskalation der axillären Chirurgie
Auch das Ausmaß der axillären Chirurgie wird durch die Anwendung der NST weiter reduziert. Ursprünglich vorsichtig getestet und schließlich durch die Einführung des Sentinel-Node(SN)-Biopsie-Konzepts Ende der 1990er sowie der Anfang der 2000er angefangenen Deeskalation der operativen Therapie in der Axilla wurde durch die NST eine weitere Deeskalation der axillären Chirurgie ermöglicht. Bei cN+-Status und Konversion in ypN0 nach der NST hat bereits ein schonenderes axilläres Staging mit einer sogenannten „targeted axilliary dissection“ (TAD) statt einer klassischen axilliären Dissektion den Weg in die Praxis gefunden.10–13 Dieses Vorgehen ist auch Bestandteil der aktuellen Leitlinien der Arbeitsgemeinschaft für gynäkologische Onkologie (AGO) geworden.4
Therapieoptimierung
Neben der Herausforderung, die lokale Therapie zu optimieren, bleibt es weiterhin eine Herausforderung, die pCR-Rate zu steigern bzw. die Resistenz auf die Therapie zu überwinden. Dies bedeutet eine Optimierung der Therapie, die in Form einer alternativen Therapie oder einer Kombinationstherapie stattfinden kann. So zeigte sich, dass eine zusätzliche platinhaltige Therapie im neoadjuvanten Setting zu einer Steigerung der pCR beim TNBC führt.14–16 Ein weiterer Erfolg wurde in der I-SPY2-Studie erzielt, in welcher eine Kombinationstherapie aus Veliparib und Carboplatin zusätzlich zur Standard-NST in PhaseII bei verschiedenen Mammakarzinomsubtypen geprüft wurde. Die Resultate zeigten, dass mit der zusätzlichen Gabe von Veliparib und Carboplatin zur Standard-NST in der Gruppe der TNBC eine Steigerung der pCR-Rate im experimentellen Arm von 51% vs. 26% im Standardarmzu erwarten ist.17
Auf der Suche nach prädiktiven Biomarkern
Prädiktive Biomarker zu definieren, welche das Erreichen der pCR mit Sicherheit vorhersagen, bleibt weiterhin eine der größten Herausforderungen. Die Prädiktion der pCR ermöglicht die Unterscheidung zwischen Respondern und Non-Respondern und schafft dadurch auch eine bessere Möglichkeit, eine adäquate pharmakologische Therapie zu wählen. Bekannte und häufig verwendete prädiktive Faktoren für eine pCR sind klinisch-pathologische Faktoren wie klinisches Tumorstadium, Grading, immunhistochemischer Subtyp oder tumorinfiltrierende Lymphozyten (TIL).
Das klinische Tumorstadium wurde in mehreren Studien als unabhängiger prädiktiver Faktor für eine pCR identifiziert. In einer Studienkohorte von 957 Mammakarzinompatientinnen, welche mit einer NST therapiert worden waren, war die am höchsten mit einer pCR assoziierte Variable das klinische Tumorstadium (p<0,001). Nur die Hälfte der Patientinnen mit einem Tumor im Stadium cT3–cT4 erreichten eine pCR verglichen mit Patientinnen, die einen Tumor im Stadium cT1–2 T2 aufwiesen (12% vs. 24% pCR-Rate).18 In einer Studie von Goorts et al. wurden die Daten von insgesamt 2046 Patientinnen analysiert. Neben dem klinischen Tumorstadium, das sich ebenfalls wie bei der vorherigen Studie als unabhängiger prädiktiver Faktor für eine pCR darstellte, wurden weitere prädiktive Faktoren für eine pCR definiert: positiver HER2/neu-Status,
negativer Östrogenrezeptor(ER)- und Progesteronrezeptor(PR)-Status.19 Lips et al. definierten in der Analyse von 560 primären Mammakarzinomen das Grading des Tumors als prädiktiven Faktor, wobei G3 der beste Prädiktor für eine pCR bei ER-positivem, HER2/neu-negativem Mammakarzinom war (p<0,004).20 Unabhängig vom Typ des Prädiktors muss jedoch auch betont werden, dass die Verbesserung des Outcomes mit dem Erreichen einer pCR assoziiert ist, aber an die spezifischen Mammakarzinomsubtypen gebunden ist.21
Eine weitere Reihe an molekularen Biomarkern als pCR-Prädiktoren wurde bzw. wird geprüft, unter anderem der PAM50-Genexpressionstest oder TRAT-Signaturen für HER2/neu-positive Mammakarzinome. Ein Großteil der Studien mit diesen Fragestellungen umfasst TNBC, wahrscheinlich aufgrund der „Aggressivität“ der Erkrankung bzw. fehlender spezifischer zielgerichteter Therapieansätze.
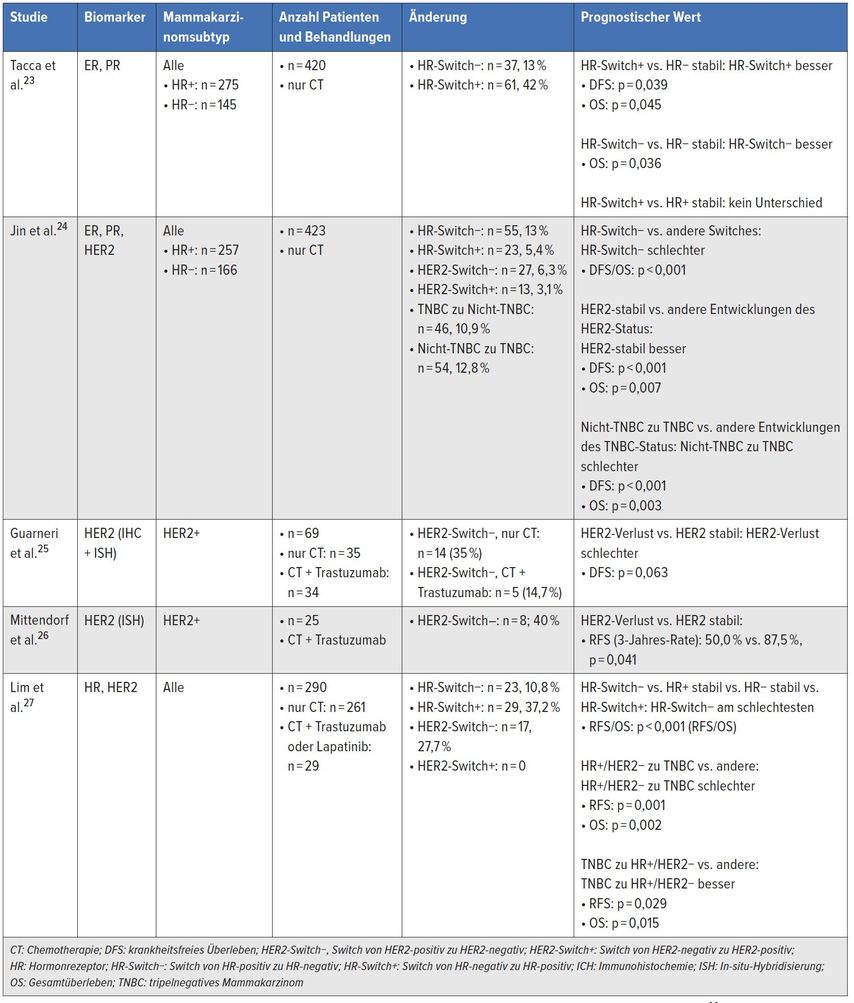
Abseits der Herausforderung, spezifische und sensitive prädiktive Biomarker für die pCR zu finden, besteht die Notwendigkeit, den Resttumor auf mögliche weitere therapeutische Targets zu prüfen. In Fällen,in denen eine pCR nicht erreicht wird, haben die Klassifikation und die Eigenschaften des Resttumors („residual disease“, RD) eine spezielle Bedeutung in Hinblick auf das klinische Outcome. Die Klassifikation der RD gibt die Möglichkeit der Identifikation weiterer möglicher therapeutischer Targets. Neue Mutationen und Evolutionen des Phänotyps während der NST können zu Veränderungen der Tumorbiologie (wie ER, PR oder HER2/neu-Status – um nur einige bekannte Biomarker zu erwähnen) führen. Diese Veränderungen können zu Änderungen der Prognose führen. Einige Studien, die diese Veränderungen untersucht haben, sind in Tabelle 1 gelistet.
Tab. 1:Ausgewählte Studien zur Bewertung klassischer Biomarker der Resterkrankung Brustkrebs (nach Penault-Llorca F et al.)22
Eine weitere Aufgabe ist es, die Faktoren, die für eine Metastasierung verantwortlich sind, zu definieren, sowohl im primären Tumor als auch im Resttumor. 90% der Todesfälle von Patientinnen mit Mammakarzinom stehen im Zusammenhang mit Fernmetastasen. Die Identifikation von diesen Faktoren/Biomarkern wird einen großen Schritt zur Verbesserung des Outcomes der Mammakarzinompatientinnen darstellen.
Fazit
Mit der NST haben wir es geschafft, die Tumoren zu verkleinern, weniger ausgedehnte Operationen durchzuführen und somit die Morbidität als Folge der Operationen zu vermindern. Eine schnellere Einführung besonders von zielgerichteten Therapien in die Praxis sowie die Optimierung der neoadjuvanten und postneodajuvanten Therapien, die zur Verbesserung des Outcomes der Mammakarzinompatientinnen führen, sind nur ein Teil der Vorteile, die die NST mit sich gebracht hat. Trotzdem bleiben weitere Fragen im Zusammenhang mit der NST offen, wie die optimale Chirurgie, um die Lokalrezidivrate zu senken, die Suche nach prädiktiven Markern für eine pCR bzw. Fernmetastasen, um nur einen Teil zu erwähnen.
Literatur:
1 von Minckwitz G et al.: Definition and impact of pathologic complete response on prognosis after neoadjuvant chemotherapy in various intrinsic breast cancer subtypes. J Clin Oncol 2012; 30(15): 1796-804 2 Masuda N et al.: Adjuvant capecitabine for breast cancer after preoperative chemotherapy. N Engl J Med 2017; 376(22): 2147-59 3 Xu D et al.: Addition of capecitabine in breast cancer first-line chemotherapy improves survival of breast cancer patients. J Cancer 2019; 10(2): 418-29 4 AGO: Diagnostik und Therapie früher und fortgeschrittener Mammakarzinome. 2020. Online verfügbar unter ago-online.de. Abgerufen am 16. Oktober 2020 5 von Minckwitz G et al.: Trastuzumab emtansine for residual invasive HER2-positive breast cancer. N Engl J Med 2019; 380(7): 617-28 6 Nagayama A et al.: Comparative effectiveness of neoadjuvant therapy for HER2-positive breast cancer: a network meta-analysis. J Natl Cancer Inst 2014; 106(9): dju203 7 Gianni L et al.: Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol 2012; 13(1): 25-32 8 Schneeweiss A et al.: Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase II cardiac safety study (TRYPHAENA). Ann Oncol 2013; 24(9): 2278-84 9 EBCTCG: Long-term outcomes for neoadjuvant versus adjuvant chemotherapy in early breast cancer: meta-analysis of individual patient data from ten randomised trials. Lancet Oncol 2018; 19(1): 27-39 10 Boughey JC et al.: Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial. JAMA 2013; 310(14): 1455-61 11 Fu JF et al.: Feasibility and accuracy of sentinel lymph node biopsy in clinically node-positive breast cancer after neoadjuvant chemotherapy: a meta-analysis. PLoS One 2014; 9(9): e105316 12 Lee HD et al.: Prospective evaluation of the feasibility of sentinel lymph node biopsy in breast cancer patients with negative axillary conversion after neoadjuvant chemotherapy. Cancer Res Treat 2015; 47(1): 26-33 13 Boileau J-F et al.: Sentinel node biopsy after neoadjuvant chemotherapy in biopsy-proven node-positive breast cancer: the SN FNAC study. J Clin Oncol 2015; 33(3): 258-64 14 Alba E et al.: A randomized phase II trial of platinum salts in basal-like breast cancer patients in the neoadjuvant setting. Results from the GEICAM/2006-03, multicenter study. Breast Cancer Res Treat 2012; 136(2): 487-93 15 von Minckwitz G et al.: Neoadjuvant carboplatin in patients with triple-negative and HER2-positive early breast cancer (GeparSixto; GBG 66): a randomised phase 2 trial. Lancet Oncol 2014; 15(7): 747-56 16 Petrelli F et al.: The value of platinum agents as neoadjuvant chemotherapy in triple-negative breast cancers: a systematic review and meta-analysis. Breast Cancer Res Treat 2014; 144(2): 223-32 17 Rugo SH et al.: Adaptive randomization of veliparib-carboplatin treatment in breast cancer. N Engl J Med 2016; 375(1): 23-34 18 Prat A et al.: Response and survival of breast cancer intrinsic subtypes following multi-agent neoadjuvant chemotherapy. BMC Med 2015; 13: 303 19 Goorts B et al.: Clinical tumor stage is the most important predictor of pathological complete response rate after neoadjuvant chemotherapy in breast cancer patients. Breast Cancer Res Treat 2017; 163(1): 83-91 20 Lips EH et al.: Breast cancer subtyping by immunohistochemistry and histological grade outperforms breast cancer intrinsic subtypes in predicting neoadjuvant chemotherapy response. Breast Cancer Res Treat 2013; 140(1): 63-71 21 von Minckwitz G et al.: Definition and impact of pathologic complete response on prognosis after neoadjuvant chemotherapy in various intrinsic breast cancer subtypes. J Clin Oncol 2012; 30(15): 1796-804 22 Penault-Llorca F et al.: Biomarkers of residual disease after neoadjuvant therapy for breast cancer. Nat Rev Clin Oncol 2016; 13(8): 487-503 23 Tacca O et al.: Changes in and prognostic value of hormone receptor status in a series of operable breast cancer patients treated with neoadjuvant chemotherapy. Oncologist 2007; 12: 636-43 24 Jin X et al.: Prognostic value of receptor conversion after neoadjuvant chemotherapy in breast cancer patients: a prospective observational study. Oncotarget 2015; 6: 9600-11 25 Guarneri V et al.: Loss of HER2 positivity and prognosis after neoadjuvant therapy in HER2-positive breast cancer patients. Ann Oncol 2013; 24: 2990-4 26 Mittendorf EA et al.: Loss of HER2 amplification following trastuzumab-based neoadjuvant systemic therapy and survival outcomes. Clin Cancer Res 2009; 15: 7381-8 27 Lim SK et al.: Impact of molecular subtype conversion of breast cancers after neoadjuvant chemotherapy on clinical outcome. Cancer Res Treat 2016; 48(1): 133-41
Das könnte Sie auch interessieren:
Die Thalassämie nimmt hierzulande an Bedeutung zu
Die medizinische Betreuung von Thalassämiepatient:innen hat sich in den letzten Jahrzehnten deutlich gebessert und benötigt insbesondere bei symptomatischen Patient:innen eine ...
Interessante Daten zu neuen Therapieoptionen
Am hämatologischen Jahreskongress der American Society of Hematology (ASH) wurden Updates von Studien wie TRIANGLE und POLARIX präsentiert, ohne dass sich hierbei grundlegende neue ...
Therapie des multiplen Myeloms
Dank vielfältiger neuer Therapieoptionen verbessert sich die Prognose beim multiplen Myelom (MM) stetig. Die bereits verfügbaren Therapien können oft eine langfristige, zum Teil auch ...