Immuntherapeutische Optionen im Mittelpunkt
Obwohl die Covid-19-Pandemie in vielerlei Hinsicht das Kongressgeschehen des diesjährigen Meetings der Europäischen Gesellschaft für Medizinische Onkologie (ESMO) dominierte, lag der Schwerpunkt beim Mammakarzinom im Frühstadium sowie bei metastasierten, tripelnegativen Formen vielmehr auf immuntherapeutischen Behandlungsoptionen wie dem PD-L1(„programmed cell death 1 ligand 1“)-Inhibitor Atezolizumab. Assoc. Prof. Priv.-Doz. Dr. Rupert Bartsch sprach mit uns u.a. über verheißungsvolle und überraschende Ergebnisse der IMpassion-Studien 031, 131 und 130 sowie über die vielversprechenden Phase-III-Daten der ASCENT-Studie zum Antikörper-Wirkstoff-Konjugat Sacituzumab govitecan.
Was waren für Sie die wichtigsten am ESMO-Meeting präsentierten Studien beim Mammakarzinom im Frühstadium?
R. Bartsch: Das ESMO-Meeting 2020 war natürlich aufgrund des virtuellen Designs etwas ganz Besonderes. Allerdings muss man gestehen, dass wir diese virtuellen Kongresse schon fast gewöhnt sind – man denke nur an das diesjährige virtuelle Meeting der American Society of Clinical Oncology (ASCO). Im Bereich des Mammakarzinoms im Frühstadium sind beim ESMO-Meeting drei Studien vorgestellt worden, die meines Erachtens nach besonders interessant sind.
Das wäre zum einen die IMpassion-031-Studie, welche von Univ.-Prof. Dr. Nadja Harbeck präsentiert wurde. Über 300 Patientinnen mit tripelnegativem Mammakarzinom wurden zu neoadjuvanter Chemotherapie mit Nab-Paclitaxel, gefolgt von dosisdichtem AC (Doxorubicin, Cyclophosphamid), entweder mit Atezolizumab oder Placebo 1:1 randomisiert, im Anschluss erfolgte die Operation. Es zeigte sich, dass durch die Zugabe der Immuntherapie eine Steigerung der Rate an pathologischen Komplettremissionen um etwa 16%, von 41,1% auf 57,6%, erzielt werden konnte. Zum jetzigen Zeitpunkt sind aussagekräftige Langzeitdaten in Hinblick auf ereignisfreies Überleben (EFS), krankheitsfreies Überleben (DFS) und Gesamtüberleben (OS)noch ausständig und werden daher bereits mit Spannung erwartet. Die Hazard-Ratios (HR) bei sehr kurzer Nachbeobachtungszeit weisen aber schon jetzt darauf hin, dass im Hinblick auf das Langzeitergebnis möglicherweise ein Vorteil für die Immuntherapie besteht.
Diese Daten sind denen, die im Rahmen der Studie KEYNOTE 522 (Zugabe von Pembrolizumab zu neoadjuvanter Chemotherapie) erhoben worden sind, sehr ähnlich. In beiden Studien konnte man erkennen, dass der PD-L1-Status prognostisch ist, nicht prädiktiv. Das heißt, dass auch Patientinnen mit PD-L1-negativen Tumoren von der Zugabe der Immuntherapie profitieren. Allerdings haben sowohl in der Interventionsgruppe als auch in der Kontrollgruppe Patientinnen mit PD-L1-positiven Tumoren generell eine höhere Rate an pathologischen Komplettremissionen. Zusammenfassend dargestellt liefert die IMpassion-031-Studie Daten, die gut übereinstimmend mit dem schon bekannten Wissen zeigen, dass die Immuntherapie im neoadjuvanten Setting möglicherweise in Zukunft eine Rolle spielen wird. Wie erwähnt fehlen allerdings noch zuverlässige Daten betreffend dasLangzeit-Outcome. Es wird entscheidend sein, dass auch diese einen positiven Effekt der Immuntherapie zeigen, um eine Zulassung erreichen zu können.
Zur adjuvanten Therapie mit „Cyclin dependent kinase 4/6“(CDK-4/6)-Hemmern bei hormonrezeptorpositiver, „human epidermal growth factor receptor 2“(HER2)-negativer Erkrankung bei Patientinnen mit hohem Rückfallrisiko wurden zwei Studien vorgestellt. Wir wissen von Patientinnen in der metastasierten Situation, dass die Addition von CDK-4/6-Hemmern zur Antihormontherapie im Erstliniensetting zu einer Verdoppelung des progressionsfreien Überlebens (PFS) führt. In einigen Studien konnte auch bereits ein Vorteil in Hinblick auf das Gesamtüberleben nachgewiesen werden. Daher ist es schlüssig, diese erfolgreiche Therapiestrategie auch im adjuvanten Setting zu evaluieren.
Nun wurden die ersten Ergebnisse von zwei Studien präsentiert: einerseits die der PALLAS-Studie mit Palbociclib und andererseits jene der MonarchE-Studie mit Abemaciclib. Die Studien waren relativ ähnlich: Über 5700 Patientinnen wurden jeweils eingeschlossen, meist mit fortgeschrittenen Tumoren – das heißt mit ausgedehntem Lymphknotenbefall oder großen Tumoren bzw. erhöhtem Risiko, definiert durch Grading 3 oder höhere Proliferationsrate (in MonarchE). Die Ergebnisse sind jedoch divergent: In PALLAS ergab sich kein Vorteil durch die zusätzliche Verabreichung des CDK-4/6-Hemmers Palbociclib über 2 Jahre, während in MonarchE durch die Zugabe von Abemaciclib eine Verminderung des Rückfallrisikos bei 2 Jahren gezeigt werden konnte. Die 2-Jahres-Rate des Überlebens ohne invasive Krankheit(IDFS) betrug 88,7% in der Kontrollgruppe vs. 92,2% in der Interventionsgruppe. Dies ergibt eine Hazard-Ratio von 0,7.
Es muss allerdings angemerkt werden, dass sich die Studien in einigen Details unterscheiden. In MonarchE war der Großteil der Patientinnen einer Hochrisikosubgruppe zuzuordnen, da alle Patientinnen einen positiven Nodalstatus hatten und 60% vier oder mehr positive Lymphknoten aufwiesen. Diese Rate war in PALLAS niedriger, und 18% der Patientinnen wiesen ein klinisches Stadium 2 auf. Ein zweiter Aspekt ist zu bedenken: Die Therapieabbruchrate war unter Palbociclib höher als unter Abemaciclib. Das ist etwas überraschend, da im metastasierten Setting mehr Therapieabbrüche unter Abemaciclib zu verzeichnen waren. Möglicherweise ist dies darauf zurückzuführen, dass die PALLAS-Studie früher begonnen worden war und dementsprechend die Behandelnden im Management der Toxizität, im Speziellen der Neutropenie, weniger erfahren waren. Heutzutage sollte dies kein Problem mehr darstellen. Eine weitere Möglichkeit wäre natürlich, dass sich auch die Substanzen in ihrer Wirkung im adjuvanten Setting unterscheiden. Dies bleibt zum jetzigen Zeitpunkt offen.
Insgesamt handelt es sich um sehr frühe Studiendaten. Es gilt also, längerfristige Ergebnisse abzuwarten, um diese optimal einordnen zu können. Beim San Antonio Breast Cancer Symposium (SABCS) wird ein Update der MonarchE-Studie erwartet. Wenn sich die Daten bestätigen oder der Effekt mit längerer Nachbeobachtungszeit sogar größer wird, dann ist davon auszugehen, dass für eine Hochrisikopopulation (etwa für Patientinnen, die aufgrund eines ausgedehnten Lymphknotenbefalls ein sehr hohes Rückfallrisiko aufweisen) Abemaciclib in der Adjuvanztherapie zugelassen wird.
Zum metastasierten Mammakarzinom wurden einige Studien im tripelnegativen Setting präsentiert. Was waren aus Ihrer Sicht die relevantesten Ergebnisse?
R. Bartsch: Beim tripelnegativen metastasierten Mammakarzinom lag der Schwerpunkt auch bei diesem ESMO-Meeting ganz klar auf der Immuntherapie. Zwei Studien sind hervorzuheben: IMpassion 131 und IMpassion 130. Auf den ersten Blick handelt es sich um sehr ähnliche Studien: Entweder Nab-Paclitaxel oder konventionelles Paclitaxel +/– Atezolizumab wurde Patienten mit metastasiertem tripelnegativem Mammakarzinom im Erstliniensetting verabreicht.
Die Ergebnisse der IMpassion-130-Studie sind gut bekannt. Der klinisch relevante, wenn auch formal statistisch nicht signifikante Vorteil im Gesamtüberleben hat zur Zulassung in den USA und Europa geführt. Es sind nun die finalen OS-Daten präsentiert worden: Die Zugabe von Atezolizumab zu Nab-Paclitaxel hat zu einer Verlängerung des medianen Gesamtüberlebens der PD-L1-positiven Kohorte von 17,9 auf 25,4 Monate geführt. Neuerlich ist dieser Effekt aufgrund der hierarchischen Analyse statistisch nicht signifikant, muss aber als klinisch relevant angesehen werden. Außerdem darf nicht vergessen werden, dass es sich hier um die besten OS-Daten handelt, die wir je in dieser Population gesehen haben.
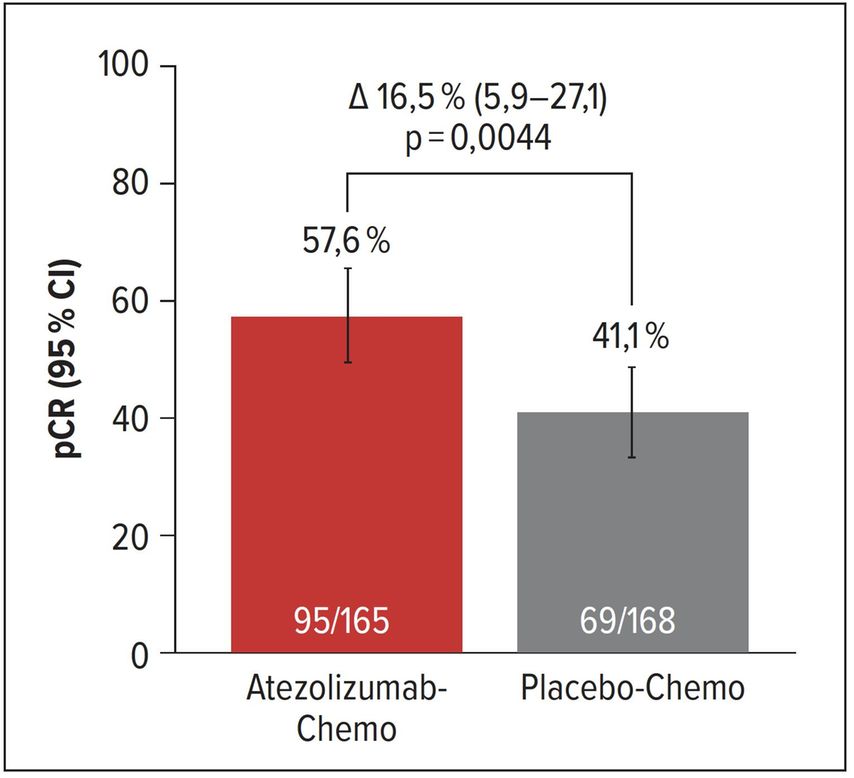
Abb. 1: Rate an pathologischen Komplettremissionen (pCR)in der IMpassion-031-Studie (nach Harbeck N et al.: ESMO Virtual Congress 2020, LBA11)
Verglichen damit sind die Ergebnisse der IMpassion-131-Studie, die erstmals präsentiert worden sind, enttäuschend. Man sieht in einer durchaus vergleichbaren Population keinen Vorteil der Kombinationstherapie aus Atezolizumab und konventionellem Paclitaxel, weder in der Gesamtpopulation noch in der PD-L1-positiven Population. Dies wirft die Frage auf, wie dieser Widerspruch erklärt werden kann. Natürlich wäre ein zufälliges Ergebnis möglich, da die Konfidenzintervalle beider Studien überlappen. Gleichzeitig ist auch bekannt, dass bei konventionellem Paclitaxel eine Begleittherapie mit Kortikosteroiden notwendig ist. Möglicherweise hat dies den Effekt der Immuntherapie hier gestört. Die Kombination von Nab-Paclitaxel und Atezolizumab bleibt also zum jetzigen Zeitpunkt der Standard in der Erstlinienbehandlung des tripelnegativen PD-L1-positiven metastasierten Mammakarzinoms.
Die ASCENT-Studie untersuchte ebenfalls eine Immuntherapie, allerdings in einem weiteren Sinne: Gegenstand der Studie war Sacituzumab govitecan. Es handelt sich hierbei um ein Antikörper-Wirkstoff-Konjugat (ADC), welches einen chemotherapeutischen Wirkstoff mit einem Antikörper kombiniert, der gegen das Trophoblasten-Zelloberflächen-Antigen 2 (Trop-2) gerichtet ist. Trop-2 ist ein Protein, welches an der Oberfläche der meisten tripelnegativen Mammakarzinome exprimiert wird. Die Substanz wurde auf Basis positiver Phase-II-Daten bereits in den USA zugelassen, in Europa ist sie derzeit noch nicht verfügbar.
Nun wurden die Phase-III-Daten bei vorbehandelten Patientinnen präsentiert. Es waren zumindest zwei vorangegangene Chemotherapielinien bei metastasierter Erkrankung verlangt. 529 Patientinnen wurden randomisiert zu Sacituzumab govitecan oder Chemotherapie nach Wahl des Behandlers, in diesem Falle Eribulin, Vinorelbin, Gemcitabin oder Capecitabin. Es lässt sich unter Sacituzumab govitecan klar eine massive Verlängerung des progressionsfreien Überlebens von 1,7 auf 5,6 Monate erkennen sowie auch eine Verdoppelung des Gesamtüberlebens und eine höhere Ansprechrate.
Bezüglich Toxizität traten Grad-3/4-Neutropenien etwas häufiger unter Sacituzumab govitecan als unter Therapie nach Wahl des Behandlers auf. Dies hat bei einem Teil der Patientinnen einen entsprechenden Support mit dem Granulozyten-Kolonie stimulierenden Faktor (G-CSF) notwendig gemacht. Auch Alopezie, Diarrhö und Übelkeit sind mögliche Nebenwirkungen. Trotzdem scheint die Substanz ein durchaus akzeptables Verträglichkeitsprofil aufzuweisen, sie zeigt sich wirksamer als eine konventionelle Chemotherapie bei vorbehandelten Patientinnen mit tripelnegativem metastasiertem Mammakarzinom und weist sicherlich die besten OS-Daten in diesem Setting auf, es handelt sich also um eine vielversprechende Substanz für die Zukunft.
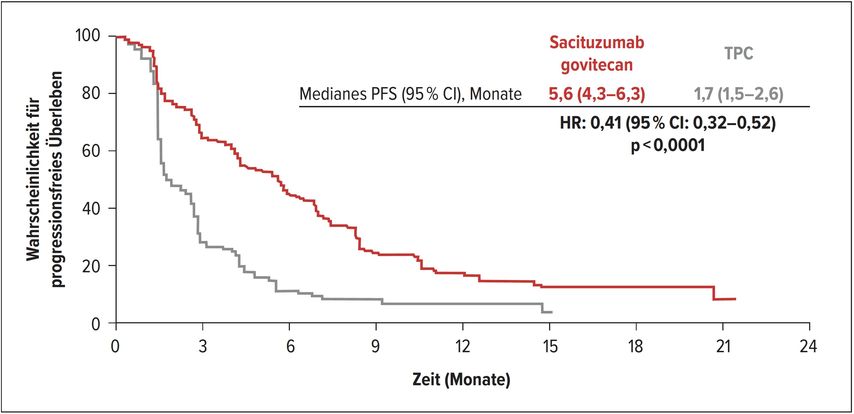
Abb. 2: Progressionsfreies Überleben in der ASCENT-Studie (nach Bardia A et al.: ESMOVirtual Congress 2020, LBA17)
Gab es darüber hinaus Studien, die Sie besonders interessant fanden, auch im Zusammenhang mit Covid-19?
R. Bartsch: Es wurde natürlich eine ganze Reihe spannender Studien vorgestellt. Hervorheben möchte ich noch gern die finale OS-Analyse der SOLAR-1-Studie, welche von Prof. Dr. Fabrice André präsentiert worden ist. Wie bekannt ist, hat die Zugabe von Alpelisib zu Fulvestrant zur endokrinen Therapie bei hormonrezeptorpositiven, HER2-negativen Patientinnen eine Verlängerung des progressionsfreien Überlebens gezeigt. Nun hat sich auch eine Verlängerung des Gesamtüberlebens im gleichen Ausmaß, wenn auch formal statistisch nicht signifikant, gezeigt. Covid-19 war das dominante Thema des Kongresses und hat natürlich das virtuelle Format bedingt. Es wurde eine Vielzahl von Arbeiten präsentiert, die darstellen konnten, wie groß der Einfluss der Covid-19-Pandemie auf die onkologischen Abteilungen und die Versorgung von Tumorpatienten weltweit war. Es bleibt zu hoffen, dass uns diese Problemstellung nicht mehr allzu lange begleiten wird.
Vielen Dank für das Gespräch!
Das Interview führte
Dr. Nicole Leitner
Unser Gesprächspartner:
Assoc. Prof. Priv.-Doz. Dr. Rupert Bartsch
Universitätsklinik für Innere Medizin I
Klinische Abteilung für Onkologie
Medizinische Universität Wien
E-Mail: rupert.bartsch@meduniwien.ac.at
Das könnte Sie auch interessieren:
Gestiegene Lebenserwartung dank neuer Therapien
Assoc.-Prof PD Dr. Karoline Gleixner und Ao. Univ.-Prof. Dr. Wolfgang R. Sperr, beide Universitätsklinik für Innere Medizin I, Medizinische Universität Wien/AKH Wien, leiteten durch die ...
Wie kann ich eine Blutungsneigung quantifizieren?
Eine erhöhte Blutungsneigung ist in der klinischen Praxis eine häufige, aber diagnostisch anspruchsvolle Herausforderung. Standardisierte Blutungsfragebögen sind deswegen ein ...
Ausgezeichnete Studien aus dem Bereich der Hämatologie
Im Rahmen der Jahrestagung der Deutschen, Österreichischen und Schweizerischen Gesellschaften für Hämatologie und Medizinische Onkologie werden jedes Jahr diverse Preise und ...