Fortschritte in der Mastozytosetherapie
Autor:
OA Dr. Alex Stefan
Universitätsklinik für Hämatologie
und internistische Onkologie,
Kepler Universitätsklinikum Linz
E-Mail: stefan@jku.at
Die geltenden Onkopedia-Leitlinien zur systemischen Mastozytose wurden zuletzt im Jänner 2024 aktualisiert. Sie umfassen die indolente systemische Mastozytose (D47.0), die fortgeschrittene systemische Mastozytose (C96.2), die systemische Mastozytose mit assoziierter hämatologischer Neoplasie (C96.2) sowie die Mastzellenleukämie (C94.31).1 Am „Onkopedia Day“ am 20. November 2025 in Wien wurden rezente klinisch relevante Studienergebnisse vorgestellt und anstehende Ergänzungsvorschläge zu dieser Leitlinie diskutiert.
Mastzellaktivierungssyndrom
In den vergangenen Jahren ist die Zahl der Patient:innenanfragen zum Mastzellaktivierungsyndrom (MCAS) an die Fachambulanzen deutlich angestiegen. Aus klinischer Perspektive bestätigen dies auch Expert:innen wie Prof. Peter Valent in Netzwerk-Meetings, etwa der Konferenz des Europäischen Kompetenznetzwerks für Mastozytose (ECNM). Diese Entwicklung wird in der Fachwelt teilweise als „MCAS-Pandemie der Wahrnehmung“ beschrieben. In der wissenschaftlichen Literatur wird MCAS als zunehmend beachtetes klinisches Syndrom dargestellt, wobei diagnostische Unsicherheiten und Forschungsbedarf bestehen.
Für MCAS und verwandte Erkrankungen (D89.4) können folgende ICD-Codes verwendet werden:2
-
D89.40 Mastzellaktivierung, nicht näher bezeichnet
-
D89.41 Monoklonales Mastzellaktivierungssyndrom
-
D89.42 Idiopathisches Mastzellaktivierungssyndrom
-
D89.43 Sekundäre Mastzellaktivierung
-
D89.44 Hereditäre Alpha-Tryptasämie
-
D89.49 Sonstige Mastzellaktivierungsstörung
Häufig basieren die Anfragen der Patient:innen auf einer Fehlinterpretation von im Internet verfügbaren Informationen. Nach genauer Evaluierung liegt dann schlussendlich kein echtes MCAS vor. Um solche Unklarheiten zwischen Hausärzten, Patient:innen und Fachambulanzen, die nicht oft mit dem MCAS konfrontiert sind, zu vermeiden, wurden am Onkopedia Day die 2022 publizierten diagnostischen Kriterien für MCAS aus dem Konsortium „Global Classification of Mast Cell Activation Disorders: An ICD-10-CM-Adjusted Proposal of the ECNM-AIM Consortium“3 vorgestellt (Tab.1).
Indolente systemische Mastozytose
Avapritinib
Die größte Änderung in der Leitlinie betrifft die indolente systemische Mastozytose (ISM) , bei der erstmals eine TKI-Therapie mit Avapritinib zusätzlich zur symptomorientierten Basistherapie unabhängig vom KIT-Mutationsstatus zur Verfügung steht. Avapritinib wurde von EMA im Dezember 2023 zugelassen und basiert auf der placebokontrollierten, doppelblinden PIONEER-Studie.4 Mit der täglichen Dosierung von 25mg erreichten die Patient:innen eine signifikante Verbesserung der Symptome („total symptom score“, TSS) sowie eine Reduktion der Serumtryptase und der KIT D816V VAF-Last.
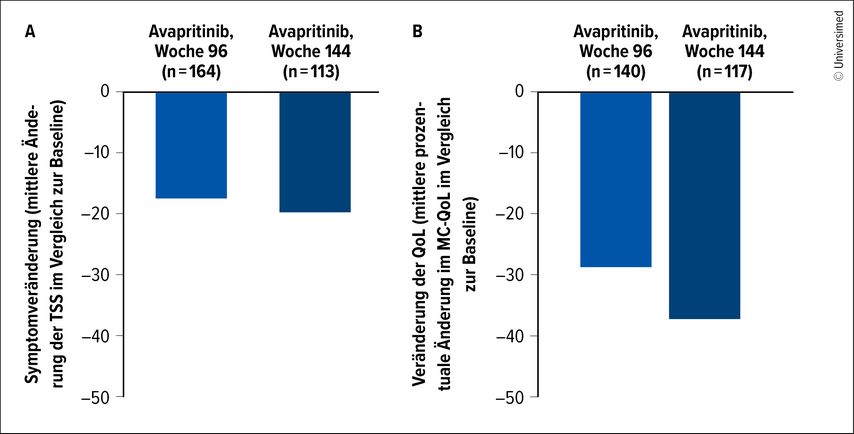
Die Langzeitdaten mit drei Jahren medianem Follow-up (präsentiert beim ASH 2024) demonstrierten eine anhaltende Verbesserung der Symptome und der Lebensqualität nach 96 und 144 Wochen der Avapritinib-Therapie (Abb.1). Therapiebezogene Nebenwirkungen (TRAE) Grad ≥3 wurden bei 6% der Patient:innen beobachtet, wobei am häufigsten periphere und periorbitale Ödeme auftraten. TRAE führten aber nur bei 3% der Patient:innen zum Therapieabbruch.4
Abb. 1: Langfristige Wirksamkeit für (A) TSS und (B) MC-QoL in der Patient:innenpopulation mit Avapritinib 25mg einmal täglich (QD) nach 96 und 144 Wochen (modifiziert nach Castells M et al.)4
Eine weitere wichtige klinische Bedeutung hat Avapritinib auch für die Verbesserung der Knochendichte (BMD), wobei die Veränderungen der BMD an der Lendenwirbelsäule besonders ausgeprägt waren.5 Dies ist die häufigste Frakturstelle bei Patient:innen mit indolenter systemischer Mastozytose (ISM).6,7 Die Kassenpreise der Therapie mit Avapritinib bleiben jedoch ziemlich hoch, sodass diese Therapieoption von Mastozytoseexpert:innen oft nur nach Erschöpfung der Basistherapiekombination erwogen wird. Eine wichtige Alternative können aber klinische Studien anbieten.
Bezuclastinib
Eine absehbar baldige Zulassung erwartet Bezuclastinib, das bereits eine „FDA breakthrough therapy designation“ nach den Ergebnissen der doppelblinden, placebokontrollierten SUMMIT-Studie bekommen hat. Patient:innen mit ISM sowie mit „smoldering“ systemischer Mastozytose (SSM) und „Bone marrow“-Mastozytose (BMM) hatten moderate bis hohe Krankheitslast (TSS betrug median 55 bei einem Maximalscore von 105).
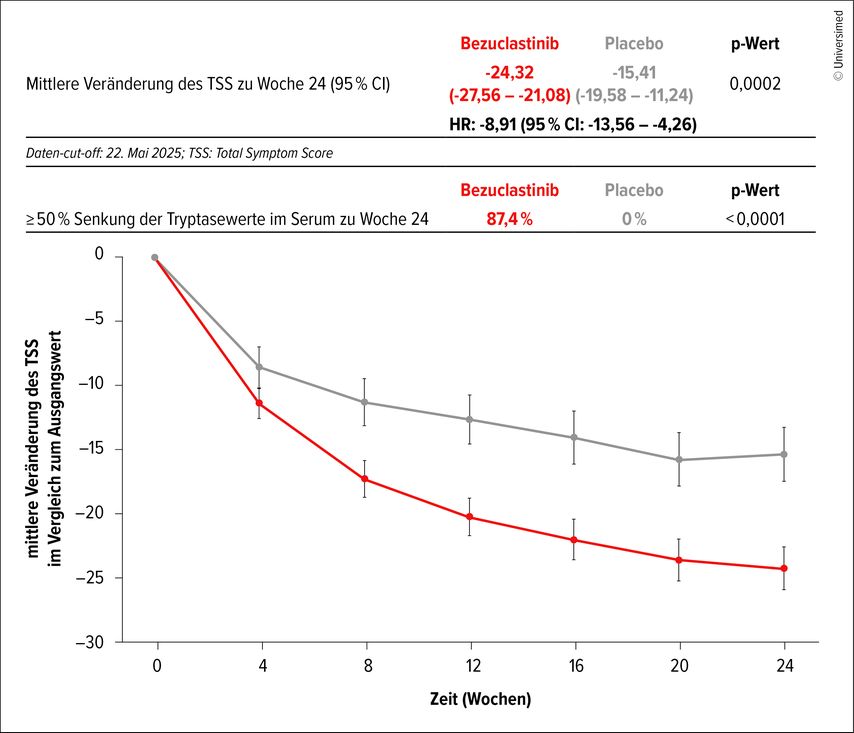
Primärer Endpunkt war die mittlere Veränderung des TSS in Woche 24, er wurde erreicht (p=0,0002) (Abb.2). Weitere sekundäre Endpunkte wurden ebenfalls erreicht: ≥50% Reduktion der Serum-Tryptase (p<0,0001), ≥50% Reduktion von KIT-D816V-VAF (p<0,0001), ≥50% Reduktion des TSS (p=0,0142), ≥50% Reduktion der Mastzellen im Knochenmark (MC) (p<0,0001), ≥30% Reduktion des TSS (p=0,0004) sowie die mittlere Veränderung des stärksten Symptomscores (p=0,0001).
Abb. 2: Behandlung mit Bezuclastinib: Ergebnisse der klinisch relevanten Abnahme von durch Patient:innen berichtete Symptome und der objektiven Messung der Krankheitslast (modifiziert nach Cogent Biosciences)8
Bezuclastinib zeigte auch ein günstiges und gut handhabbares Sicherheitsprofil: Die Mehrheit der TRAE war niedriggradig (70% Grad 1) und reversibel. Eine größere Vielfalt an unerwünschten Ereignissen trat häufiger in der Placebogruppe auf. Nur 5,9% der Patient:innen zeigten Therapieabbrüche wegen ALT/AST-Erhöhungen ≥Grad 3 und bei allen Betroffenen kam es zu einer vollständigen Rückbildung.8
Elenestinib
Elenestinib ist ein neuer Next-Generation-TKI, der potent und selektiv KITD816V inhibiert und Wild-type-KIT ausspart. Für die anstehende Zulassung wird die Substanz derzeit im Teil 2 der HARBOR-Studie bei den Patient:innen mit ISM und MCAS untersucht. Elenestinib zeigte ein ähnlich gutes Safety-Profil und eine signifikante Reduktion aller Biomarker der Krankheitslast.9
Fortgeschrittene systemische Mastozytose (ASM)
Midostaurin
Midostaurin ist ein zielgerichteter Kinaseinhibitor, der seit 2017 von der EMA für die Behandlung der aggressiven systemischen Mastozytose (ASM), der systemischen Mastozytose mit assoziierter hämatologischer Neoplasie (SM-AHN) und der Mastzellleukämie (MCL) zugelassen ist.
Die Zulassungsstudie war eine einarmige Phase-II-Studie, die unabhängig vom KIT-Mutationsstatus eine Responserate von 60% mit einem medianen Gesamtüberleben (OS) von 28,7 Monaten und einem medianen progressionsfreiem Überleben (PFS) von 14,1 Monaten gezeigt hat.10
Es war die erste On-Label-Zulassung nach dem vorhergehenden Off-Label-Einsatz von Cladribin für die Behandlung von systemischer Mastozytose.
Avapritinib
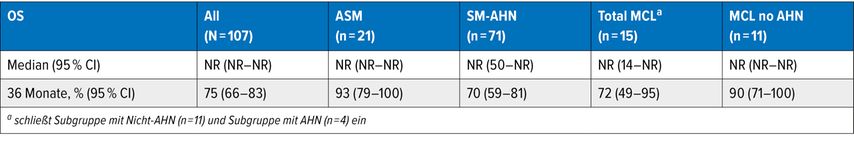
Seit 2023 steht Avapritinib zur Behandlung von ASM nach zumindest einer systemischen Therapie zur Verfügung. Das letzte Update mit drei Jahren Follow-up (Data-cut-off September 2023) der Zulassungsstudie PATHFINDER bestätigte die sehr gute Wirksamkeit von Avapritinib in allen Risikogruppen (MARS-R-Score), in denen das mediane OS noch nicht erreicht wurde, obwohl die meisten Patient:innen mit Midostaurin vorbehandelt waren (Tab.2).11
Tab. 2: Medianes Gesamtüberleben unter Avapritinib, PATHFINDER-Studie mit 3 Jahren Follow-up (modifiziert nach Reiter A et al.)11
Am ASH 2024 wurden die Daten des OS und der Behandlungsdauer bei Patient:innen mit fortgeschrittener systemischer Mastozytose unter Avapritinib im Vergleich zu Midostaurin oder der bestverfügbaren Therapie in einer Real-World-Situation präsentiert (Abb.3),12 wobei der Einsatz von Avapritinib in der ersten Therapielinie noch nicht mit einem randomisierten direkten Vergleich belegt ist.
Abb. 3: Ereignisfreies Überleben (EFS) für Avapritinib und Midostaurin in der Erstlinientherapie der ASM (modifiziert nach Reiter A et al.)12
Bezuclastinib
Eine zeitnahe Zulassung von Bezuclastinib für ASM, MCL und vor allem SM-AHN wird nach der Veröffentlichung der Phase-II-Studie APEX erwartet. Die Daten zeigten >50% Reduktion der Tryptase und KITD816V VAF bei >90% der Patient:innen sowie >50% Reduktion der Mastzellenlast im Knochenmark bei allen Patient:innen. Das PFS lag bei 82% nach 24 Monaten, wobei medianes PFS und mediane Ansprechdauer noch nicht erreicht sind. Die häufigsten AE waren hämatologischer Natur sowie eine Erhöhung der Transaminasen, aber nur zwei Patient:innen beendeten deswegen die Therapie.13
Zusammenfassung
Die systemische Mastozytose umfasst eine heterogene Gruppe seltener klonaler Mastzellneoplasien mit unterschiedlicher Prognose und unterschiedlichem Verlauf. Die rasante Entwicklung der neuen TKI für alle Subentitäten hat eine deutliche Verbesserung der Symptome, Lebensdauer und Lebensqualität gebracht.
Literatur:
1 Onkopedia-Leitlinie „systemische Mastozytose“ ( www.onkopedia.com ) 2 ICD10-Data: www.icd10data.com/ICD10CM/Codes/D50-D89/D80-D89/D89-/D89.4 3 Valent P et al.: Global classification of mast cell activation disorders: an ICD-10-CM-adjusted proposal of the ECNM-AIM consortium. J Allergy Clin Immunol Pract 2022; 10(8): 1941-50 4 Castells M et al.: Long-term quality of life and safety in patients with indolent systemic mastocytosis treated with avapritinib in the PIONEER study. Presented at the 2025 AAAAI/WAO Joint Congress, San Diego/USA 5 Siebenhaar F et al.: Avapritinib and bone health in indolent systemic mastocytosis: learnings from the PIONEER trial. Presented at the 2025 AAAAI/WAO Joint Congress, San Diego/USA 6 Black DM et al.: Treatment-related changes in bone mineral density as a surrogate biomarker for fracture risk reduction: meta-regression analyses of individual patient data from multiple randomised controlled trials. Lancet Diabetes Endocrinol 2020; 8: 672-82 7 van der Veer E et al.: High prevalence of fractures and osteoporosis in patients with indolent systemic mastocytosis. Allergy 2012; 67: 431-8 8 Cogent Biosciences: SUMMIT trial: bezuclastinib in NonAdvSM patients top-line results ( https://investors.cogentbio.com/static-files/4c7e1e71-0a3e-49b9-ba6c-683a703e308a ) 9 Castells M et al.: P1017: HARBOR, a phase 2/3 study of BLU-263 in patients with indolent systemic mastocytosis and monoclonal mast cell activation syndrome. Hemasphere 2022; 6(Suppl): 907-8 10 Gotlib J et al.: Efficacy and safety of midostaurin in advanced systemic mastocytosis. N Engl J Med 2016; 374(26): 2530-41 11 Reiter A et al.: Avapritinib in patients with advanced systemic mastocytosis (AdvSM): efficacy and safety analysis from the phase 2 PATHFINDER study with 3-year follow-up. Presented at the 2024 European Hematology Association (EHA) Conference, Madrid/Spanien 12 Reiter A et al.: Overall survival and duration of treatment in patients with advanced systemic mastocytosis receiving avapritinib versus midostaurin or best available therapy in a real-world setting. Blood 2024; 144 (Suppl. 1): 1801 13 DeAngelo DJ et al.: Apex part 1: updated assessment of bezuclastinib (CGT9486), a selective KITD816V tyrosine kinase inhibitor, in patients with advanced systemic mastocytosis (AdvSM). Blood 2024; 144 (Suppl. 1): 659
Das könnte Sie auch interessieren:
Gestiegene Lebenserwartung dank neuer Therapien
Assoc.-Prof PD Dr. Karoline Gleixner und Ao. Univ.-Prof. Dr. Wolfgang R. Sperr, beide Universitätsklinik für Innere Medizin I, Medizinische Universität Wien/AKH Wien, leiteten durch die ...
Wie kann ich eine Blutungsneigung quantifizieren?
Eine erhöhte Blutungsneigung ist in der klinischen Praxis eine häufige, aber diagnostisch anspruchsvolle Herausforderung. Standardisierte Blutungsfragebögen sind deswegen ein ...
Ausgezeichnete Studien aus dem Bereich der Hämatologie
Im Rahmen der Jahrestagung der Deutschen, Österreichischen und Schweizerischen Gesellschaften für Hämatologie und Medizinische Onkologie werden jedes Jahr diverse Preise und ...

%20f%C3%BCr%20Avapritinib%20und%20Midostaurin.jpg)