Vorsorge des Zervixkarzinoms
Autoren:
Ao. Univ.-Prof. Dr. Elmar Joura
Dr. Valentina Paspalj
Klinische Abteilung für Allgemeine Gynäkologie und gynäkologische Onkologie,
Universitätsklinik für Frauenheilkunde, Medizinische Universität Wien
E-Mail: elmar.joura@meduniwien.ac.at
Die HPV-Impfung als Präventionsmaßnahme und der HPV-Test als verlässliches Diagnosetool bilden das Fundament in der Vorsorge gegen das Zervixkarzinom. Wer und zu welchem Zeitpunkt geimpft und getestet werden soll und warum die Impfung auch bei Frauen und Männern bis 45 Jahre und bei Patientinnen nach Konisation empfohlen ist, wird in diesem Artikel beleuchtet.
Zwei Prozent aller weiblichen Krebserkrankungen gehen auf das Zervixkarzinom zurück. Unter den invasiven Karzinomen ist das Zervixkarzinom die zweithäufigste Diagnose bei Frauen unter 45 Jahren. Durch die Einführung des sogenannten „Krebsabstrichs“ konnte die Inzidenz in Österreich in den letzten Jahrzehnten deutlich gesenkt werden. Durch die Grenzen der Methode kommt es aber zur Stagnation.
Humane Papillomaviren
Persistente, d.h. über mehr als zwei Jahre bestehende HPV-Infektionen sind die entscheidende Ursache für die Entstehung eines Zervixkarzinoms sowie dessen unmittelbarer Vorstufen (HSIL, „high grade squamous intraepithelial lesions“ und AIS, „adenocarcinoma in situ“).1 Ca. 70% aller Zervixkarzinome sind auf eine persistente HPV-16- oder -18-Infektion zurückzuführen.2
Daraus ergibt sich logischerweise, dass die primäre Prävention durch die Impfung und die sekundäre Prävention durch den Nachweis oder Ausschluss einer onkogenen HPV-Infektion am effektivsten sind. Daher muss das Ziel von uns Frauenärztinnen und Frauenärzten sein, dies auch entsprechend den WHO-Vorgaben umzusetzen und damit für unsere Patientinnen die größtmögliche Sicherheit zu erreichen.
Prävention – die HPV-Impfung
Die erste Generation der HPV-Impfungen war in der Verhinderung von HPV-16/18-Infektionen und Krebsvorstufen sowie in der Abwendung der Entstehung von Genitalwarzen hocheffektiv. Besonders ein frühes Impfalter und eine gute Durchimpfungsrate sind entscheidend.3–5 Inzwischen ist zusätzlich auch der Nachweis gelungen, dass invasive Zervixkarzinome tatsächlich verhindert werden.6, 7 Doch die HPV-Impfung verhindert nicht nur das Zervix-, Vulva- und Vaginalkarzinom, sondern ebenso das Anal- und Peniskarzinom und wahrscheinlich auch HPV-assoziierte oropharyngeale Karzinome. Seit 2016 ist in Österreich mit der neun-valenten HPV-Impfung die zweite Generation der Impfungen verfügbar. Hier werden 95–100% der Erkrankungen, die durch die neun gefährlichsten HPV-Stämme ausgelöst werden, verhindert.8,9
Unter anderem auch deswegen ist die Impfung in Österreich für alle Mädchen und Buben ab dem vollendeten 9. Lebensjahr empfohlen.10–12Außerdem kann durch die Impfung beider Geschlechter die Infektionskette durchbrochen und eine Herdenimmunität erreicht werden.13 Die Impfempfehlung beschränkt sich jedoch nicht ausschließlich auf die Gruppe der Kinder und Jugendlichen. Die Inzidenz für eine HPV-Infektion ist zwar in den ersten 5–10 Jahren nach den ersten sexuellen Erfahrungen am höchsten, dennoch besteht auch danach ein Risiko, sich mit HPV zu infizieren und eine HPV-assoziierte Erkrankung zu entwickeln.14
Zudem zeigt sich ein weiterer Anstieg der Inzidenz für HPV-Infektionen und HPV-assoziierte Erkrankungen bei Frauen im vierten und fünften Lebensjahrzehnt.15 Für die HPV-Impfung ist es deshalb wohl „nie zu spät“, sie sollte aber zumindest bis zum 30. Lebensjahr (laut österreichischem Impfplan)16 empfohlen werden. Studien konnten aber zeigen, dass Frauen bis 45 Jahre deutlich von der Impfung profitieren. So erkranken geimpfte Frauen dreimal seltener an HPV-assoziierten Erkrankungen als ungeimpfte Frauen im Alter bis 45 Jahre.17,18
Auch Frauen, die bereits eine HPV-assoziierte Erkrankung entwickelt haben und sich beispielsweise bereits einer Konisation unterziehen mussten, profitieren von der prophylaktischen HPV-Impfung. Diesen Hochrisikopatientinnen sollte am besten die Impfung kurz vor oder nach der Konisation empfohlen werden. Die HPV-Impfung kann bei diesen Hochrisikopatientinnen das Rezidivrisiko um zwei Drittel senken.19,20
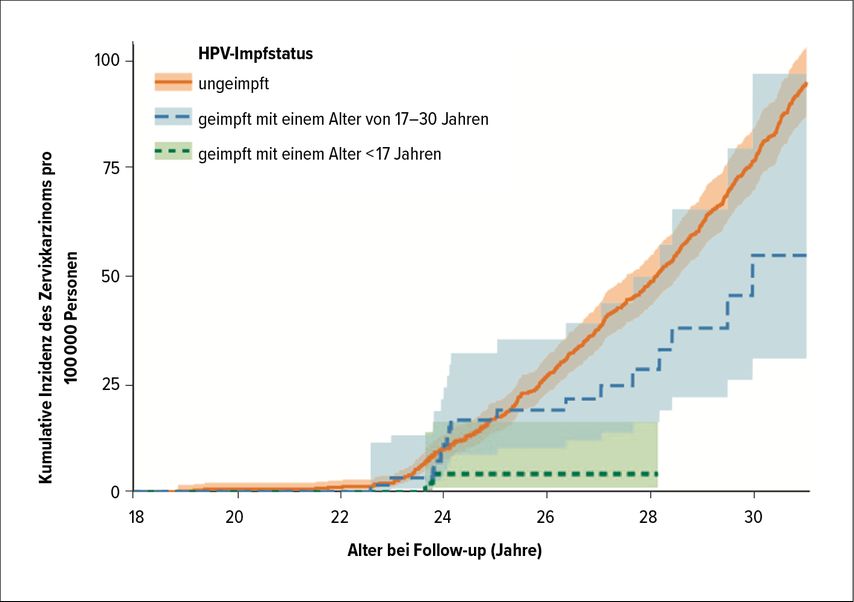
Abb. 1: Kumulative Inzidenz von invasivem Gebärmutterhalskrebs in Abhängigkeit vom HPV-Impfstatus (mod. nach Lei et al. 2020)6
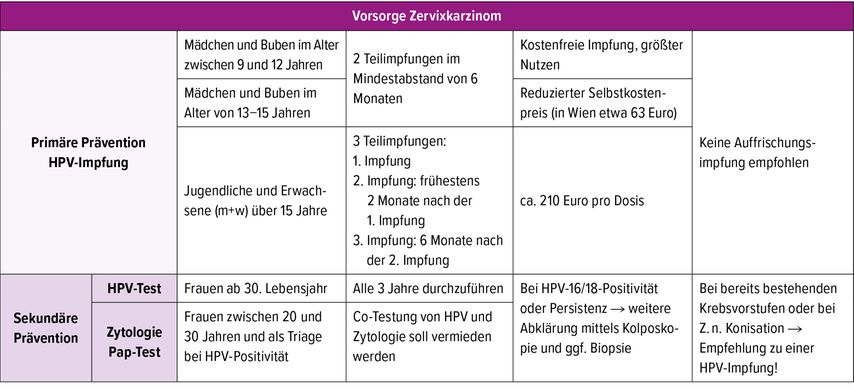
Tab. 1: Übersicht über primäre und sekundäre Präventionsmaßnahmen in der Vorsorge gegen das Zervixkarzinom
Früherkennung – der HPV-Test
Neben der Impfempfehlung ist die Erkennung der HPV-Infektion und von HPV-assoziierten Erkrankungen bzw. Krebsvorstufen wesentlich in der Vorsorge gegen das Zervixkarzinom. Das bisher in Österreich etablierte opportunistische Screening mittels Zytologie (Pap-Abstrich) sollte entsprechend der Datenlage mittelfristig durch ein primäres HPV-Screening (ab dem 30. Lebensjahr) ergänzt bzw. ersetzt werden. Dabei wäre hier ein organisiertes nationales Screening-Programm der opportunistischen Vorsorge überlegen.
In einer Metaanalyse von vier großen Studien zeigte sich, dass das HPV-basierte Screening im Vergleich zur Zytologie einen 60–70% höheren Schutz vor invasiven Zervixkarzinomen bietet.21 Dabei zeigt sich, dass der HPV-Test eine 1,5-mal höhere Sensitivität als der Pap-Test hat. Es ist daher unwahrscheinlich, eine hochgradige Präkanzerose (HSIL) mittels HPV-Testsnicht zu detektieren. Somit erreicht der negative prädiktive Wert eines HPV-Tests fast 100%. Das bedeutet, dass bei einem negativen HPV-Test weitgehend ausgeschlossen werden kann, dass ein Zervixkarzinom oder eine präkanzeröse Läsion vorliegt. Zumal zwischen der initialen HPV-Infektion und der Entstehung eines invasiven Karzinoms eine Latenz von mehreren Jahren angenommen wird. Ein zytologischer Befund hat im Gegensatz dazu eine viel höhere Wahrscheinlichkeit einer falschen Negativität. Dadurch steigt das Risiko, dass behandlungsbedürftige Zervixkarzinome oder Präkanzerosen unentdeckt bleiben.
Das Risiko, in den ersten fünf Jahren nach einem negativen HPV-Test ein Zervixkarzinom zu entwickeln, ist ähnlich dem Risiko in den ersten zwei Jahren nach einem negativen zytologischen Befund.22
Die bisherigen Daten sprechen für den Beginn des HPV-basierten Screenings ab einem Alter von 30 Jahren. In Österreich ist eine Wiederholung alle 3 Jahre empfohlen. Bei den HPV-Tests stehen mehrere Anbieter zur Auswahl, wobei die Subtypisierung der High-Risk-Typen 16 und 18 auf jeden Fall beinhaltet sein sollte und der Test klinisch validiert sein soll. Deshalb ist es auch unbedingt notwendig, dass das Labor den verwendeten Test beim Ergebnis anzeigt. Der Nachweis einer Infektion mit einem High-Risk-Subtyp liefert zusätzliche prädiktive und prognostische Informationen und gibt Anlass für weitere diagnostische Schritte, wie eine Kolposkopie und ggf. histologische Probengewinnung.
Die Zytologie ist zwischen dem 20. und 30. Lebensjahr der bevorzugte Suchtest und dient ebenso als Triagetest bei einem positiven HPV-Test. Eine Co-Testung von HPV und Zytologie sollte vermieden werden.
Neben HPV 16 und 18 gibt es noch andere Hochrisiko-Subtypen, die man berücksichtigen sollte. Der dritthäufigste onkogene HPV-Subtyp in Europa ist HPV 33. Aus Studien geht hervor, dass HPV 33 ein ähnlich onkogenes Potenzial wie HPV 16 hat. Außerdem ist HPV 33 vor allem für Karzinome bei Frauen über 45 Jahre ursächlich.23 Es ist daher auf jeden Fall empfehlenswert, bei einer persistenten HPV-Pool-Positivität eine Typisierung durchzuführen. Nach einem positiven HPV-16/18-Test bzw. bei einer HPV-Persistenz besteht der Goldstandard darin, eine Kolposkopie und ggf. bei Auffälligkeiten eine Biopsie durchzuführen.
Zusammenfassung
Unter den invasiven Karzinomen ist das Zervixkarzinom in Österreich die zweithäufigste Diagnose bei Frauen unter 45 Jahren. Persistente HPV-Infektionen sind mehrheitlich für die Entstehung von Präkanzerosen und Zervixkarzinomen ursächlich. Die frühzeitige HPV-Impfung (im Alter zwischen neun und zwölf Jahren) und eine primäre HPV-Testung (ab dem 30. Lebensjahr) sind die zwei wichtigsten Eckpfeiler in der Vorsorge gegen das Zervixkarzinom. Nicht nur HPV-naive Mädchen und Frauen profitieren von der Impfung. Die HPV-Impfung ist für Frauen und Männer bis 30 Jahre empfohlen und sicher bis 45 Jahre sinnvoll. HPV 33 ist der dritthäufigste onkogene HPV-Subtyp und hat ein ähnlich onkogenes Potenzial wie HPV 16.
Literatur:
1 Walboomers JM et al.: Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol 1999; 189(1): 12-9 2 Muñoz N et al.: International Agency for Research on Cancer Multicenter Cervical Cancer Study Group: Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003; 348(6): 518-27 3 Garland SM et al.: Females united to unilaterally reduce endo/ectocervical disease (FUTURE) I investigators. Quadrivalent vaccine against human papillomavirus to prevent anogenital diseases. N Engl J Med 2007; 356(19): 1928-43 4 FUTURE II Study Group: Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions. N Engl J Med 2007; 356(19): 1915-27 5 Drolet M et al.: HPV vaccination impact study group. Population-level impact and herd effects following the introduction of human papillomavirus vaccination programmes: updated systematic review and meta-analysis. Lancet 2019; 394(10197): 497-509 6 Lei J et al.: HPV vaccination and the risk of invasive cervical cancer. N Engl J Med 2020; 383(14): 1340-8 7 Nygård M et al.: Human papillomavirus genotype-specific risks for cervical intraepithelial lesions. Hum Vaccin Immunother 2021; 17(4): 972-981 8 Joura EA et al.: A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women. N Engl J Med 2015; 372(8): 711-23 9 Ferris DG et al.: Prevalence, incidence, and natural history of HPV infection in adult women ages 24 to 45 participating in a vaccine trial. Papillomavirus Res 2020; 10: 100202 10 Giuliano AR et al.: Efficacy of quadrivalent HPV vaccine against HPV infection and disease in males. N Engl J Med 2011; 364(5): 401-11 11 Palefsky JM et al.: HPV vaccine against anal HPV infection and anal intraepithelial neoplasia. N Engl J Med 2011; 365(17): 1576-85 12 Marur S et al.: HPV-associated head and neck cancer: a virus-related cancer epidemic. Lancet Oncol 2010; 11(8): 781-9 13 Ali H et al.: Genital warts in young Australians five years into national human papillomavirus vaccination programme: national surveillance data. BMJ 2013; 346: f2032 14 Woodman CB et al.: Natural history of cervical human papillomavirus infection in young women: a longitudinal cohort study. Lancet 2001; 357(9271): 1831-6 15 de Sanjosé S et al.: Worldwide prevalence and genotype distribution of cervical human papillomavirus DNA in women with normal cytology: a meta-analysis. Lancet Infect Dis 2007; 7(7): 453-9 16 Bundesministerium für Soziales, Gesundheit, Pflege und Konsumentenschutz (BMSGPK) (Hg.): Impfplan Österreich, 2021 17 Muñoz N et al.: Safety, immunogenicity, and efficacy of quadrivalent human papillomavirus (types 6, 11, 16, 18) recombinant vaccine in women aged 24-45 years: a randomised, double-blind trial. Lancet 2009; 373(9679): 1949-57 18 Castellsagué X et al.: End-of-study safety, immunogenicity, and efficacy of quadrivalent HPV (types 6, 11, 16, 18) recombinant vaccine in adult women 24-45 years of age. Br J Cancer 2011; 105(1): 28-37 19 Joura EA et al.: Effect of the human papillomavirus (HPV) quadrivalent vaccine in a subgroup of women with cervical and vulvar disease: retrospective pooled analysis of trial data. BMJ 2012; 344: e1401 20 Jentschke M et al.: Prophylactic HPV vaccination after conization: a systematic review and meta-analysis. Vaccine 2020; 38(41): 6402-9 21 Ronco G et al.: Efficacy of HPV-based screening for prevention of invasive cervical cancer: follow-up of four European randomised controlled trials. Lancet 2014; 383(9916): 524-32 22 Koliopoulos G et al.: Cytology versus HPV testing for cervical cancer screening in the general population. Cochrane Database Syst Rev 2017; 8(8): CD008587 23 Demarco M et al.: A study of type-specific HPV natural history and implications for contemporary cervical cancer screening programs. EClinicalMedicine 2020; 22: 100293
Das könnte Sie auch interessieren:
Künstliche Intelligenz in der Brustpathologie
Die Einführung von künstlicher Intelligenz (KI) markiert einen Paradigmenwechsel in der Pathologie – insbesondere in der Brustpathologie. Validierte KI-Tools steigern bereits heute ...
Postpartale Blutung im Fokus
Wenn sich die Sonne über dem Tafelberg erhebt und das goldene Licht über Kapstadt legt, ahnt man kaum, dass sich hier im Oktober 2025 mehr als 8000 Fachpersonen aus über 130 Ländern ...
Muss das duktale Carcinoma in situ noch operativ behandelt werden?
Das duktale Carcinoma in situ (DCIS) ist ein möglicher Vorläufer des invasiven Mammakarzinoms, wird jedoch zunehmend als heterogene Entität erkannt, sodass eine Standardtherapie mit ...