Die operative Therapie des Vulvakarzinoms
Autor:
Assoc. Prof. PD Dr. Christoph Wohlmuth
Universitätsklinik für Gynäkologie und Geburtshilfe
Medizinische Universität Graz
E-Mail: christoph.wohlmuth@medunigraz.at
Daten des deutschen Krebsregisters zeigen, dass sich die Inzidenz des Vulvakarzinoms in den letzten 20 Jahren mehr als verdoppelt hat. Im Vergleichszeitraum ist die Inzidenz des Zervixkarzinoms deutlich zurückgegangen.1 Hinsichtlich Therapie und Prognose des Vulvakarzinoms ist eine möglichst frühzeitige Diagnose entscheidend.
Keypoints
-
Zur exakten Diagnose und Therapieplanung des Vulvakarzinoms sollte ein „Vulvamapping“ mit Biopsie aller suspekten Areale erfolgen, wobei die entnommenen Biopsien mittels Skizze und Beschreibung exakt dokumentiert werden sollten.
-
Die lokal-radikale Exzision stellt die primäre Therapie beim lokalisierten Vulvakarzinom dar.
-
Die Exzision soll allseits im Gesunden erfolgen, wobei ein optimaler „cut-off“ für den Sicherheitsabstand basierend auf der derzeitigen Datenlage nicht gegeben werden kann. Die ESGO hält derzeit >2–3mm, insbesondere bei anatomisch kritischen Strukturen (z.B. Urethra, Anus), für ausreichend.
-
Abhängig von der möglichen spannungsfreien Wunddeckung, der Funktionalität und der bestmöglichen anatomischen Rekonstruktion erfolgt der Defektverschluss des Tumors mittels primären Wundverschlusses oder des Einsatzes plastisch rekonstruktiver Maßnahmen.
-
Eine operative Lymphknotenevaluation sollte bei allen Karzinomen über 2cm im Durchmesser oder mehr als 1mm Invasionstiefe (>FIGO IA) erfolgen.
-
Bei kleinen, unifokalen Karzinomen <4cm sollte die Sentinellymphknotentechnik eingesetzt werden.
Maligne Erkrankungen der Vulva umfassen Plattenepithelkarzinome (76,4%),Basalzellkarzinome (8,0%), Melanome (5,8%), Morbus Paget der Vulva (5,8%), Adenokarzinome, Sarkome sowie andere seltene Entitäten (zusammen etwa 4%).2,3 Zu den Risikofaktoren für Plattenepithelkarzinome der Vulva zählen fortgeschrittenes Alter, HIV, Nikotinabusus, HPV-Infektion und chronisch-entzündliche Vulvaerkrankungen. Die präinvasive Vorläuferläsion, die vulväre intraepitheliale Neoplasie (VIN), wird in zwei Kategorien unterteilt: die HPV-abhängige „usual-type VIN (uVIN)“ und die HPV-unabhängige „differentiated VIN (dVIN)“, wobei Letztere stark mit Lichen sclerosus und Lichen planus assoziiert ist. Zur Differenzialdiagnose dient dabei die immunhistochemische Färbung von p16 und p53. Während uVIN und das HPV-assoziierte Plattenepithelkarzinom typischerweise positiv für p16 und negativ für p53 sind, sind dVIN und HPV-unabhängige Plattenepithelkarzinome negativ für p16 und häufig positiv für p53.
Verdächtige Läsionen frühzeitig biopsieren
Plattenepithelkarzinome können sich asymptomatisch oder mit Juckreiz, lokalen Irritationen oder Schmerzen präsentieren. Um eine möglichst frühe Diagnose zu gewährleisten, sollte daher jede verdächtige Läsion biopsiert und die exakte Lokalisation der Biopsien im Sinne eines „Vulvamappings“ dokumentiert (mit Skizze und Beschreibung) werden.
Die Stadieneinteilung des Vulvakarzinoms erfolgt sowohl durch das TNM- als auch durch das FIGO-Staging, wobei Letzteres 2021 aktualisiert und basierend auf rezenten Daten des nationalen amerikanischen Krebsregisters von elf auf acht prognostische Gruppen reduziert wurde.
Operative Behandlung des Primärtumors
Die operative Behandlung sollte möglichst in einem Zentrum mit entsprechender Expertise in der Behandlung des Vulvakarzinoms erfolgen – nicht zuletzt wegen der relativen Seltenheit im Vergleich zu anderen gynäkologischen Malignomen.
Bei lokalisierten Tumoren stellt die operative Resektion, wenn möglich, die primäre Therapiemodalität dar. Auch wenn große randomisierte Studien fehlen, hat eine Cochrane-Analyse gezeigt, dass die radikaletotale Vulvektomie der lokal-radikalen Exzision in onkologischer Sicherheit nicht überlegen ist, aber mit mehr Komplikationen assoziiert ist, sodass die lokal-radikale Exzision als Standardtherapie angesehen wird. Bei multifokaler Erkrankung ist eine lokal-radikale Exzision der einzelnen Herde gegenüber einer Vulvektomie abzuwägen.4
Traditionell wurde ein minimaler onkologischer Sicherheitsabstand von 8mm gefordert. Dies geht auf eine US-amerikanische Beobachtungsstudie aus dem Jahr 1990 zurück, die auf ein erhöhtes Lokalrezidivrisiko bei jenen Tumoren hinwies, bei denen die Exzision mit einem pathologischen Sicherheitsabstand von unter 8mm erfolgte.5 Eine rezente retrospektive Analyse der deutschen AGO mit 289 Patientinnen mit nodal-negativem Vulvakarzinom konnte keine Assoziation zwischen einem bestimmten Sicherheitsabstand und dem Lokalrezidivrisiko nachweisen. Somit bleibt der „optimale“ Sicherheitsabstand unklar, worauf auch die aktuelle Leitlinie der Europäischen Gesellschaft für gynäkologische Onkologie (ESGO) hinweist und einen pathologischen Sicherheitsabstand von >2–3mm für ausreichend erachtet, wenngleich auf die widersprüchliche Datenlage hingewiesen wird.4,6
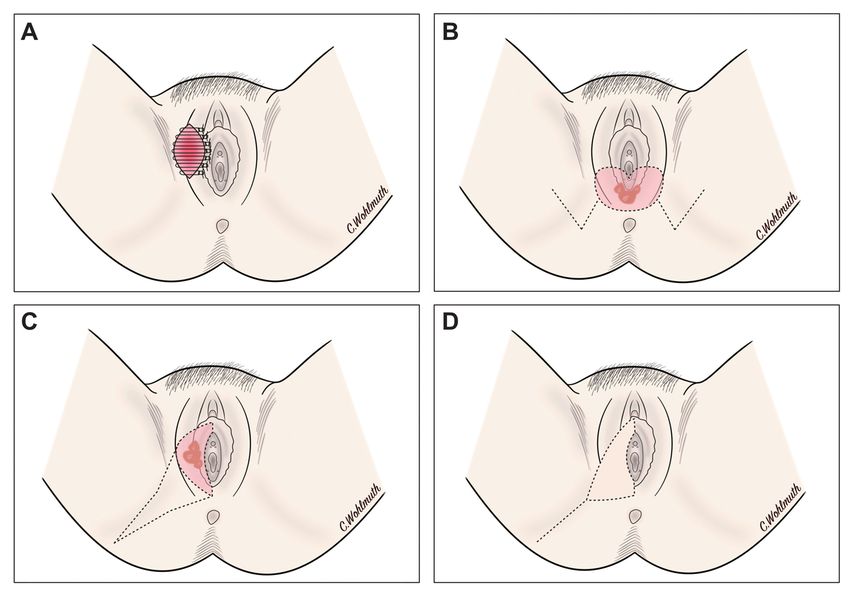
Die Art des Defektverschlusses hängt vom Ausmaß der Resektion und der damit verbundenen möglichen spannungsfreien Wunddeckung, der Funktionalität und der bestmöglichen anatomischen Rekonstruktion ab. Neben dem primären Wundverschluss steht eine Vielzahl an plastisch-rekonstruktiven Maßnahmen mit regionalen Lappenplastiken mit „random pattern“ Durchblutung (z.B. VY-Lappen, Limberg-Lappen) und gestielten oder freien lappenplastischen Deckungsmethoden zur Verfügung (Abb. 1).
Abb. 1 A–D: Operativer Defektverschluss des Tumors. A: Primärer Wundverschluss bei Exzision eines kleinen Karzinoms mit Einzelknopfnähten. B: Plastische Rekonstruktion bei posteriorem Karzinom mit beidseitiger modifizierter Limberg-Lappenplastik (Dufourmentel-Modifikation)C–D: VY-Verschiebeplastik bei lateralem Karzinom mit Schnittführung (C) und abschließender Naht (D)
Bei einem fortgeschrittenen Lokalbefund mit Beteiligung der umliegenden Strukturen (z.B. Urethra und/oder Anus) sollte präoperativ evaluiert werden, ob eine primär kontinenzerhaltende Operation möglich wäre. Eine kleine retrospektive Studie deutet darauf hin, dass eine Teilresektion der Urethra bis etwa 1cm möglich ist, ohne die Rate an postoperativer Harninkontinenz zu erhöhen.7 Erscheint eine kontinenzerhaltende Primäroperation nicht möglich, erfolgt häufig eine multimodale Therapie (Strahlentherapie, systemische Therapie, operatives Vorgehen). Eine Exenteration kann in ausgewählten Fällen erwogen werden.
Operative Behandlung der Lymphabflusswege
Bei Plattenepithelkarzinomen unter 2cm Durchmesser und maximal 1mm Invasionstiefe ist kein operatives Lymphknotenassessment erforderlich. In allen anderen Fällen sollte eine operative Lymphknotenevaluierung erfolgen. Bei unifokalen Tumoren unter 4cm mit klinisch unauffälligen Leistenlymphknoten sollte die Sentinel-Lymphknotentechnik durchgeführt werden.4 Mit der Validierung der Sentineltechnik beim Vulvakarzinom in der GROINSSV-I-Studie fand die Technik breite Anwendung, womit die Morbidität, die mit der vollständigen inguinalen Lymphadenektomie einhergeht, signifikant gesenkt werden konnte. Wichtig ist die pathologische Aufarbeitung des Sentinellymphknotens mittels Ultrastaging: Dabei sollten zumindest 3 Schnitte pro Millimeter erfolgen. Wenn die Hematoxylin- und Eosinfärbung negativ ist, wird eine Immunhistochemie für Cytokeratin durchgeführt.4
Bei lateralen Tumoren reicht eine einseitige Sentinellymphonodektomie, wobei die ESGO „laterale“ Tumoren als jene definiert, deren medialster Rand mehr als 1cm von der Mittellinie entfernt ist, während die US-amerikanischen NCCN-Guidelines einen Abstand von 2cm von der Mittellinie fordern.4,8
Die höchste Detektionsrate für die Sentineltechnik ergibt sich bei der Verwendung einer dualen Markierung mit Tc99m in Kombination mit blauem Farbstoff oder Indocyaningrün. Wenn kein Sentinellymphknoten detektiert werden kann, sollte eine inguinofemorale Lymphadenektomie der oberflächlichen und tiefen Lymphknoten erfolgen. Bei medial gelegenen Tumoren sollte eine bilaterale Lymphknotenevaluation erfolgen, welche unter den oben genannten Voraussetzungen ebenfalls mittels Sentineltechnik erfolgen kann. Bei Makrometastasen (>2mm) im Sentinellymphknoten sollte eine vollständige ipsilaterale Lymphadenektomie erfolgen. Bei Karzinomen über 4cm oder multifokalen Karzinomen sollte aufgrund einer erhöhten Rate an Nicht-Sentinellymphknotenmetastasen ebenfalls a priori eine vollständige inguinale Lymphadenektomie erfolgen.4,8
Literatur:
1 Robert-Koch-Institut: Zentrum für Krebsregisterdaten. https://www.krebsdaten.de/Krebs/SiteGlobals/Forms/ErgebnisAnsicht/ErgebnisAnsicht_form.html; zuletzt aufgerufen am 29.09.2023 2 Wohlmuth C, Wohlmuth-Wieser I: Vulvar melanoma: molecular characteristics, diagnosis, surgical management, and medical treatment. Am J Clin Dermatol 2021; 22(5): 639-51 3 Wohlmuth C, Wohlmuth-Wieser I: Vulvar malignancies: an interdisciplinary perspective. J Dtsch Dermatol Ges 2019; 17(12): 1257-76 4 Oonk MHM et al.: European Society of Gynaecological Oncology Guidelines for the Management of Patients with Vulvar Cancer - Update 2023. Int J Gynecol Cancer 2023; 33(7): 1023-43 5 Heaps JM et al.: Surgical-pathologic variables predictive of local recurrence in squamous cell carcinoma of the vulva. Gynecol Oncol 1990; 38(3): 309-14 6 Woelber L et al.: Role of tumour-free margin distance for loco-regional control in vulvar cancer-a subset analysis of the Arbeitsgemeinschaft Gynäkologische Onkologie CaRE-1 multicenter study. Eur J Cancer 2016; 69: 180-8 7 Hampl M et al.: The risk of urinary incontinence after partial urethral resection in patients with anterior vulvar cancer. Eur J Ostet Gynecol Reprod Biol 2011; 154(1): 108-128NCCN: NCCN Clinical Practice Guidelines in Oncology: Vulvar Cancer. Version 1.2023. Verfügbar unter: nccn.org. zuletzt aufgerufen am 19.09.2023.
Das könnte Sie auch interessieren:
Postpartale Blutung im Fokus
Wenn sich die Sonne über dem Tafelberg erhebt und das goldene Licht über Kapstadt legt, ahnt man kaum, dass sich hier im Oktober 2025 mehr als 8000 Fachpersonen aus über 130 Ländern ...
Künstliche Intelligenz in der Brustpathologie
Die Einführung von künstlicher Intelligenz (KI) markiert einen Paradigmenwechsel in der Pathologie – insbesondere in der Brustpathologie. Validierte KI-Tools steigern bereits heute ...
Muss das duktale Carcinoma in situ noch operativ behandelt werden?
Das duktale Carcinoma in situ (DCIS) ist ein möglicher Vorläufer des invasiven Mammakarzinoms, wird jedoch zunehmend als heterogene Entität erkannt, sodass eine Standardtherapie mit ...