Operationen am Uterus bei Placenta- accreta-Spektrum (PAS)
Autoren:
Dr. Marie-Christin Pohle
Priv.-Doz. Dr. Mehmet Vural
Univ.-Prof. Dr. Angela Köninger
Klinik für Frauenheilkunde und Geburtshilfe
Klinik St. Hedwig Krankenhaus Barmherzige Brüder
Lehrstuhl für Frauenheilkunde und Geburtshilfe (Schwerpunkt Geburtshilfe) der Universität Regensburg
Korrespondierende Autorin:
Univ.-Prof. Dr. Angela Köninger
E-Mail: angela.koeninger@ukr.de
Höhergradige Plazentationsstörungen steigen in ihrer Prävalenz und betreffen mittlerweile schon eine von 500 Geburten,1 weshalb aufgrund ihrer potenziell tödlichen Komplikationen das Bewusstsein für diese Pathologie geschärft und das klinische Management optimiert werden muss. Im folgenden Artikel wird entsprechend ein Überblick über das Krankheitsbild und vor allem die verschiedenen Therapiemöglichkeiten auf Grundlage der Pathophysiologie gegeben.
Epidemiologie und Pathogenese
Das Placenta-accreta-Spektrum (PAS) oder – wie auch synonym in der Literatur verwendet wird – „abnormally invasive placenta“ (AIP) oder „morbidly adherent placenta“ (MAP) umfasst drei Entitäten, deren Einteilung anhand klinischer und histopathologischer Kriterien erfolgt: 1. die Placenta accreta als mildeste Ausprägung der Plazentationsstörung mit einer sich bei Geburt nicht spontan lösenden Adhärenz der plazentaren Zotten mit der Uteruswand ohne eine Infiltration des Myometriums, 2. die Placenta increta, bei der die plazentaren Villi das Myometrium infiltrieren, und 3. die Placenta percreta als Maximalvariante, bei der die plazentaren Villi das Myometrium durchdringen und die uterine Serosa erreichen.2 Je nach Lage wird das umliegende Gewebe, insbesondere die aufgrund ihrer anatomischen Lage gefährdete Harnblasenhinterwand, in den Prozess involviert.3
Bei weltweit steigenden Kaiserschnittraten treten auch vermehrt Störungen des PAS auf. Es besteht zwar eine starke Assoziation mit der Anzahl an vorangegangenen Kaiserschnitten, jedoch können Plazentationsstörungen als Folge jeder Endometriumläsion auftreten. Das heißt, operative Interventionen (wie Curettagen des Cavum uteri, manuelle Plazentalösungen, Endometriumablationen oder hysteroskopische Interventionen) sowie andere strukturelle oder anatomische Auffälligkeiten des Uterus (Adenomyosis uteri, postpartale Endometritis, Uterus duplex mit nicht kommunizierenden Hörnern) stellen Risikofaktoren dar.4
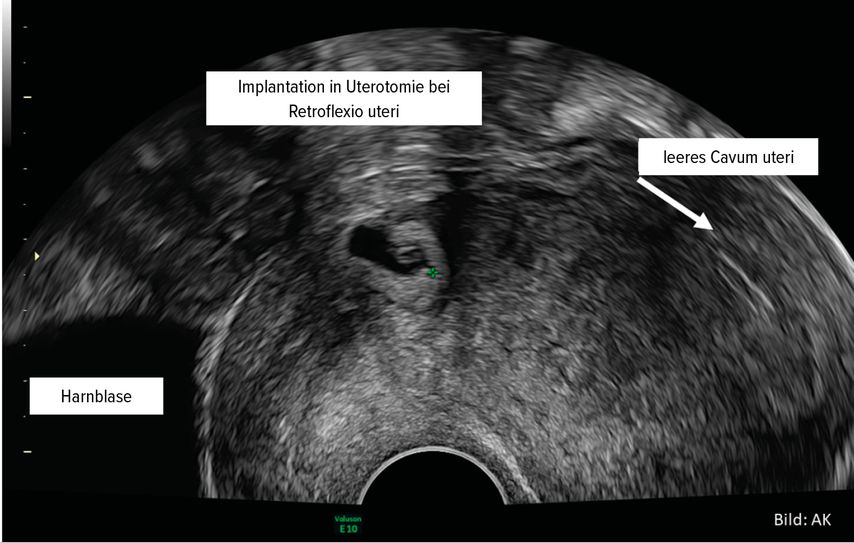
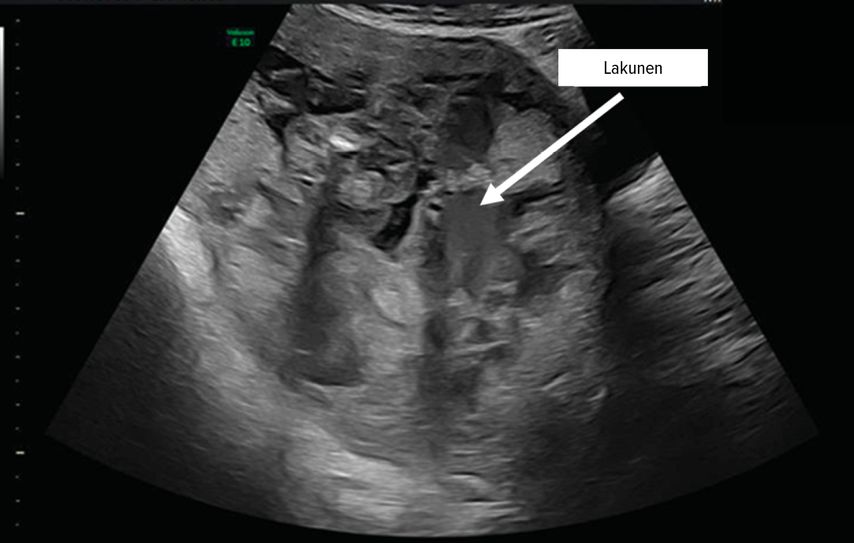
Pathophysiologische Grundlage der Entwicklung von Plazentationsstörungen ist ein dezidualer Defekt, im Sinne eines kompletten oder partiellen Fehlens der Decidua basalis. So kommt es zum Versagen der regelhaften Trophoblastinvasion.5 Man geht davon aus, dass es, im Falle einer vorausgegangenen Sectio caesarea, im Bereich der Uterotomie zu einem sekundären Defekt an der Grenzfläche zwischen Endometrium und Myometrium kommt, der wiederum zu einem Versagen der normalen Dezidualisierung führt und so eine abnorm tiefe Trophoblastinvasion, Vaskularisation und damit eine abnorm tiefe Plazentation ermöglicht.5 Die klassische Eintrittspforte ist die Sectionarbenschwangerschaft6 (Abb. 1). Es kommt zur Neovaskularisation mit Ausbildung muskelschwacher Gefäße, die durch hohen Blutfluss gekennzeichnet sind5 und wesentlich die klinischen Probleme bei der Entbindung sowie auch den sonografischen Aspekt bedingen. So lassen sich beispielsweise die Lakunen als Folge einer Gewebedisruption durch den gesteigerten Fluss erklären (Abb. 2).
Abb. 1: Durch eine vorangegangene Sectio kann es bei einer weiteren Schwangerschaft zu einer abnorm tiefen Plazentation im Bereich der Uterotomie kommen
Abb. 2: Lakunen bilden sich als Folge einer Gewebsdisruption durch gesteigerten Blutfluss
Im weitesten Sinn stellt das PAS den pathophysiologischen diametralen Gegenpol zur gestörten Trophoblastinvasion bei der plazentaren Dysfunktion (Präeklampsie, Wachstumsretardierung) dar. Während bei der Präeklampsie eine geminderte Invasion extravillöser trophoblastärer Zellen in die uterinen Spiralarterien stattfindet und dieser Prozess durch die Decidua reguliert wird, gibt es Hinweise, dass aufgrund des Deciduadefektes bei PAS die Trophoblastinvasion gegenteilig, nämlich akzeleriert verläuft.7
Das matrizelluläre Protein CCN3 reguliert den Übergang von proliferierenden in migrierende trophoblastäre Zellen und spielt eine bedeutende Rolle in der Pathogenese der Präeklampsie.8 So konnte gezeigt werden, dass in präeklamptischen Plazenten eine reduzierte, in Plazenten mit inkretem oder perkretem Wachstum hingegen eine gesteigerte CCN3-Expression vorliegt.7
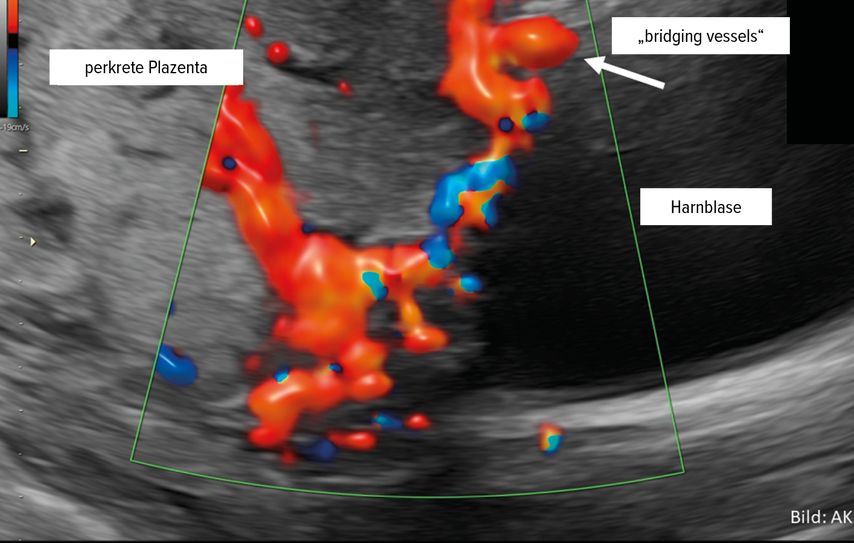
Die durch die veränderte Trophoblastinvasion induzierte Neovaskularisation ist besonders dann herausfordernd, wenn sich diese auf die angrenzende Blasenhinterwand erstreckt. Sonografisch zeigen sich sog. „bridging vessels“–die Topografie impliziert die Pathogenese: Es handelt sich um Gefäßneubildungen, die sich vom Nachbarorgan auf die Plazentaoberfläche erstrecken und im Falle der operativen Versorgung subtil ligiert werden müssen (Abb. 3). Aufgrund der Fragilität der Gefäße sind sie praktisch nicht koagulierbar, sondern erfordern eine subtile Ligatur und Durchtrennung jedes einzelnen Gefäßes.9
Abb. 3: „Bridging vessels“-Gefäßneubildungen, die sich vom Nachbarorgan auf die Plazentaoberfläche erstrecken
Deziduale Defekte als Eintrittspforten der höhergradigen Plazentationsstörungen erklären auch die hohe Koinzidenz mit einer Placenta praevia und die Assoziation beider pathologischer Zustände mit der Anzahl an Sectiones.4
Therapie
Derzeit existiert kein Goldstandard der Therapie der höhergradigen Plazentationsstörungen. Entscheidend im klinischen Management sind in jedem Fall die frühe Diagnosestellung und das Schaffen optimaler (präpartaler) Voraussetzungen.10,11
Die manuelle Plazentalösung ist in Fällen einer verzögerten Plazentalösung oder -retention und bei Vorliegen einer Placenta accreta Therapie der Wahl. Bei Placenta in- und percreta ist dies jedoch unbedingt zu vermeiden, um schwere Hämorrhagien durch Gefäßabrisse zu verhindern.12,13
Die bisher gängigste Therapie der höhergradigen Plazentationsstörungen stellte die Sectio-Hysterektomie dar. Diese wurde lange für die sicherste Therapieoption gehalten. Neben dem Fertilitätsverlust und den psychischen Folgen der Hysterektomie geht jedoch auch die Sectio-Hysterektomie mit hoher maternaler Morbidität einher.14,17 Insbesondere kann es auch hier zu erheblichem Blutverlust mit einhergehenden Komplikationen wie der Notwendigkeit von Bluttransfusionen oder dem Auftreten einer disseminierten intravasalen Koagulation kommen.17
Fokale Resektion
Verschiedene Autoren beschrieben organerhaltende Vorgehensweisen bei Placenta percreta und increta.12,14–16,18 Camuzcuoglu et al. entwickelten eine Technik der Sectio-Hysterektomie bei Placenta praevia et percreta zur Reduktion der maternalen Komplikationen. Sie beinhaltet die Sectio mittels Längslaparotomie, eine fundale Uterotomie zur Kindsentwicklung im Bereich des Fundus uteri, wobei die genaue Lokalisation der Uterotomie anhand der präoperativen Sonografie festgelegt wird, und eine Reduktion des uterinen Blutflusses entweder mittels Ligatur der Arteria iliaca interna oder Ligatur/Abklemmen der Ligg. ovarii propria und rotunda. Anschließend erfolgen die Adhäsiolyse und Ligatur der Gefäße zwischen Uterus und Blase/vorderer Beckenwand und das Abklemmen der A. uterina beidseits. Im Anschluss kann die Hysterektomie mit Placenta in situ erfolgen. Entsprechend dieser Operationstechnik kam es kaum zu schwerwiegenden maternalen Komplikationen und insbesondere zu keinem maternalen Todesfall. Herausfordernd sind die Gefäße zwischen perkreter Plazenta und Blasenhinterwand.9
Neben der Sectio-Hysterektomie existiert eine Reihe an konservativen Therapieansätzen. Eine konservative Therapie beschreibt in diesem Zusammenhang alle Verfahren, die eine peripartale Hysterektomie zu vermeiden suchen.12,13
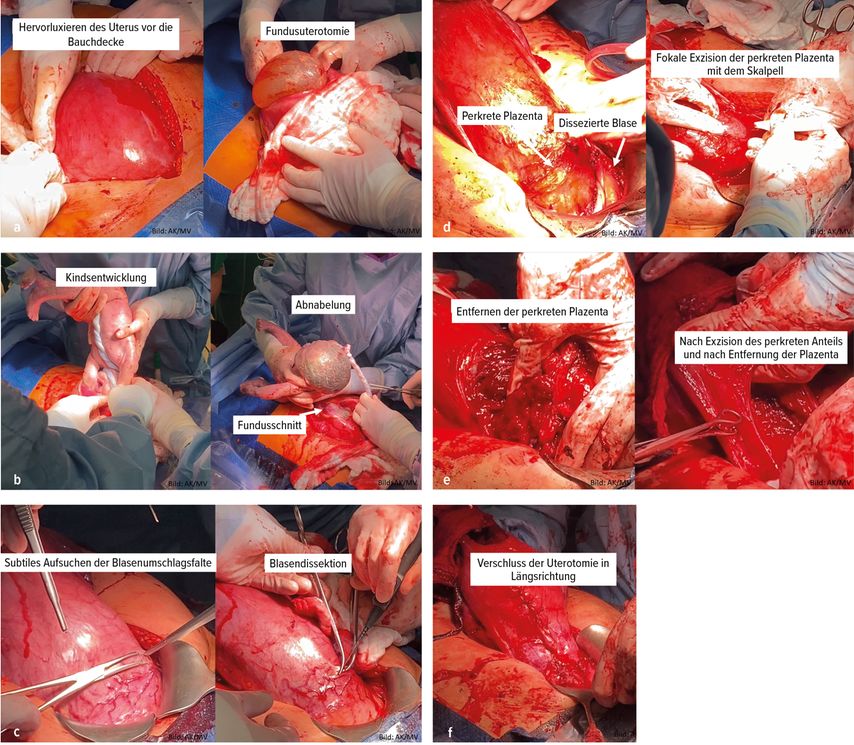
Unter den konservativen Therapien wird zunehmend die fokale Resektion durchgeführt, die von von verschiedenen Autoren beschrieben wurde.15,16,18 Dieses Verfahren eignet sich insbesondere bei der umschriebenen Implantation der Plazenta in die Sectionarbe hinein mit Dehiszenz derselben. Die genaue Kenntnis der perkreten Anteile erlaubt die präoperative Operationsplanung hinsichtlich der Machbarkeit. Die fokale Resektion setzt voraus, dass auch nur eine fokale Invasion in einem resektablen Bereich vorliegt. Eine Infiltration der Zervix oder der Uterushinterwand verunmöglicht die schnelle und komplette Plazentaentfernung, sodass sich diese Lokalisationen nicht für eine fokale Resektion eignen. Wir beschreiben hier nun die in unserem Haus angewandte Technik in Analogie zum beschriebenen Vorgehen von Camuzcuoglu et al., 2016. Hierbei erfolgt die Sectio analog zur oben beschriebenen Technik der Sectio-Hysterektomie mittels Längslaparotomie und Hervorluxieren des Uterus vor die Bauchdecke (Abb. 4a) und der Kindsentwicklung über den Fundus per Längsinzision (Abb. 4b). Vor fokaler Resektion erfolgt die Ligatur aller Gefäße zwischen Uterus/Plazenta und Blase bzw. vorderer Bauchwand. Hierfür werden Overholt-Klemmen eingesetzt, die Gefäße mit monopolarem Strom durchtrennt und anschließend mit Vicryl- 3,0-Fäden ligiert (Abb. 4c). Der betroffene Myometriumanteil mit eingewachsener Plazenta wird mit einem Skalpell sehr rasch exzidiert (Abb. 4d und 4e), anschließend erfolgt die Rekonstruktion des Uterus durch tiefgreifende Nähte in Längsrichtung (Abb. 4f).
Abb. 4a–f: OP-Technik zur fokalen Resektion, wie sie in der Universitätsklinik Regensburg angewandt wird
Mehrere multizentrische Arbeiten konnten zeigen, dass weder Blutverlust noch Morbidität höher sind, wenn eine fokale Resektion vorgenommen wird verglichen zur primären Hysterektomie.14,17
Es konnte gezeigt werden, dass nach fokaler Resektion eine komplikationslose Folgeschwangerschaft und Entbindung bei bestehendem Risiko für das erneute Auftreten einer Plazentationsstörung möglich sind.19
Die Erfolgsraten der fokalen Resektion sind stark von der Lokalisation der Placenta percreta abhängig: Bei >90% der Patientinnen mit Placenta percreta und Infiltration der Blase im oberen Bereich konnte der Uterus erhalten werden, bei Infiltration des unteren Segmentes nur bei bis zu 20%.20
„Leaving the placenta in situ approach“(LISA)
Einen weiteren konservativen Therapieansatz stellt der „leaving the placenta in situ approach“ (LISA) dar, bei welchem die Plazenta nach Entbindung des Kindes in situ belassen wird. Pathophysiologische Grundlage des LISA ist, dass es nach Entbindung des Feten zu einer kontinuierlichen Abnahme der Blutversorgung des Uterus, der Parametrien und der Plazenta kommt. Dies führt im Verlauf zu einer sekundären Nekrose des Zottengewebes und so zur Ablösung der Plazenta von der Gebärmutter und den angrenzenden Beckenorganen.12 Zur Senkung des Infektionsrisikos wird häufig eine prophylaktische Therapie mit einem Breitspektrumantibiotikum durchgeführt.21
Dieser Therapieansatz kann nur bei kreislaufstabiler Patientin und hoher zu erwartender Compliance angewandt werden aufgrund des erhöhten Risikos einer nicht vorhersehbaren vaginalen Blutung.13 Auch kann durch die Gewebsnekrose ein pseudoseptisches Bild entstehen,22 was sich aus unserer Erfahrung selbst limitieren kann und von einer bakteriellen Superinfektion der Plazenta unterschieden werden muss.
Im Falle von schweren Komplikationen wie Hämorrhagie, Infektion oder Sepsis ist eine (Notfall-)Hysterektomie indiziert. Diese geht allerdings mit einem deutlich höheren Blutverlust einher als eine geplante Hysterektomie.17
Zusammenfassung
Mittlerweile ist in einem Großteil der Fälle ein konservatives Vorgehen möglich.14,18
Es konnte in einer Arbeit mit großer Fallzahl gezeigt werden, dass bei Patientinnen im Zustand nach konservativer Therapie des PAS innerhalb der ersten 24 Stunden postoperativ weniger Blutverlust und damit weniger zu transfundierende Blutkonserven zu verzeichnen waren als bei Patientinnen im Zustand nach Sectio-Hysterektomie. Es bestand kein Unterschied der beiden Gruppen hinsichtlich des Auftretens von Blasenverletzungen, postoperativer Anämie, Fieber oder disseminierter intravasaler Gerinnnung. Ebenso war das neonatale Outcome beider Gruppen vergleichbar.14
Zusammenfassend lässt sich festhalten, dass die Kenntnis der pathophysiologischen Grundlagen der höhergradigen Plazentationsstörungen entscheidend bei der operativen Versorgung und damit bei der erfolgreichen Therapie ist. Insbesondere spielt die pathologische Neovaskularisation eine wichtige Rolle im Management dieses Krankheitsbildes, weshalb sich alle operativen Therapien hiermit auseinandersetzen müssen. Die exakte Kenntnis der Lage der perkreten Plazentaanteile und die subtile Ligatur jedes Gefäßes, welches sich zwischen perkreter Plazenta und Umgebung erstreckt, ermöglichen das organerhaltende Vorgehen mittels fokaler Resektion. Die präpartale Diagnosestellung, ein koordiniertes klinisches Management und große Erfahrung des operierenden Teams stellen die entscheidenden Einflussfaktoren in der Behandlung dar.
Literatur:
1 Jauniaux E et al.: Epidemiology of placenta previa accreta: a systematic review and meta-analysis. BMJ Open 2019; 9(11): e031193 2 Silver RM and Branch DW: Placenta accreta spectrum. N Engl J Med 2018; 378: 1529-36 3 Jauniaux E et al.: FIGO classification for the clinical diagnosis of placenta accreta spectrum disorders. Int J Gynaecol Obstet 2019; 146: 20-4 4 Jauniaux E, Burton GJ: Pathophysiology of placenta accreta spectrum disorders: a review of current findings. Clin Obstet Gynecol 2018; 61: 743-54 5 Jauniaux E et al.: Placenta accreta spectrum: pathophysiology and evidence-based anatomy for prenatal ultrasound imaging. Am J Obstet Gynecol 2018; 218: 75-87 6 Timor-Tritsch IE et al.: Cesarean scar pregnancy is a precursor of morbidly adherent placenta. Ultrasound Obstet Gynecol 2014; 44: 346-53 7 Duan L et al.: CCN3 signaling is differently regulated in placental diseases preeclampsia and abnormally invasive placenta. Front Endocrinol 2020; 11: 597549 8 Kipkeew F et al.: CCN1 (CYR61) and CCN3 (NOV) signaling drives human trophoblast cells into senescence and stimulates migration properties. Cell Adh Migr 2016; 10: 163-78 9 Camuzcuoglu A et al.: Surgical management of 58 patients with placenta praevia percreta. Wien Klin Wochenschr 2016; 128: 360-6 10 Nieto-Calvache AJ et al.: All maternal deaths related to placenta accreta spectrum are preventable: a difficult-to-tell reality. AJOG Glob Rep 2021; 1: 100012 11 Nieto-Calvache AJ et al.: Lack of experience is a main cause of maternal death in placenta accreta spectrum patients. Acta Obstet Gynecol Scand 2021; 100: 1445-53 12 Sentilhes L et al.: Conservative management of placenta accreta spectrum. Clin Obstet Gynecol 2018; 61: 783-94 13 Sentilhes L et al.: FIGO consensus guidelines on placenta accreta spectrum disorders: Conservative management. Int J Gynaecol Obstet 2018; 140: 291-8 14 Wang Q et al.: Conservative management versus cesarean hysterectomy in patients with placenta increta or percreta. J Matern Fetal Neonatal Med 2022; 35: 1944-50 15 Chandraharan E et al.: The Triple-P procedure as a conservative surgical alternative to peripartum hysterectomy for placenta percreta. Int J Gynaecol Obstet 2012; 117: 191-4 16 Nieto-Calvache AJ et al.: How to perform the one-step conservative surgery for placenta accreta spectrum move by move. Am J Obstet Gynecol MFM 2023; 5(2): 100802 17 van Beekhuizen HJ et al.: A multicenter observational survey of management strategies in 442 pregnancies with suspected placenta accreta spectrum. Acta Obstet Gynecol Scand 2021; 100(1): 12-20 18 Palacios-Jaraquemada JM et al.: Placenta accreta spectrum: a hysterectomy can be prevented in almost 80% of cases using a resective-reconstructive technique. J Matern Fetal Neonatal Med 2022; 35: 275-82 19 Palacios-Jaraquemada JM et al.: Pregnancy outcome in women with prior placenta accreta spectrum disorders treated with conservative-reconstructive surgery: analysis of 202 cases. J Matern Fetal Neonatal Med 2022; 35: 6297-301 20 Palacios-Jaraquemada JM et al.: Placenta accreta spectrum into the parametrium, morbidity differences between upper and lower location. J Matern Fetal Neonatal Med 2023; 36: 2183764 21 Fox KA et al.: Conservative management of morbidly adherent placenta: expert review. Am J Obstet Gynecol 2015; 213: 755-60 22 Biele C et al.: Conservative management of abnormally invasive placenta complicated by local hyperfibrinolysis and beginning disseminated intravascular coagulation. Arch Gynecol Obstet 2021; 303: 61-8
Das könnte Sie auch interessieren:
Künstliche Intelligenz in der Brustpathologie
Die Einführung von künstlicher Intelligenz (KI) markiert einen Paradigmenwechsel in der Pathologie – insbesondere in der Brustpathologie. Validierte KI-Tools steigern bereits heute ...
Postpartale Blutung im Fokus
Wenn sich die Sonne über dem Tafelberg erhebt und das goldene Licht über Kapstadt legt, ahnt man kaum, dass sich hier im Oktober 2025 mehr als 8000 Fachpersonen aus über 130 Ländern ...
Muss das duktale Carcinoma in situ noch operativ behandelt werden?
Das duktale Carcinoma in situ (DCIS) ist ein möglicher Vorläufer des invasiven Mammakarzinoms, wird jedoch zunehmend als heterogene Entität erkannt, sodass eine Standardtherapie mit ...