Interpretation von molekularpathologischen Befunden
Autor:
Assoz. Prof. Priv.-Doz. Dr. Stephan Polterauer
2. Stellvertretender Leiter Klinische Abteilung für Allgemeine Gynäkologie und Gynäkologische Onkologie,
Leiter Gynäkologisches Krebszentrum
Koordinator Gynecologic Cancer Unit, Comprehensive Cancer Center Vienna
Universitätsklinik für Frauenheilkunde, Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
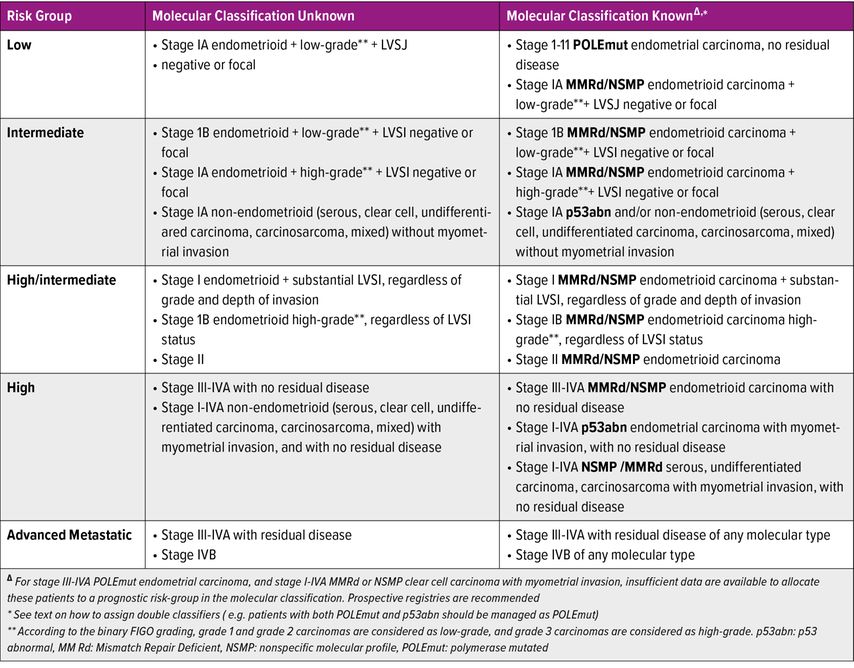
Das Endometriumkarzinom ist die häufigste gynäkologische Krebserkrankung in Europa. Die Einteilung in Risikogruppen erfolgte bisher anhand klassischer histopathologischer und klinischer Parameter wie Tumorgrad, histologischen Typs, Tumorausbreitung, Lymphgefäßeinbrüchen und Alter. Die kürzlich publizierte Leitlinie der ESGO nahm nun die molekulare Klassifikation in Bezug auf Risikoeinteilung und Therapieempfehlung auf.
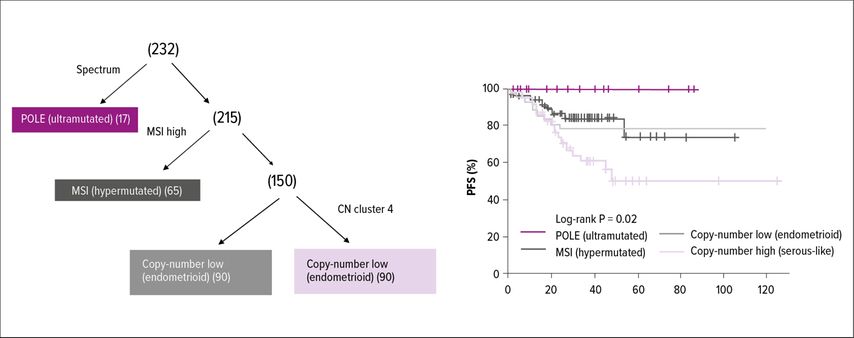
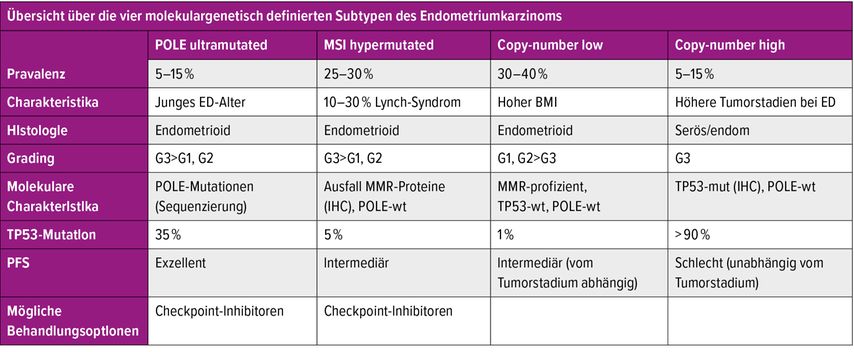
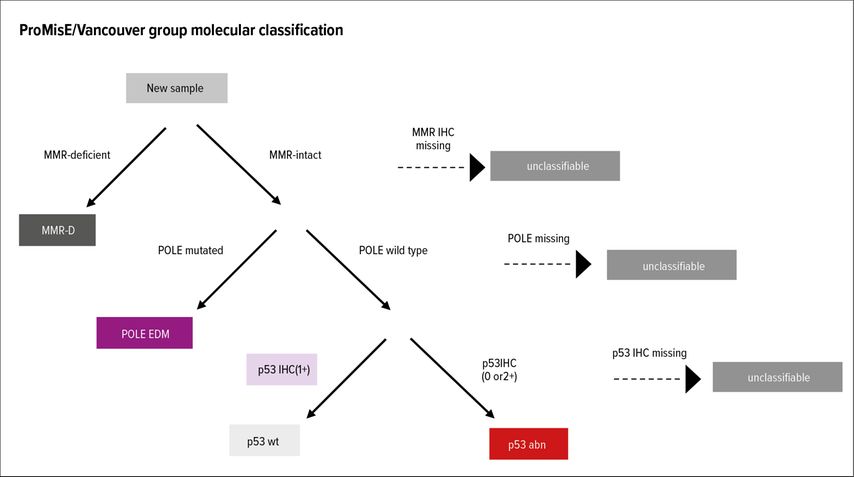
Der Cancer Genome Atlas (TCGA) identifizierte 2013 vier molekulare Subtypen des Endometriumkarzinoms (Abb. 1). Diese vier molekularen Untergruppen zeigen signifikante klinische und prognostische Unterschiede (Tab. 1). Im Jahr 2015 wurde ein molekulares Klassifikationssystem entwickelt, das leichter auf das klinische Umfeld übertragen werden konnte: ProMisE (Proactive Molecular Risk Classifier for Endometrial Cancer) identifizierte vier ähnliche molekulare Untergruppen, POLEmut, „DNA mismatch repair deficient“ (MMRd), „p53 abnormal“ und eine Gruppe ohne spezielles molekulares Profil (NSMP) (Abb. 2). Tumoren mit POLEmut haben die beste Prognose, gefolgt von NSMP und MMRd, während p53-abnorme Tumoren die schlechteste Prognose haben. Durch die Implikation der molekularen Parameter lässt sich eine präzisere Risikoklassifikation durchführen und es ergeben sich dadurch auch mögliche therapeutische Implikationen. Die kürzlich publizierte Leitlinie der europäischen gynäkoonkologischen Fachgesellschaft (ESGO) inkorporierte die molekulare Klassifikation in Bezug auf Risikoeinteilung und Therapieempfehlung (Tab. 2). Durch die präzisere Risikozuteilung kann bei Patientinnen mit guter Prognose eine Deeskalation und bei Patientinnen mit hohem Rezidivrisiko eine Eskalation der Therapie durchgeführt werden.
POLEmut-ultramutated
Bei POLEmut-Tumoren, gekennzeichnet durch Mutationen in der Exonuklease-Domäne des POLE-Gens, eines Gens, das an der nukleären DNA-Replikation und -reparatur beteiligt ist, handelt es sich tendenziell um ultramutierte, „high-grade“ endometrioide Endometriumkarzinome. Diese Gruppe macht weniger als 10% der Endometriumkarzinome aus, hat darüber hinaus eine ausgezeichnete Prognose und ist mit sehr gutem klinischem Outcome verbunden. In einer Analyse der PORTEC-3-Daten zeigte sich ein rezidivfreies 5-Jahres-Überleben von 98% für High-Risk-POLEmut-Patienten und kein Unterschied der rezidivfreien Prognose nach kombinierter Radiochemotherapie im Vergleich zur alleinigen Strahlentherapie in der POLEmut-Gruppe. Durch die generell günstige Prognose wird in aktuellen Leitlinien die Möglichkeit diskutiert, bei frühen Tumorstadien eine Deeskalation der adjuvanten Therapie zu erwägen. Im seltenen Fall eines Wiederauftretens der Erkrankungen können Immuntherapien evtl. in Kombination mit Tyrosinkinaseinhibitoren zum Einsatz kommen.
Mismatch-Repair-Defizienz (MMRd)/Mikrosatelliteninstabilität (MSI)-hypermutated
Etwa 3% aller Endometriumkarzinome und etwa 10% der MMRd/mikrosatelliteninstabilen (MSI) Endometriumkarzinome stehen in ursächlichem Zusammenhang mit Keimbahnmutationen eines der MMR-Gene MLH1, PMS2, MSH2 und MSH6. Internationale Fachgesellschaften empfehlen, den MMR-Status/MSI bei allen Endometriumkarzinomen unabhängig vom Alter der Patientin zu testen. Als Methoden zum Screening auf Mutationen in den Lynch-Genen (MLH1, MSH2, MSH6, PMS2) kommen potenziell zwei Methoden infrage. Die immunhistochemische Untersuchung (IHC) der DNA-Reparaturproteine gepaart mit einer molekularen Analytik der MLH1-Promotormethylierung bei einem Expressionsverlust von MLH1/PMS2 oder die Analyse der DNA-Reparaturstörung mittels Testung auf Mikrosatelliteninstabilität (MSI). Das Testen auf MMR-Defizienz/MSI bei Patientinnen mit Endometriumkarzinom hat sich aus mehreren Gründen als relevant erwiesen: 1. diagnostisch, da MMRd/MSI als Marker für Endometriumkarzinome vom endometrioiden histologischen Typ gilt, 2. zum Vorscreening, um Patienten mit einem höheren Risiko für das Lynch-Syndrom zu identifizieren, 3. prognostisch (TCGA, ProMisE) und prädiktiv für den potenziellen Nutzen einer Immuncheckpoint-Inhibitor-Therapie. Kürzlich wurden verschiedene Immuntherapien zur Behandlung des MMRd rezidivierten/metastasierten Endometriumkarzinoms nach vorangegangener Chemotherapie zugelassen.
P53 abnormal (copy-number high)-serous like
Der Anteil der p53-abnormen Endometriumkarzinome beträgt etwa 15%. p53-Mutationen finden sich bei 92% der serösen, 85% der Karzinosarkome, 37% der klarzelligen und 22% der endometrioiden Grad-3-Tumoren. Endometriumkarzinome mit p53-abnormer Immunhistochemie (IHC) haben das schlechteste klinische Outcome, verursachen 50–70% der Sterblichkeit. Deshalb wird in den meisten Fällen zusätzlich zur Operation eine Chemotherapie ± Strahlentherapie empfohlen. Die Analyse der molekularen Daten von PORTEC-3-Studienteilnehmern zeigte bei p53-klassifizierten Tumoren ein rezidivfreies 5-Jahres-Überleben von 48,0% und ein 5-Jahres-Gesamtüberleben von 54,0%. Unabhängig vom histologischen Typ waren abnorme p53-Tumoren die einzige molekulare Untergruppe, die ein signifikant verbessertes rezidivfreies 5-Jahres-Überleben mit adjuvanter Radiochemotherapie im Vergleich zu Radiotherapie allein zeigte.
Kürzlich wurde die Kombination von Lenvatinib plus Pembrolizumab für MMRp rezidivierten/metastasierten Endometriumkarzinomen zugelassen.
No specific molecular profile (NSMP)/p53 Wild type (copy-number low)
Die häufigste molekulare Untergruppe ist die NSMP/p53 Wild type (WT) und umfasst etwa 40–50% der Endometriumkarzinome mit einer intermediären Prognose. Bei dieser Gruppe handelt es sich um Tumoren, die keiner der o.g. Gruppen zugeordnet werden können. Tumoren können unterschiedliche histopathologische Eigenschaften zeigen. Meistens handelt es sich um Grad-1- oder -2-Tumoren (71%) mit endometrioider Histologie (91%), die im Stadium 1 (80%) diagnostiziert werden. Da die Prognose in dieser Gruppe heterogen ist, werden zusätzliche Biomarker herangezogen, um eine genauere Einschätzung treffen zu können und daraus mögliche Therapiekonsequenzen abzuleiten. Hierfür werden die Expression des L1-Zelladhäsionsmoleküls (L1CAM), ß-Catenin (CTNNB1), ein an Zellkontakten beteiligtes Strukturprotein, sowie Östrogen/Progesteron-Rezeptorstatus herangezogen.
Außerdem werden etablierte Parameter wie Alter, LVSI (negativ/mild/substanziell) berücksichtigt. Für fortgeschrittene und rezidivierende Tumoren wurde kürzlich eine Kombinations-Immuntherapie mit Lenvatinib und Pembrolizumab zugelassen. Weitere zielgerichtete Behandlungen umfassen antihormonelle Therapien bei rezidivierenden ER/PR-positiven Tumoren. Innerhalb der endometrioiden Histologie, die den Großteil des NSMP/p53 WT ausmacht, ist der PI3K/Akt/mTOR-Pathway einer der wichtigsten Treiber für die Karzinogenese und könnte daher auch ein potenzielles therapeutisches Ziel darstellen.
Tumoren mit mehr als einem molekularen Merkmal/„multiple classifiers“
Bei 2–3% aller Endometriumkrazinome findet sich mehr als ein molekulares Merkmal. Somatische MMR-Mutationen können sekundär zum ultramutierten POLE-Phänotyp auftreten. Ebenso können sowohl die POLE- als auch die MMRd-Endometriumkarzinome, die sich durch das Vorhandensein hoher Mutationslast auszeichnen, sekundär P53-abnorme Veränderungen zeigen („multiple classifiers“). In diesem Fall wird der p53mut keine prognostische oder prädiktive Bedeutung zugeschrieben und die Patientin der jeweils prognostisch besseren molekularen Gruppe zugerechnet.
Literatur:
1 Cancer Genome Atlas Research Network: Nature 2013; 497(7447): 67-7 2 Rhiem K et al.: Dtsch Arztebl 2021; 118(11): 32 3 Talhouk A and McAlpine JN:Gynecol Oncol Res Pract 2016;3:14 4 Concin N et al.: Int J Gynecol Cancer 2021; 31(1): 12-39
Das könnte Sie auch interessieren:
Welche Risiken sind zu erwarten?
Die präventive Mastektomie wird vor allem bei genetischer Vorbelastung, z.B. bei BRCA1/2-Mutationen, erwogen. Der Eingriff kann das Brustkrebs-Erkrankungsrisiko deutlich reduzieren, aber ...
Pharmakogenetik zur Vermeidung unerwünschter Arzneimittelwirkungen
Alle praktizierenden Mediziner:innen hatten schon einmal mit unerwünschten Arzneimittelwirkungen zu kämpfen. Wir gehen davon aus, dass diese Nebenwirkungen ein unangenehmer Teil von ...
AI in der Reproduktionsmedizin
Kein Thema bewegt derzeit die Menschen mehr als künstliche Intelligenz (AI – „artificial intelligence“). Wiewohl in der Behandlung des unerfüllten Kinderwunsches in den letzten ...