Beratung und Testung von High-Risk-Patientinnen und mögliche Prävention bei Mutationsträgerinnen
Autorin:
Priv.-Doz. Dr. Gunda Pristauz-Telsnigg, AOA
Klinische Abteilung für Gynäkologie, Universitätsklinik für Frauenheilkunde und Geburtshilfe, Graz
Seit 1994 sind die beiden Tumorsuppressorgene BRCA1 und BRCA2 bekannt und mittlerweile gut etabliert. Es wurden nun weitere Brustkrebs-assoziierte Gene entdeckt, welche die genetische Abklärung immer komplexer machen. Zur medikamentösen Prävention des Mammakarzinoms bei Mutationsträgerinnen läuft in Österreich gerade eine Multicenterstudie, in die Betroffene eingeschlossen werden können.
Ziel in der Onkologie ist die individuelle Betreuung von Krebspatientinnen. Die Feststellung einer genetischen Prädisposition für ein vererbbares Mammakarzinom ist hierfür essenziell. Ein etablierter Risikofaktor für das Auftreten eines Mammakarzinoms ist eine familiäre Krebshäufung. Doch haben Studien gezeigt, dass lediglich durch die Familienanamnese das Auftreten einer Mutation nicht verlässlich genug festgestellt werden kann. Bei etwa 15% der Patientinnen mit einem tripelnegativen Mammakarzinom, unabhängig von der Familienanamnese und unabhängig vom Erkrankungsalter der Patientin, konnte eine Mutation in den beiden Brustkrebsgenen BRCA1 oder BRCA2 nachgewiesen werden.1 Dies hat zu einer Erweiterung der Indikationen zur genetischen Testung für Patientinnen unter 60 Jahren mit einem tripelnegativen Brustkrebs geführt. Ebenso konnte bei Patientinnen mit einem Typ-II-Ovarialkarzinom („high grade“ serös), unabhängig von der Familienanamnese und vom Erkrankungsalter, zu ewa 20% eine Mutation im BRCA1- oder BRCA2-Gen – entweder im Tumor oder in der Keimbahn – festgestellt werden.2,3 Somit wird derzeit allen Patientinnen mit einem „high grade“ serösen Ovarialkarzinom die genetische Testung empfohlen.
Der häufigste Krebs der Frau, jener der Brust, betrifft in Österreich etwa jede achte Frau. Insgesamt erkranken jährlich an die 5200 Frauen in Österreich an Brustkrebs.4 Die genauen Ursachen des sporadischen Brustkrebses (nicht vererbbare Form) sind bis heute noch nicht geklärt. Bei etwa 5–10% aller Brustkrebsfälle und bei etwa 15% der Eierstockkrebsfälle handelt es sich um eine genetische Form, bei der eine Veränderung im Genom der Patientin die Ursache für die Erkrankung ist.2
Bei der Mehrzahl der genetischen Form des Brustkrebses besteht eine Fehlfunktion der Tumorsuppressorgene BRCA1 oder BRCA2. Das BRCA1-Gen liegt auf dem Chromosom 17q21 und besteht aus 22 codierenden Exons. Das BRCA2-Gen liegt auf dem Chromosom 13q13 und besteht aus 26 codierenden Exons. Diese beiden Gene, die jeder Mensch besitzt, die also geschlechtsunabhängig sind, funktionieren als sogenannte Reparaturgene (Schutzgene), die bei der Reparatur von Zellschäden eine zentrale Rolle übernehmen. Sind diese Gene defekt, kann Krebs entstehen.
Bei Frauen sind dies vor allem Krebsarten der Brust und der Eierstöcke. Der Nachweis einer BRCA-Veränderung geht mit einem bis zu 80% erhöhten Risiko einher, im Laufe des Lebens an Brustkrebs zu erkranken.5 Zudem besteht bei bereits erkrankten Frauen ein deutlich erhöhtes Risiko für die Entwicklung eines Brustkrebses der anderen Seite. Die Wahrscheinlichkeit für BRCA-Mutationsträgerinnen, im Laufe ihres Lebens an einem Eierstockkrebs zu erkranken, liegt bei ungefähr 40–60%.2 Bei Männern sind es vor allem bösartige Erkrankungen der Prostata, des Dickdarms und der Bauchspeicheldrüse. Auch wird eine erhöhte Inzidenz des malignen Melanoms bei Mutationen im BRCA2-Gen beobachtet. Die Vererbung dieser Genveränderungen folgt einem autosomal dominanten Erbgang, d.h. die Mutation wird mit einer 50%igen Wahrscheinlichkeit geschlechtsunabhängig an die Nachkommen (also an Männer ebenso wie an Frauen) weitergegeben.
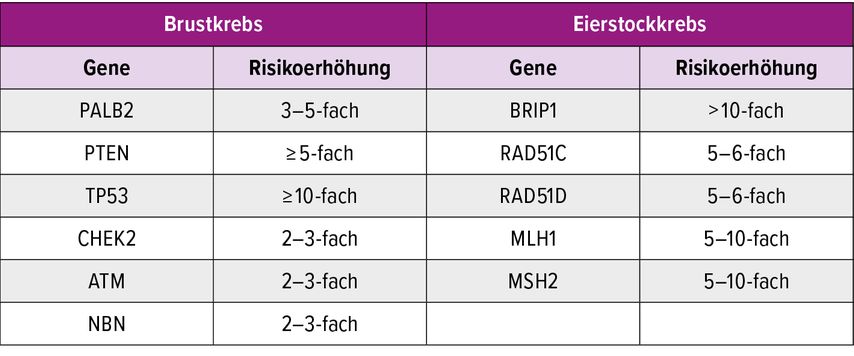
Mittlerweile wurden weitere Brustkrebs-assoziierte Gene entdeckt, auch durch den Einsatz neuer Testungsverfahren.6,7 Mithilfe des NGS („next-generation sequencing“) werden bei einer Untersuchung mehrere Gene gleichzeitig untersucht. So werden heutzutage verschiedene Gen-Panels eingesetzt. An der Universitätsklinik für Frauenheilkunde und Geburtshilfe Graz werden in Zusammenarbeit mit dem Institut für Humangenetik die in Tabelle 1 angeführten Gene mit einem erhöhten Risiko für eine Brutkrebs- oder Eierstockkrebserkrankung zusätzlich zu den beiden Genen BRCA1 und BRCA2 untersucht. Eine Studie, die an der Universitätsklinik für Frauenheilkunde und Geburtshilfe in Graz in Zusammenarbeit mit dem Institut für Humangenetik durchgeführt wurde und 2019 beim San Antonio Breast Cancer Symposium präsentiert wurde, konnte zeigen, dass eine von drei Patientinnen, die selbst erkrankt sind und BRCA1- und BRCA2-negativ getestet wurden, eine Mutation in einem anderen Gen der in Tabelle 1 beschriebenen Genpanele aufweist.8
Tab. 1: Gene, die mit einem erhöhten Risiko für Brust- und Eierstockkrebs assoziiert sind und an der Grazer Universitätsklinik für Frauenheilkunde und Geburtshilfe in Zusammenarbeit mit dem Institut für Humangenetik zusätzlich zu BRCA1 und BRCA2 untersucht werden
Prävention und prophylaktische Operation
Die Beratung hinsichtlich einer prophylaktischen Operation ist komplex und sollte stets „non-directive“ erfolgen. Sowohl die prophylaktische bilaterale Salpingoovarektomie (PBSO) als auch die prophylaktische bilaterale Mastektomie (PBM) stellen die effektivsten Methoden dar, das Risiko für eine Brustkrebs- oder Eierstockkrebserkrankung zu minimieren. Eine Sofortrekonstruktion der Brust sollte jeder Frau angeboten werden. Diesbezüglich stehen viele neue Verfahren mit verschiedensten Techniken zur Verfügung. Ein Überlebensvorteil gegenüber Frauen ohne BRCA-Mutation durch die prophylaktische „Nipple-sparing“-Mastektomie konnte nur für BRCA1-Mutationsträgerinnen gezeigt werden.9 Einen Überlebensvorteil sowohl für BRCA1- und BRCA2-Mutationsträgerinnen bringt allerdings die prophylaktische kontralaterale Mastektomie bei bereits erkrankten Brustkrebspatientinnen.10
Für junge Risikopatientinnen, die die Familienplanung bereits abgeschlossen haben, aber noch nicht durch eine Ovarektomie in die Menopause kommen möchten, scheint die prophylaktische Eileiterentfernung eine Option zur Reduktion des Risikos für ein Ovarialkarzinom zu sein. Wissenschaftliche Untersuchungen konnten zeigen, dass niedrig differenzierte („high grade“) seröse Karzinome der Ovarien, der Tuben und des Bauchfells eine gemeinsame Entstehung aufweisen. Sogenannte STIC(„serous tubal intraepithelial carcinoma“)-Zellen im Bereich der Fimbrien der Tuben scheinen Vorläuferzellen dieser serösen Karzinome darzustellen.11,12 Bei einem Großteil aller „high grade“ serösen Ovarialkarzinome können histologisch solche Vorläuferzellen in den Tuben diagnostiziert werden.13,14 Die größte Reduktion des Risikos für den Eierstockkrebs mitbis zu 90% stellt allerdings nach wie vor die Entfernung der Tuben und Eierstöcke dar.15 Der Zeitpunkt der Operation sollte mit der Patientin anhand von individuellen Faktoren, wie z.B. Ovarialkarzinomanamnese in der Familie oder der Möglichkeit der Hormonersatztherapie, festgelegt werden. Studien konnten zeigen, dass eine Hormonersatztherapie über fünf Jahre hinweg keinen nachteiligen Effekt auf die Risikoreduktion durch die Operation zu haben scheint.
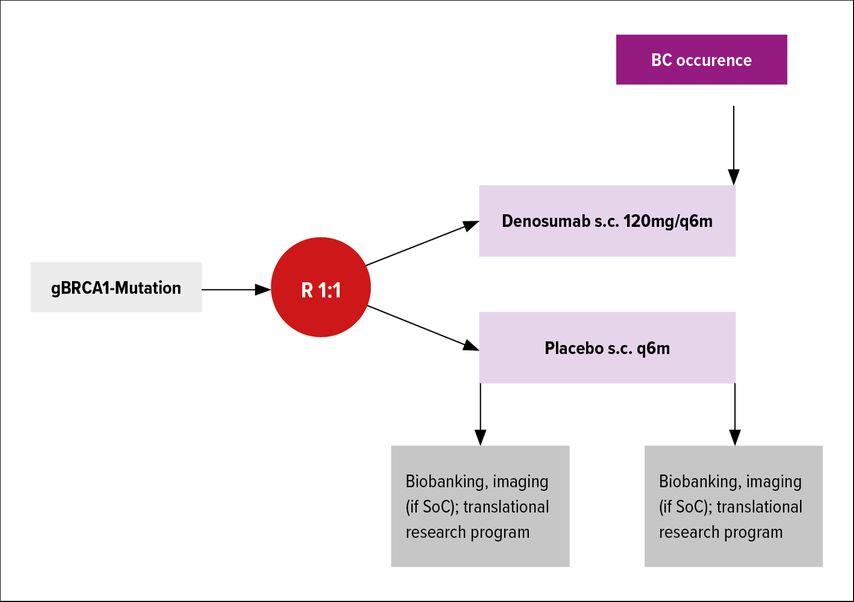
Ein neues Konzept der medikamentösen Prävention wird derzeit in der ABCSG-50- (BRCA-P)-Studie untersucht. Hierbei wird Denosumab, welches in Tierversuchen und präklinischen Studien vielversprechende Ergebnisse zur Brustkrebsprävention gezeigt hat, angewandt. Durch die Hemmung des RANK/RANKL-Mechanismus werden verschiedene Proliferations- und Reifungsprozesse an der Brustzelle blockiert, was protektiv für das Auftreten eines Mammakarzinoms sein soll. In dieser Studie, die für die Rekrutierung an fünf österreichischen Zentren offen ist, werden BRCA1-positiven gesunden Frauen ohne vorangegangene prophylaktische Operationen im Alter von 25 bis 55 Jahren zweimal jährlich 120mg Densosumab verglichen mit Placebo über 5 Jahre verabreicht. Endpunkt dieser Studie ist die Bewertung der Risikoreduktion durch die Gabe von Denosumab (Abb.1).
Abb. 1: Studiendesign der ABCSG-50/BRCA-P-Studie zur Bestimmung der präventiven Wirkung von Denosumab auf Brustkrebs bei Frauen mit BRCA1-Keimbahnmutation16
Die genetische Testung von Betroffenen ist nicht nur zur Feststellung des Risikos für das Auftreten von verschiedensten Karzinomen und zur Prävention sinnvoll, vielmehr werden heutzutage auch Therapieentscheidungen aufgrund von bestimmten Genmutationen in der Keimbahn oder im Tumor getroffen. Längst haben Medikamente, wie PARP-Inhibitoren, die genau auf diese DNA-Reparaturmechanismen abzielen, Einzug in die therapeutische Landschaft beim Ovarialkarzinom und Mammakarzinom gehalten.
Fazit
Das Feld der Tumorgenetik ist ein sich ständig weiterentwickelndes Gebiet mit immer wieder neuen Erkenntnissen. Mit der Entwicklung von neuen Technologien wie dem NGS konnte laufend Wissen über verschiedenste neue Gene generiert werden, weshalb derzeit die Testung auf mehrere Gene, neben den zwei bekanntesten Genen BRCA1 und BRCA2, ausgeweitet wurde. Durch prophylaktische Operationen steht die größtmögliche Reduktion des Risikos für eine Erkrankung zur Verfügung. Eine individuelle Beratung von Betroffenen diesbezüglich ist notwendig.
Literatur:
1 Couch et al.: Inherited mutations in 17 breast cancer susceptibility genes among a large triple-negative breast cancer cohort unselected for family history of breast cancer. J Clin Oncol 2015; 33(4): 304-11 2 Pal T et al.: BRCA1 and BRCA2 mutations account for a large proportion of ovarian carcinoma cases. Cancer 2005; 104(12): 2807-16 3 Ramus SJ, Gayther SA: The contribution of BRCA1 and BRCA2 to ovarian cancer. Mol Oncol 2009; 3(2): 138-50 4 Statistik Austria, www.statistik.at 5 US Preventive Task Force Evidence Syntheses 2013 6 Balmaña J et al.: BRCA in breast cancer: ESMO clinical practice guidelines. Ann Oncol 2011; (Suppl 6): vi31-4 7 Venkitaraman AR: Functions of BRCA1 and BRCA2 in the biological response to DNA damage. J Cell Sci 2001; 114(Pt 20): 3591-8 8 Trapp E et al.: SABCS 2019, Posterpräsentation (P5-03-09) 9 Heemskerk-Gerritsen BAM et al.: Survival after bilateral risk-reducing mastectomy in healthy BRCA1 and BRCA2 mutation carriers. Breast Cancer Res Treat 2019; 177(3): 723-33 10 Metcalfe K et al.: Contralateral mastectomy and survival after breast cancer in carriers of BRCA1 and BRCA2 mutations: retrospective analysis. BMJ 2014; 348: g226 11 Kurman RJ, Shih I-M: Molecular pathogenesis and extraovarian origin of epithelial ovarian cancer. Shifting the paradigm. Hum Pathol 2011; 42(7): 918-31 12 Crum CP et al.: Lessons from BRCA: the tubal fimbria emerges as an origin for pelvic serous cancer. Clin Med Res 2007; 5(1): 35-44 13 Cibula D et al.: Tubal ligation and the risk of ovarian cancer: review and meta-analysis. Hum Reprod Update 2011; 17(1): 55-67 14 McAlpine JN et al.: Opportunistic salpingectomy: uptake, risks, and complications of a regional initiative for ovarian cancer prevention. Am J Obstet Gynecol 2014; 210(5): 471.e1-11 15 Rebbeck TR et al.: Meta-analysis of risk reduction estimates associated with risk-reducing salpingo-oophorectomy in BRCA1 or BRCA2 mutation carriers. J Natl Cancer Inst 2009; 101(2): 80-7 16 www.abcsg.org
Das könnte Sie auch interessieren:
Postpartale Blutung im Fokus
Wenn sich die Sonne über dem Tafelberg erhebt und das goldene Licht über Kapstadt legt, ahnt man kaum, dass sich hier im Oktober 2025 mehr als 8000 Fachpersonen aus über 130 Ländern ...
Künstliche Intelligenz in der Brustpathologie
Die Einführung von künstlicher Intelligenz (KI) markiert einen Paradigmenwechsel in der Pathologie – insbesondere in der Brustpathologie. Validierte KI-Tools steigern bereits heute ...
Muss das duktale Carcinoma in situ noch operativ behandelt werden?
Das duktale Carcinoma in situ (DCIS) ist ein möglicher Vorläufer des invasiven Mammakarzinoms, wird jedoch zunehmend als heterogene Entität erkannt, sodass eine Standardtherapie mit ...