Präzisionsdiagnostik bei kutanen Lymphomen
Autorin:
PD Dr. Regina Fink-Puches
Universitätsklinik für Dermatologie und Venerologie
Medizinische Universität Graz
E-Mail: regina.fink@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
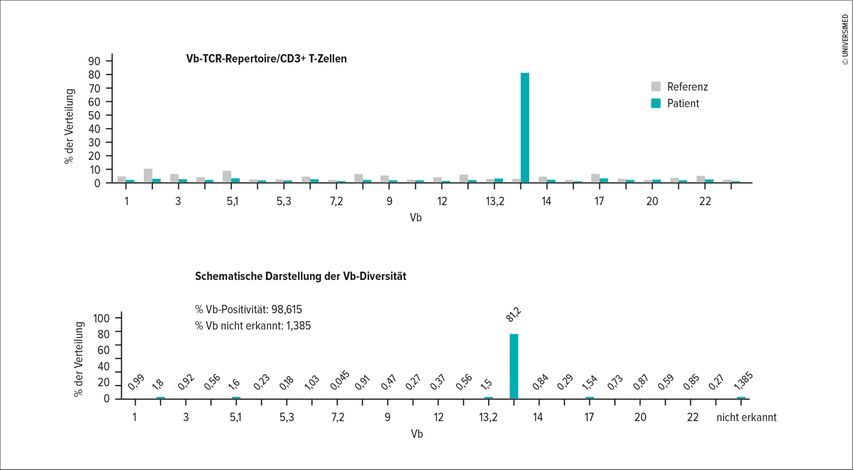
Die Analyse des T-Zell-Rezeptor-Repertoires bei Patienten mit erythrodermatischen Verlaufsformen bildet die Grundlage für eine zielgerichtete und individualisierte Therapie. Ausschlaggebend dabei ist die Vβ-Kette des T-Zell-Rezeptors, ihre Zusammensetzung bestimmt die Wahl der Antikörpertherapie.
Klassifikation kutaner Lymphome
Mycosis fungoides
Die Mycosis fungoides (MF) ist das häufigste aller kutanen T-Zell-Lymphome (CTCL) und macht mit einer Inzidenz von 1–2/100000 ca. 60% dieser Gruppe aus. Sie wurde 1860 erstmals durch Alibert und Bazin beschrieben und betrifft meist Menschen im fortgeschrittenen Erwachsenenalter. Männer sind etwas häufiger betroffen als Frauen. Die MF entwickelt sich meist sehr langsam über Jahre und Jahrzehnte über Patches und Plaques (T1–T2, frühe Läsionen) ins Tumorstadium (T3) oder manchmal auch in ein erythrodermatisches Stadium (T4). Sie zählt grundsätzlich mit einem meist indolenten klinischen Verlauf zu den niedrig malignen kutanen T-Zell-Lymphomen und weist eine 5-Jahres-Überlebensrate von etwas mehr als 80% auf.1 Progression ins Tumorstadium allerdings bedeutet einen massiven Einschnitt in der Prognose der Erkrankung, denn dann sinkt die Überlebensrate von >80% auf ca. 40%. Gerade wenn die MF in jüngeren Jahren auftritt – sie kann leider auch schon bei Kindern auftreten – ist es sehr wahrscheinlich, dass der Patient nach Jahren die Progression ins Tumorstadium erlebt.
Das Sézary-Syndrom
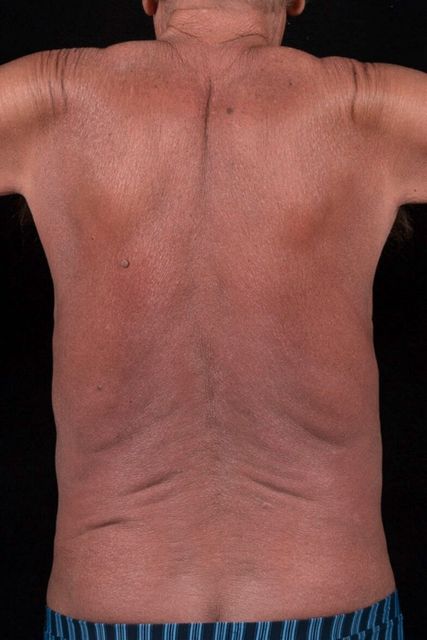
Das Sézary-Syndrom wurde 1938 durch Sézary und Bouvrain erstmals beschrieben. Es macht ca. 5% aller kutanen Lymphome aus und tritt meist um das 60. Lebensjahr auf. Auch hier sind Männer etwas häufiger betroffen als Frauen. Das Sézary-Syndrom ist gekennzeichnet durch eine Erythrodermie und generalisierte Lymphadenopathie sowie den Nachweis einer neoplastischen T-Zell-Population im peripheren Blut. Des Weiteren können schwere, diffuse Alopezien, Onychodystrophie, palmoplantare Hyperkeratosen und vor allem ein generalisierter, ausgeprägter und sehr quälender Juckreiz bestehen. Die 5-Jahres-Überlebensrate ist beim Sézary-Syndrom wesentlich geringer und beträgt ca. 36%.1 Obwohl es insgesamt ein großes therapeutisches Spektrum sowohl für die MF als auch für das Sézary-Syndrom gibt, das von sogenannten „Skin directed“-Therapien über die verschiedenen Formen der Lichttherapie bis zu unterschiedlichsten Systemtherapien reicht, besteht nach wie vor der Wunsch nach besseren therapeutischen Strategien, insbesondere auch, weil diese Erkrankungen bis heute nicht heilbar sind. Durch die quantitative Bestimmung des T-Zell-Rezeptor(TCR)-Vβ-Repertoires von T-Lymphozyten mittels Durchflusszytometrie (DFC) und anschließende Immunphänotypisierung der klonalen Zellen ist es uns möglich, vor allem bei erythrodermatischen Verlaufsformen der Erkrankung (erythrodermatische Mycosis fungoides/Sézary-Syndrom), zielgerichtete, individuell angepasste Therapien („targeted therapies“) für jeden einzelnen Patienten anzuwenden.
Grundlagen der T-Zell-Reifung
Der T-Zell-Rezeptor (TCR) ist ein Komplex, der auf allen T-Zellen ausgebildet ist und zwei Subpopulationen umfasst, die einander ausschließen: αβ-T-Zellen und γδ-T-Zellen. Die meisten T-Zellen im peripheren Blut und in den lymphatischen Organen haben den αβ-Typ (90–99% aller T-Zellen). αβ-T-Zellen können weiter in CD4-positive (etwa 2/3 von αβ) und CD8-positive T-Zellen (etwa 1/3 der αβ-Zellen) sowie in die sehr selten vorkommenden CD4-negativen, CD8-negativen Zellen unterteilt werden.
Die Spezifität und Vielfalt des T-Zell-Rezeptors bilden sich während der Lymphozytenentwicklung durch Kombination der verschiedenen V-, D- und J-Gensegmente („variable“, „diversity“, „joining“) und durch Deletion und/oder Insertion von Nukleotiden an den Verbindungsstellen dieser Segmente aus. Dieser randomisierte Prozess kann zu >1018 unterschiedlichen αβ-TCR führen, was es höchst unwahrscheinlich macht, zwei separate TCR mit einer identischen Nukleotid-CDR3-Sequenz zu erzeugen. Daher stellt die TCR-Nukleotidsequenz jeder T-Zelle einen „eingebauten Strichcode“ dar, der es uns ermöglicht, jeden spezifischen T-Zellklon zu erkennen und zu verfolgen.2
Während der zellulären Immunantwort reagieren T-Zellen auf bestimmte Antigene. Nur T-Zellen, welche einen TCR gegen ein spezifisches Antigen aufweisen, lösen eine Interaktion mit den Antigen-präsentierenden Zellen in Gegenwart von spezifischen Zellen (dendritische Zellen, Makrophagen, B-Zellen) aus. Diese Aktivierung, welche in ganz frühen Stadien der T-Zell-Reifung stattfindet, führt zur klonalen Expansion spezifischer T-Zellen.
Differenzierung kutaner Lymphome anhand von T-Zell-Subpopulationen
Bei MF und Sézary-Syndrom differenzieren Vorläuferzellen in sogenannte zentrale Gedächtnis-T-Zellen (engl. „central memory T-cells“, TCM) bzw. in Gewebsgedächtnis-T-Zellen (engl. „tissue-resident memory T-cells“, TRM) und bestimmen das klinische Bild des CTCL.3
Campbell et al. zeigten bereits vor vielen Jahren, dass die malignen T-Zellen der MF TRM-Zellen sind, während die malignen Sézary-T-Zellen TCM-Zellen sind.4 Das zeigt sich auch im klinischen Bild: Skin-TRM-Zellen sind eine nichtmigratorische Population, klinisch haben MF-Patienten fixe Patches, Plaques und Tumoren. TCM-Zellen rezirkulieren zwischen Blut, LK und Haut; Patienten mit einem TCM-Phänotyp (Sézary-Syndrom) zeigen Erythrodermie und leukämische Erkrankungsvarianten (Abb. 1).4
Auf genetischer Ebene sind diese Zellen nun bereits klonal für einen umgelagerten T-Zell-Rezeptor – d.h., eine klonale Aktivierung dieser Zellen hat bereits stattgefunden. Vor der kompletten Differenzierung in TCM- oder TRM-Zellen führen frühe Mutationen zur Malignität der Zelle, welche weiter expandieren und sich klonal vermehren.
Auf diesen Tatsachen beruht nun die quantitative Bestimmung des TCR-Vβ-Repertoires von menschlichen T-Lymphozyten mittels Durchflusszytometrie, wobei mit unserer Analysetechnik (Beta Mark TCR Vbeta Repertoire Kit, 25 Tests, RUO, Product; No: IM3497) 24 verschiedene TCR-Vβ-Gensegmente detektiert werden können, was ca. 70% des normalen humanen TCR-Vβ-Repertoires entspricht (Abb. 2).
Einsatz therapeutischer Antikörper basierend auf T-Zell-Rezeptor-Varianten
Nach Identifikation der Vβ-Kette eines Klons werden die Zellen mit unterschiedlichen Antikörpern gefärbt und anschließend ausgewertet. Für folgende spezifische Antigene, die am Klon exprimiert werden, stehen uns auch therapeutische Antikörper zur Verfügung: CD30, CD52, CCR4 und KIR3DL2.
Gegen CD52, welches auf den meisten malignen Lymphozyten exprimiert wird, richtet sich Alemtuzumab, ein humanisierter IgG1-AK. Durch die Bindung dieses Antikörpers entstehen eine Antikörper-abhängige Zytotoxizität und daraus resultierend eine komplementmediierte Zell-Lyse und Apoptose. Diese Substanz ist von der FDA zur Behandlung der chronischen lymphatischen Leukämie und der Multiplen Sklerose zugelassen, die MF und das Sézary-Syndrom können nur im „off-label use“ im Rahmen der Therapiefreiheit angewendet werden.5
Brentuximab-Vedotin ist ein chimärer monoklonaler Anti-CD30-Antikörper, gekoppelt an Monomethyl Auristatin E (MMAE). Hierbei handelt es sich um ein sogenanntes Spindelgift, das die Tubulinpolymerisierung stoppt. Nach Antikörperbindung wird dieses in der Zelle freigesetzt, damit kommt es letztendlich zur Apoptose der Tumorzellen. CD30 selbst ist ein Transmembran-Protein, welches für die Regulation der Entwicklung von CD4+ Zellen (Monozyten, Makrophagen und T-Helferzellen) eine wichtige Rolle spielt.6
CCR4 wird vor allem auf den Zellen des Immunsystems exprimiert und ist mit-verantwortlich für die Zellmigration. CCR4 ist ein Rezeptor für zahlreiche Liganden, vor allem für CCL17 und CCL22. CCR4-CCL17/CCL22-Interaktionen sind essenziell für die KH-Progression bei CTCL. Sie ermöglichen den Eintritt maligner T-Zellen aus dem Blut in Dermis und Epidermis. CCR4 ist in allen Stadien der MF stark exprimiert, zeigt eine Zunahme der Expression mit Progression der Erkrankung und ist ein Target für die Therapie des CTCL.
Mogamulizumab ist ein rekombinanter humanisierter AK (IgG1-Kappa-Immunglobulin) mit antineoplastischer Wirkung, der selektiv an Chemokinrezeptor 4 (CCR 4) bindet und damit eine Antikörper-abhängige zelluläre Zytotoxizität auslöst. Durch den Prozess der sogenannten Defucosylierung wird die Zahl der Fucosemoleküle (Zuckerketten, die für den therapeutischen Effekt nicht benötigt werden) im AK reduziert, damit entsteht eine stärkere Bindung von Mogamulizumab an die Immuneffektorzelle.7
KIR3DL2 wird auf Untergruppen normaler CD8+ T-Zellen und NK-Zellen exprimiert. Des Weiteren haben mehrere Studien gezeigt, dass KIR3DL auch von neoplastischen CD4+ T-Zellen in bis zu 90% bei Sézary-Syndrom-Patienten und auch bei Patienten mit fortgeschrittener MF exprimiert wird. Die relativ spezifische Expression von KIR3DL2 auf diesen malignen CTCL-Zellen macht es zu einem idealen therapeutischen Ziel für Lacutamab (Anti-KIR3DL2-Antikörper), einen humanisierten zytotoxizitätsinduzierenden Antikörper, der derzeit noch in klinischen Studien getestet wird.8
Literatur:
1 Willemze R et al.: The 2018 update of the WHO-EORTC classification for primary cutaneous lymphomas. Blood 2019; 133: 1703-14 2 Matos TR et al.: Research techniques made simple: high-throughput sequencing of the T-cell receptor. J Invest Dermatol 2017; 137(6): e131-8 3 Stadler R, Hain C: Neues zu Pathogenese und molekularem Verständnis bei kutanen T-Zell-Lymphomen. Dermatologie 2022; 73: 765-77 4 Campbell JJ et al: Sezary syndrome and mycosis fungoides arise from distinct T-cell subsets: a biologic rationale for their distinct clinical behaviors. Blood 2010; 116(5): 767-71 5 Lundin J et al.: Phase 2 study of alemtuzumab (anti-CD52 monoclonal antibody) in patients with advanced mycosis fungoides/Sezary syndrome. Blood 2003; 101(11): 4267-72 6 Stranzenbach R et al.: Brentuximab vedotin in CD30 + cutaneous lymphoma: How do we treat, how shall we treat? A review of the literature. Br J Dermatol 2017; 177(6): 1503-9 7 Kim et al.: Mogamulizumab versus vorinostat in previously treated cutaneous T-cell lymphoma (MAVORIC): an international, open-label, randomised, controlled phase 3 trial. Lancet Oncol 2018; 19: 1192-204 8 Oka T, Miyagaki T: Novel and future therapeutic drugs for advanced mycosis fungoides and Sézary syndrome. Front Med (Lausanne) 2019; 6: 116
Das könnte Sie auch interessieren:
Behandlungspfad „Atopische Dermatitis“
Das Netzwerk onkoderm hat seine Empfehlungen für die ambulante Versorgung von Patienten mit atopischer Dermatitis aktualisiert: Der onkoderm-Behandlungspfad 2025 sowie weitere Tools ...
STI: aktueller Diskurs zum Anstieg der Fallzahlen
Die globale Inzidenz von sexuell übertragbaren Infektionen (STI) steigt fortwährend. Immer häufiger wird das Thema auch in fachunspezifischen breiten Medien aufgegriffen und z.B. in ...
Wege zur korrekten Diagnose
Patientinnen und Patienten mit verhärteter Haut können an sehr unterschiedlichen Erkrankungen leiden. Im Zentrum steht immer ein Fibroblast, eine mesenchymale Vorläuferzelle, die durch ...