Periphere arterielle Verschlusskrankheit


Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Nach wie vor haben Patient*innen mit peripherer arterieller Verschlusskrankheit (PAVK) national wie international eine sehr schlechte Prognose.
Zu einem gewissen Teil wird dies durch eine nach wie vor weitverbreitete inadäquate Richtlinienadhärenz verursacht. Andererseits zeigte eine deutsche Publikation, dass 37% der PAVK-Patient*innen, die während eines stationären Aufenthaltes eine Amputation an der unteren Extremität erhielten, innerhalb von zwei Jahren vor dem Ereignis keinerlei angiografische Gefäßdarstellung, geschweige denn einen Revaskularisationsversuch erhielten.1
Dies ist umso betrüblicher, als in den letzten fünf Jahren große Fortschritte bei sogenannten „Below the ankle“(BTA)-Eingriffen erzielt wurden, also nun aufgrund von Weiterentwicklungen der Kathetertechnologien, oft auch erfolgreich Wiedereröffnungen von verengten oder gar verschlossenen Gefäßen unterhalb der Knöchelebene möglich geworden sind.2,3
Mit anderen Worten: Auch distale Probleme an der Arteria dorsalis pedis (Endstrecke der Arteria tibialis anterior) oder der Arteria fibularis (Endstrecke der Arteria tibialis posterior) sind heute oft erreichbar. Mittlerweile ist auch klar erwiesen, dass das bestmögliche Ergebnis bei akralen Ulzera erreicht werden kann, wenn zumindest eine Achse, noch besser natürlich beide Achsen wieder an den Durchblutungskreislauf angeschlossen werden können.5
Effiziente Diagnostik
Damit nun in möglichst vielen hausärztlichen, aber auch allgemein-internistischen Praxen nach PAVK kosteneffizient gescreent werden kann, sollte man die einfachsten Prinzipien in einem ersten Schritt nicht vergessen:
-
Sehen: Bewegungsmuster des Patienten erkennen – „Watschelgang“-Coxarthrose, Schmerzen beim Wiederaufrichten aus dem „japanischen Gruß“
-
Anamnese: die richtigen Fragen stellen – z.B. Claudicatio intermittens vs. Claudicatio spinalis (Erholungsdauer beim Stehenbleiben)
-
Spüren: Pulse tasten
-
Hören: Auskultation von Strömungsgeräuschen
Hämodynamische Untersuchungen
In zweiter Linie kommen dann hämodynamische Untersuchungen zum Tragen:
-
Taschendoppler (billig!): „Ein triphasisches Geräusch macht Sie und den Patienten sicher.“
-
Semiautomatische Ankle-Brachial-Index-Messung (teurer): Bei 80mmHg Knöcheldruck respektive >50mm Hg Zehendruck liegt fast immer kein Bein- oder lebensgefährdendes Stadium III vor.
-
Farbcodierte Duplexsonografie (mit Gefäßschallkopf noch teurer): Ist für die exakte Morphologie sehr schön, hängt aber vom Aufkommen ab (Anschaffungskosten, Trainingszeit).
-
Bitte keine Screening-CT-Angiografie (CTA) oder Magnetresonanzangiografie (MR); diese haben zuletzt massiv zugenommen, sind aber zumeist nicht zielführend.
Weiteres Vorgehen
-
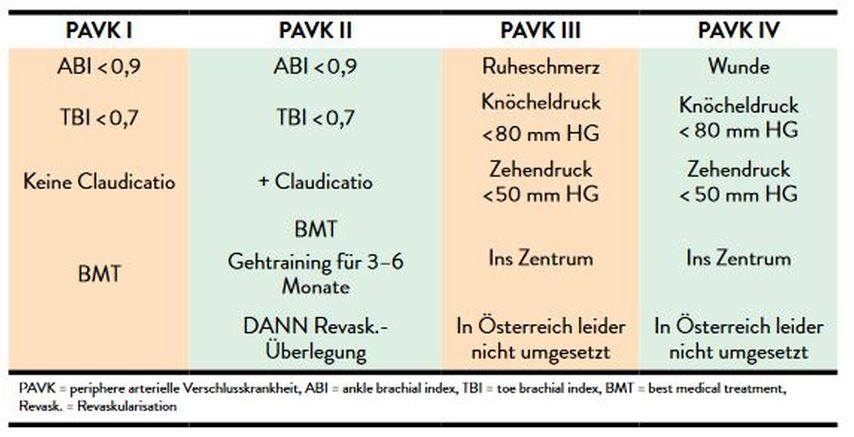
Die Management-Entscheidungen bei Patient*innen mit PAVK sollten einem klaren effizienz- und evidenzbasierten Algorithmus (Tab.1) folgen: Während im Stadium I und II nach Fontaine einer bestmöglichen Pharmakotherapie („best medical treatment“ – BMT) der größte Stellenwert in der Praxis zukommt, ist es ebenso wichtig, Patient*innen im Stadium III und IV frühzeitig in der Praxis zu erkennen, um diese dann rasch an einem Zentrum vorstellen zu können.
Fallstricke bei Diabetes mellitus
Das Tückische sind insbesondere PAVK-Patient*innen mit zusätzlichem Diabetes mellitus, da bei diesen häufig zusätzlich eine Polyneuropathie (PNP) besteht, wodurch einige klassische Screening-Tools versagen:
-
Aufgrund einer Koinzidenz einer PAVK mit einer sensomotorischen PNP besteht oft keine typische Claudicatio-Symptomatik.
-
Die offenen AV-Shunts bei autonomer PNP führen zu warmer, rosiger Haut, wiewohl eine schwere Ischämie besteht.
-
Die Mönckeberg’sche Mediasklerose macht die ABI(ankle brachial index; Knöchel-Arm-Index)-Beurteilung unsicher (falsch hoch).
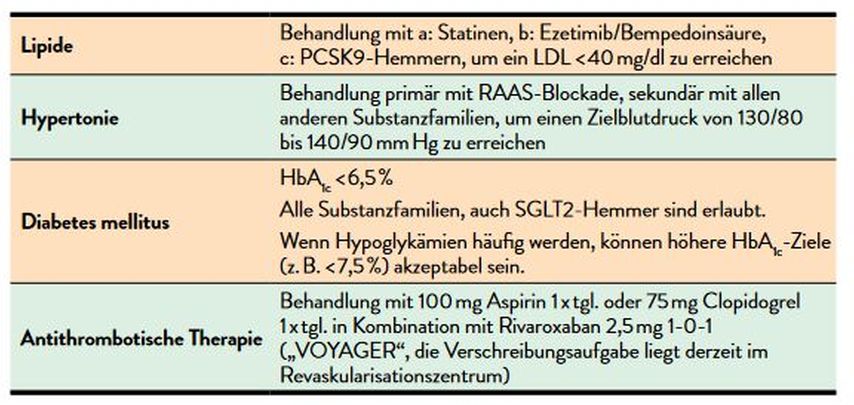
Tab.2: Empfehlungen für die Reduktion von MACE- und MALE-Ereignissen bei PAVK I und II nach Fontaine (aber ohne Revaskularisation) 2022/2023 (modifiziert nach Schernthaner GH 2022) 15
Tab.3: Empfehlungen für die Reduktion von MACE- und MALE-Ereignissen bei PAVK II mit Revaskularisation und PAVK III und PAVK IV 2022/2023 (modifiziert nach Schernthaner GH 2022)15
Effiziente Therapie
Mehrere Studien der letzten Jahre (EUCLID6–8, DECLARE-TIME 589–10, VOYAGER11,12; aber auch andere) haben eigentlich verschiedene Risikopopulationen innerhalb der Patient*innen mit PAVK erkennen lassen.
Das Risiko für ein „major adverse cardiovascular event“ (MACE), aber auch ein „major adverse limb event“ (MALE) ist natürlich in der kritischen Ischämie (Fontaine-Stadium III–IV) höher als bei Patient*innen mit Claudicatio-Symptomatik (Fontaine-Stadium II). Innerhalb der Patient*innen mit Claudicatio haben welche, die bereits einer Revaskularisation bedurften, eine Wahrscheinlichkeit von >80%, innerhalb von zwei Jahren wieder ein MALE zu erleiden.6–12
Therapieziele
Dementsprechend ist es sehr sinnvoll, für die beiden Populationen PAVK I und PAVK II ohne Revaskularisation auf der einen sowie PAVK II mit Revaskularisation und PAVK III und PAVK IV auf der anderen Seite für die Praxis unterschiedliche, da evidenzbasierte Ziele zu formulieren (Tab.2 und 3). Es soll hier explizit erinnert werden, dass aufgrund der massiv gesteigerten MALE-Häufigkeit bei Patient*innen mit PAVK II und stattgefundener Revaskularisation sowie bei PAVK III und PAVK IV einerseits ein LDL-Ziel von <40 statt 55mg/dl verfolgt werden muss, anderseits kann die antithrombotische Therapie mit einem Rivaroxaban 2,5mg 2xtgl. ergänzt werden.11,12
Langfristig sollte es das Ziel für alle PAVK-Patient*innen sein, die Ziele, wie in den Tabellen 2 und 3 geschildert, zu verfolgen, da dann eine deutlich bessere 5-Jahres-Überlebensrate von >70%13 oder gar >90%14 erreichbar scheint.
Diese Ziele werden nur durch eine engmaschige Betreuung im niedergelassenen Bereich und bei Bedarf Vorstellung im Zentrum zur Revaskularisation und bei kritischer Ischämie zu erreichen sein.
Literatur:
Reinecke H et al.: EHJ 2015; 36: 932
Iida O et al.: Eur J Vasc Endovasc Surg 2012; 43:313-21
Shiraki T et al.: Eur J Vasc Endovasc Surg 2015; 49:565-73
Huizing E et al.: J Vasc Interv Radiol 2019; 30:1361-8
Jung HW et al.: Eur J Vasc Endovasc Surg 2019; 58:854-63
Hiatt WR et al.: N Engl J Med 2017; 376: 32-40
Jones WS et al.: Circulation 2017; 135: 241-50
Norgren L et al.: Eur J Vasc Endovasc Surg 2018;55: 109-17
Wiviott SD et al.: N Engl J Med 2019; 380: 347-57
Bonaca MP et al.: Circulation 2020; 142: 734-47
Bonaca MP et al.: N Engl J Med 2020; 382: 1994-2004
Hess C et al.: Circulation 2021; 144: 1831-41
Hussain MA et al.: JAMA Surg 2016; 151: 742-50
Höbaus C et al.: Ann Med 2017; 49: 291-8
Schernthaner GH: Gefäßpatient:innen in der Praxis.ÖGIM 2022
Das könnte Sie auch interessieren:
ALLGEMEINE+ auf universimed.com
Ab sofort finden Sie alle Inhalte von ALLGEMEINE+ auf unserem Portal universimed.com! Sie müssen nichts weiter tun - die Log-in-Daten bleiben dieselben.
Basispauschalierung
Zur Basispauschalierung bei selbstständiger Tätigkeit könnte es bereits für das Jahr 2025 Änderungen geben, die fallweise eine Steueroptimierung möglich machen.
Einsatz von KI-Tools in der Ordination
Die Integration künstlicher Intelligenz (KI) in den medizinischen Alltag verspricht Effizienzsteigerungen, präzisere Diagnosen und entlastende Automatisierung. Doch bevor man KI-basierte ...