Neue Impfstoffe
Autorin:
Dr. Angelika Wagner, PhD
Fachärztin für Spezifische Prophylaxe und Tropenmedizin
Zentrum für Pathophysiologie, Infektiologie und Immunologie
Medizinische Universität Wien
E-Mail: angelika.wagner@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Impfungen leisten einen wesentlichen Beitrag zur Prävention von Infektionserkrankungen. Trotz der Vielzahl bereits verwendeter Impfstoffe sind weitere Anpassungen bzw. die Entwicklung von neuen Impfstoffen gegen weitere Pathogene wichtig zur Infektionsbekämpfung. Im Folgenden werden Vakzine gegen Pneumokokken, Meningokokken und Chikungunya vorgestellt, die derzeit der Europäischen Arzneimittelbehörde zur Begutachtung vorliegen bzw. bereits zugelassen sind und kurz vor der Markteinführung stehen.
21-valenter Pneumokokken-Konjugat-Impfstoff
Die Pneumokokken-Impfung wird seit vielen Jahren schon zur Prävention eingesetzt. Ziel ist es, nicht nur durch Streptococcus pneumoniae verursachte Erkrankungen zu verhindern – allen voran Pneumonien, Sepsis und Meningitis –, sondern auch postinfektiöse Folgeschäden zu vermeiden. Hierzu zählen durch die Infektion resultierende verminderte Funktionen betroffener Organe sowie ein erhöhtes Risiko für kardiovaskuläre Ereignisse, Rehospitalisierungen, die verstärkte Altersgebrechlichkeit/Frailty, die die selbstständige Lebensführung bedroht, und die erhöhte Gesamtmortalität vor allem bei Patienten mit Komorbiditäten.
Über 100 Serotypen von S. pneumoniae sind bekannt, wobei nur ein Teil dieser Serotypen durch Impfstoffe abgedeckt wird. Die Auswahl der Serotypen erfolgt anhand der Inzidenz bzw. der Pathogenität. Zudem ist bei Kindern und Erwachsenen ein unterschiedliches Spektrum an Serotypen verantwortlich für invasive Pneumokokken-Erkrankungen.
Epidemiologische Analysen haben gezeigt, dass die Verabreichung von Pneumokokken-Impfstoffen im Rahmen von Kinderimpfprogrammen nicht nur die Krankheitshäufigkeit mit den durch die verwendeten Impfstoffe abgedeckten Serotypen bei den geimpften Kindern, sondern auch bei nicht geimpften Erwachsenen senken kann. Jedoch wurde festgestellt, dass sich daraufhin die Lücken mit anderen, nicht in den verwendeten Impfstoffen enthaltenen Serotypen füllen. Kommt es zu einem starken Anstieg invasiver Erkrankungen durch Serotypen spricht man von Serotypen-Replacements.
Neuer Impfstoff PCV21
Ein neu entwickelter 21-valenter Impfstoff für Erwachsene (CAPVAXIVE) soll dem entgegenwirken, 8 Serotypen werden erstmals in einem Impfstoff inkludiert sein. Für die Zulassung wurden wie bei anderen höhervalenten Pneumokokken-Konjugat-Impfstoffen (PCV15 [Vaxneuvance], PCV20 [Prevenar20]) keine Wirksamkeitsdaten, sondern Sicherheitsdaten und immunologische Ergebnisse im Vergleich zu anderen Impfstoffen eingereicht.
In den klinischen randomisierten, verblindeten Studien wurde die einmalige i.m. Gabe von PCV21 mit den bereits zugelassenen Impfstoffen PCV20 und dem 23-valenten Polysaccharid-Impfstoff (Pneumovax23) verglichen. Die lokalen und systemischen Reaktionen waren zwischen den Impfstoffen vergleichbar. Am häufigsten waren Schmerzen an der Impfstelle (ca. 40%), Müdigkeit (ca. 20%) und Kopfschmerz (ca. 20%), wobei die Reaktionen in der jüngeren Altersgruppe (18 bis 49 Jahre) häufiger auftraten als in der älteren Kohorte (≥50 Jahre).
Die Immunantwort wurde anhand von opsonisierenden Antikörpern (OPA-Titer) gegen die im Impfstoff enthaltenen Serotypen einen Monat nach Impfung gemessen. Diese Antikörper erreichen durch die Bindung an den Erreger sowohl eine verbesserte Erkennung als auch Beseitigung des Erregers durch das Immunsystem.
Die Ergebnisse haben gezeigt, dass die Antikörpertiter gegen die in PCV21 und in den Vergleichsimpfstoffen enthaltenen Serotypen nach PCV21 nicht geringer waren (Nichtunterlegenheit). Die Antikörperspiegel gegen Serotypen, die nicht in den Vergleichsimpfstoffen beinhaltet sind, waren höher („superiority“; Überlegenheit) nach PCV21 als nach Impfung mit den Vergleichsimpfstoffen (mit Ausnahme von Serotyp 15C). Zudem hat die Impfung mit PCV21 zu einem mindestens vierfachen Titeranstieg bei ca. 80% der Geimpften geführt. Diese Daten zeigen somit ein mit anderen Pneumokokken-Impfstoffen vergleichbares Sicherheitsprofil und gutes immunologisches Ansprechen der Impflinge auf die PCV21-Impfung.
Des Weiteren wurde auch gezeigt, dass die gleichzeitige Verabreichung von PCV21 mit Influenza-Impfstoffen sicher ist und zu einem vergleichbaren Impfansprechen führt. Bei zuvor mit anderen Pneumokokken-Impfstoffen Geimpften ist die Verträglichkeit von PCV21 mit jener von PCV15 und PPSV23 vergleichbar. Die Antikörperantwort auf die gemeinsamen Serotypen war zwischen den Impfstoffen äquivalent, die Antwort auf die nur in PCV21 enthaltenen Serotypen war im Vergleich höher. Erste Resultate bei HIV-Patienten über 18 Jahre zeigen auch in dieser Patientengruppe eine gute Verträglichkeit und ein gutes Impfansprechen. Ein interessanter Aspekt ist, dass der Erfolg der Erwachsenenimpfung auch davon abhängt, welcher Pneumokokken-Impfstoff im Kinderimpfprogramm verwendet wird und wie hoch die Pneumokokken-Durchimpfungsraten in der Bevölkerung sind.
Zulassung im März 2025
Ende März 2025 erfolgte die Zulassung von PCV21 (CAPVAXIVE) in der EU und der Impfstoff wird voraussichtlich in den kommenden Wochen in Österreich verfügbar sein.
Die Weiterentwicklung der Pneumokokken-Impfstoffe mit der Auswahl weiterer Serotypen bzw. das Ziel, einen universellen, nicht Serotypen-spezifischen Proteinimpfstoff zu entwickeln, wird in Zukunft spannende Ergebnisse bringen.
Pentavalente Meningokokken-Impfstoffe
Die Kombination eines bereits zugelassenen Impfstoffs gegen Meningokokken ACWY (Nimenrix) und des bivalenten B-Impfstoffes (Trumenba) sollte das Impfschema für all jene, die den Schutz gegen diese 5 Serogruppen benötigen, vereinfachen. Der Impfstoff hat im November 2024 die Zulassung für Personen ab 10 Jahren in der EU erhalten, diese wurde jedoch auf Wunsch des Zulassungsinhabers im Februar 2025 wieder zurückgezogen. Ob die Zulassung in der EU erneut beantragt wird, ist derzeit offen, weshalb hier auf diesen Impfstoff nicht weiter eingegangen wird. Der Impfstoff ist aber weiterhin, z.B. in den USA, erhältlich.
Ein weiterer pentavalenter Meningokokken-Impfstoff (PENMENVY; eine Kombination von Bexsero und Menveo) hat im Februar 2025 die Zulassung in den USA für 10- bis 25-Jährige erhalten (bislang wurde noch keine Einreichung bei der EMA durchgeführt). Der Nachweis von Sicherheit und Immunogenität erfolgte anhand von Antikörpermessungen im Vergleich zu den separat verfügbaren Impfstoffen bei mehr als 3700 Proband:innen.
Chikungunya-Impfstoffe
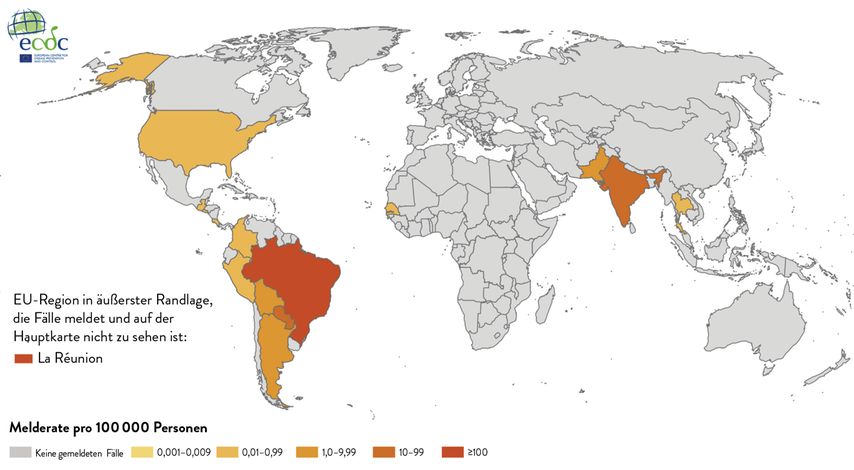
Die Entwicklung von Chikungunya-Impfstoffen wurde im Zusammenhang mit großen Ausbrüchen in der Pazifik/Karibik/Mittel- und Südamerika-Region zwischen 2013 und 2015 vorangetrieben. Das Chikungunyavirus gehört zur Familie der Alphaviren und obwohl bis zu vier genetische Linien (westafrikanische, ost-süd-zentralafrikanische [ESCA], asiatische Linie und Indischer Ozean) beschrieben wurden, gibt es nur einen Serotyp. Die Endemiegebiete liegen in tropischen und subtropischen Regionen Afrikas, Amerikas und Asiens (Abb. 1), wobei auch in der gemäßigten Klimazone vereinzelt Ausbrüche auftreten können. Die Übertragung erfolgt überwiegend über Stechmücken der Gattung Aedes aegypti (Gelbfiebermücke) und albopictus (Asiatische Tigermücke), aber auch vertikal (höchstes Risiko peripartal).
Abb. 1: Dreimonatsrate der gemeldeten Chikungunya-Virusfälle pro 100000 Einwohner von Dezember 2024 bis Jänner 2025 (modifiziert nach: European Centre for Disease Prevention and Control)
Bei Infektion treten nach einer kurzen Inkubationszeit von drei bis fünf Tagen bei zwei Drittel der Infizierten akute Symptome mit plötzlich einsetzendem Fieber und einem makulopapulösen Exanthem gefolgt von symmetrisch auftretenden Arthralgien (v.a. distal) auf. Atypische, schwere Verläufe wurden vor allem bei neurologischen Manifestationen und Patienten mit Komorbiditäten beschrieben.
Die Therapie der akuten Erkrankung erfolgt symptomatisch mit Analgetika (bevorzugt NSAR). Während der akuten Infektion liegt die Hospitalisierungsrate zwischen 1 und 13% und die Mortalität weit unter 1% (~0,07%). Nach durchgemachter Infektion besteht lebenslange Immunität. Jedoch ist ein beträchtlicher Anteil der Erkrankten von länger andauernden Arthritiden und Arthralgien über die postakute Phase (drei Wochen bis drei Monate) hinaus betroffen. Mehr als die Hälfte der Patienten ist nach einem Jahr beschwerdefrei, bis zu 25% haben allerdings über ein Jahr lang Beschwerden – ähnlich einer rheumatoiden Arthritis. Therapeutisch werden im chronischen Stadium auch DMARDs („disease modifying antirheumatic drugs“) sowie Biologika eingesetzt. Aufgrund der hohen Krankheitslast ist die Möglichkeit der Prävention mittels Impfung interessant.
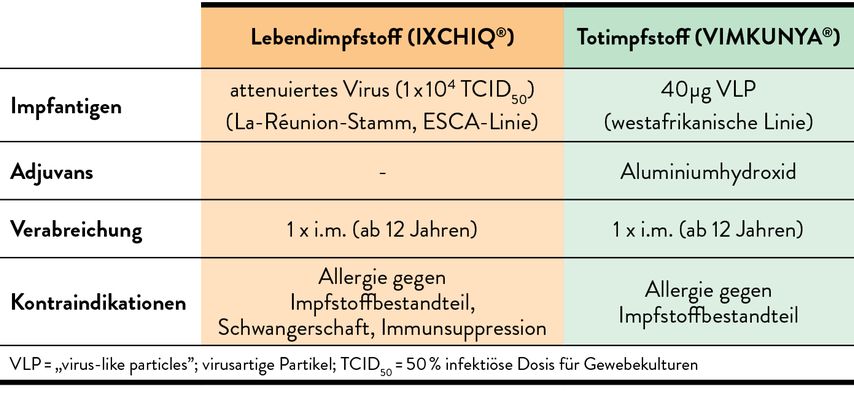
Derzeit haben zwei Impfstoffe eine EU-Zulassung (Tab. 1): ein attenuierter Lebendimpfstoff (IXCHIQ; ab 12 Jahren) und ein Totimpfstoff (VIMKUNYA; ab 12 Jahren). Beide Impfstoffe werden einmal intramuskulär verabreicht. Die Zulassungsdaten aus randomisierten, placebokontrollierten Studien beruhen nicht auf Wirksamkeitsdaten, sondern auf funktionellen (neutralisierenden) Antikörpertitern, die als Surrogatwert für Wirksamkeit herangezogen wurden. Nachdem die beiden Hersteller unterschiedliche Tests und Grenzwerte verwendet haben, sind die Ergebnisse nicht direkt vergleichbar. Zur gleichzeitigen Verwendung mit anderen Impfstoffen liegen derzeit noch keine Daten vor (Stand Februar 2025).
Lebendimpfstoff
Der Lebendimpfstoff erreicht nach einmaliger Verabreichung hohe Seroprotektionsraten (% an Impflingen mit Antikörperspiegeln über dem festgelegten Surrogat-Grenzwert) von 99% einen Monat nach der Impfung und 97% zwei Jahre nach der Impfung (laut Pressemitteilung des Herstellers 96% nach 3 Jahren). Diese gute Immunogenität wurde sowohl in der jüngeren (12 bis 64 Jahre) als auch in der älteren Altersgruppe (≥65 Jahre) gezeigt (gesamt etwa 4500 Personen).
Als häufigste Reaktionen wurden lokaler Druckschmerz an der Impfstelle (10%) und systemisch Kopfschmerz (32%), Müdigkeit (29%), Myalgie (24%), Arthralgie (17%) und Fieber (14%) angegeben. Vor allem das Auftreten von einer Chikungunya-ähnlicher Symptomatik (Fieber ≥38°C + 1 weiteres Symptom) wurde genau analysiert, diese Symptome wurden von 12% der Impflinge angegeben, davon wurden 1,8% als schwer eingestuft und in 0,4% war die Dauer über 30 Tage. In den Tagen nach der Impfung kommt es zu einer Virämie und zudem treten häufig transient veränderte Laborparameter (Neutropenie, Leukopenie, Lymphopenie sowie erhöhte Leberwerte) auf. Kontraindikationen sind neben einer Allergie gegen Impfstoffbestandteile, bedingt durch das Lebendvirus, Immunsuppression und Schwangerschaft.
Totimpfstoff
Der Totimpfstoff besteht aus drei rekombinant hergestellten Chikungunya-Strukturproteinen, die sich zu einer Virus-ähnlichen Struktur („virus-like particles“; VLP) zusammenfügen, aber aufgrund fehlender RNA im Impfling nicht repliziert werden können. Es liegen Daten von insgesamt 3500 Impflingen vor. Die Seroprotektionsrate betrug in der jüngeren Altersgruppe (18 bis 45 Jahre) drei Wochen nach Impfung 97% und 86% in der älteren Gruppe (≥65 Jahre) sowie 84% bzw. 74% nach sechs Monaten. In der jüngeren Alterskohorte lag die Seroprotektionsrate nach zwei Jahren bei 100%. Die häufigsten Reaktionen waren Schmerzen an der Impfstelle (24%), Fatigue (20%), Kopfschmerz (18%), Muskelschmerzen (18%) – Arthralgien traten mit ca. 7% gleich häufig wie in der Placebogruppe auf. Bei Personen über 65 Jahre wurden Reaktionen deutlich seltener beobachtet. Die Kontraindikation für den Totimpfstoff ist eine Allergie gegen einen Impfstoffbestandteil.
Die Impfstoffe wirken gegen alle beschriebenen genetischen Linien des Virus. Für beide Impfstoffe gilt, dass derzeit keine Daten über die Wirksamkeit und die Dauer des „Impfschutzes“ vorliegen. Somit steht noch nicht fest, ob und wann Auffrischungsimpfungen nötig sein werden.
Impfempfehlungen
Die derzeitige Impfempfehlung (Impfplan Österreich 2024/25, Version 1.1) ist sehr breit formuliert und sieht die Empfehlung „zur Impfung für Reisende in Endemiegebiete ab dem vollendeten 18. Lebensjahr, bei entsprechendem epidemiologischem Risiko (=Ausbruchszenario), außerdem für exponiertes Laborpersonal“ vor. Es ist zu erwarten, dass demnächst eine Präzisierung der Impfindikation bzw. eine Quellenangabe zur Definition der Risikogebiete im österreichischen Impfplan erfolgt. Laut dem US-amerikanischen Advisory Committee on Immunization Practices (ACIP) wird die Impfung ab 18 Jahren für alle Reisenden in ein Gebiet mit aktivem Ausbruch empfohlen. Bei Reisen in Endemiegebiete ohne aktuellen Ausbruch, in denen aber Übertragungen innerhalb der letzten fünf Jahre stattgefunden haben, wird laut ACIP eine Impfindikation nur für ältere Personen (≥65 Jahre) – besonders solche mit Grunderkrankungen – oder für Erwachsene bei längeren Aufenthalten (>6 Monate) gestellt.
UPDATE
Aufgrund schwerer Nebenwirkungen bei Personen über 65 Jahren soll bei dieser Personengruppe der Lebendimpfstoff derzeit nicht verabreicht werden. Eine entsprechende Anpassung im Impfplan dazu finden Sie unter „Impfempfehlung Chikungunya“ hier:
https://www.sozialministerium.gv.at/Themen/Gesundheit/Impfen/Impfplan-%C3%96sterreich.html
Literatur:
bei der Verfasserin
Das könnte Sie auch interessieren:
ALLGEMEINE+ auf universimed.com
Ab sofort finden Sie alle Inhalte von ALLGEMEINE+ auf unserem Portal universimed.com! Sie müssen nichts weiter tun - die Log-in-Daten bleiben dieselben.
Basispauschalierung
Zur Basispauschalierung bei selbstständiger Tätigkeit könnte es bereits für das Jahr 2025 Änderungen geben, die fallweise eine Steueroptimierung möglich machen.
Einsatz von KI-Tools in der Ordination
Die Integration künstlicher Intelligenz (KI) in den medizinischen Alltag verspricht Effizienzsteigerungen, präzisere Diagnosen und entlastende Automatisierung. Doch bevor man KI-basierte ...