Asthma-Update
Bericht:
Mag. Andrea Fallent
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In der Asthmatherapie ist ein grundlegender Wandel zu beobachten: weg von der Symptombekämpfung hin zur Symptomprävention. Bei schwerem Asthma stehen Biologika mit unterschiedlichen Targets als Add-on-Therapie zur Verfügung. Ein bedeutender Aspekt sind die „treatable traits“, der Einsatz von systemischen, aber auch hoch dosierten inhalativen Glukokortikoiden wird zunehmend kritisch hinterfragt.
Prim. Ao. Univ.-Prof. Dr. Judith Löffler-Ragg, Landeskrankenhaus Hochzirl – Natters, präsentierte in ihrem Vortrag beim 12. Pneumo Aktuell neue Erkenntnisse zu den obstruktiven Atemwegserkrankungen Asthma und COPD. Aufgrund der erheblichen Heterogenität der beiden Erkrankungen und ihrer unspezifischen Symptome wie Atembeschwerden, Husten und Auswurf ist die Differenzierung im klinischen Alltag nicht immer einfach. Innovative Konzepte, die sich an aktuellen Studiendaten orientieren, ermöglichen jedoch eine zunehmend präzisere Diagnosestellung und Therapieanpassung. Bei Asthma und COPD sollten die Patient:innen umfassend phänotypisiert werden und bei unklarer Differenzierung sollte das Konzept der „treatable traits“ angewendet werden. Konkret gemeint sind jene Parameter in Hinblick auf klinische Phänotypen, Biomarker und Ätiologie, die klinisch relevant sind, objektiv gemessen werden können und nicht zuletzt auch beeinflussbar sind. Wie bedeutend die Einbeziehung von Komorbiditäten und Nebenwirkungen bei der Therapiewahl ist, zeigt die von Löffler-Ragg vorgestellte Kasuistik eines Patienten mit schwerem Asthma.
Ein Patientenfall: eosinophiles Asthma und Nasenpolypen
Ein 62-jähriger Mediziner stellte sich in der Klinik mit Late-onset-Asthma vor. Seine aktuelle Medikation bestand aus einer inhalativen Triple-Therapie (Kortikosteroid/lang wirksamer Muskarinantagonist/Beta-2-Sympathomimetikum; ICS/LAMA/LABA) mit adäquater Adhärenz und Inhalationstechnik und dem oralen Kortikosteroid (OCS) Dexamethason in der Dosierung von 1mg jeden 2. Tag. Der Patient fragte nach einer „Asthma-Spritze“, weil ihn die blauen Flecken auf der Haut als bekannte Nebenwirkung der langjährigen OCS-Therapie und seine ständig rinnende Nase bei Nasenpolypen störten. Die wichtigsten aktuellen Befunde lauteten:
-
Bluteosinophile (BEC) unter OCS-Therapie 456 Zellen/μl
-
IgE 25,1U/ml
-
ANCA-negativ
-
FeNO 27ppb
-
FEV1 68% vom Soll
-
FEV1/FVC < LLN
-
Bronchodilatator-Test nicht signifikant
-
Thorax-CT: keine eosinophilen Infiltrate
-
chronische Rhinosinusitis mit Nasenpolypen (CRSwNP)
-
Diabetes mellitus Typ 2 (Therapie: SGLT2-Hemmer)
-
NSAR-Intoleranz
Es liegen ein schwer behandelbares Asthma und klinisch eine Samter-Trias vor; die Reversibilität konnte im Bronchodilatator-Test akut zwar nicht bewiesen werden, die Biomarker waren allerdings erhöht (Bluteosinophile, FeNO) und der Patient zeigte laut Anamnese ein klinisches Ansprechen auf inhalative und orale Steroide, mit deutlicher Verschlechterung der Asthmasymptome bei Reduktion der OCS. In früheren Befunden war die Bluteosinophilie sogar bei 30% der Gesamtzellzahl gelegen. Daher wurde differenzialdiagnostisch eine eosinophile Granulomatose mit Polyangiitis (EGPA) abgeklärt, „wobei Patienten mit schwerem Late-onset-Asthma oft hohe Typ-2-Entzündungsmarker aufweisen“, so Löffler-Ragg. Bezüglich der Asthmaeinstufung des Patienten erklärte sie: „Wir positionierten diesen Patienten unter inhalativer Triple-Therapie mit mittel bis hoch dosiertem inhalativem Kortikosteroid wegen der Dauertherapie mit oralem Steroid und nach Ausschluss von modifizierbaren Triggern und Komorbiditäten schon in der Stufe 5 im GINA-Stufenschema,1 d.h. bei schwerem Asthma.“ Dazu aktuelle Zahlen aus Österreich: Laut der LEAD-Studie leiden 4,6% der Bevölkerung unter Asthma, darunter sind 5% von schwerem Asthma betroffen.2
Löffler-Ragg wies im Zusammenhang mit dem Patientenfall darauf hin, dass es wichtig ist, die Asthmatherapie bei Erwachsenen immer mit ICS in Fixkombination mit dem schnell und lang wirksamen Beta-2-Sympathomimetikum (FABA bzw. LABA) Formoterol zu beginnen, da Registerdaten zeigen, dass die Asthmaerstmedikation häufig noch aus dem kurz wirksamen Beta-2-Sympathomimetikum (SABA) Salbutamol alleine besteht – was aufgrund fehlender Entzündungskontrolle nicht empfohlen wird.
Tab. 1: Hinweise auf Vorliegen einer Typ-2-Entzündung (modifiziert nach S2k-Leitlinie Asthma 2023 und * GINA Report 2024)1,3
Patient:innen mit Asthma, die keine Typ-2-Inflammation aufweisen (fragliche Existenz eines „Type-2 low“-Asthma: FeNO <25ppb und BEC <150 Eosinophile/μl; Tab.1)1, sollten laut GINA3zur genauen Eingrenzung des Phänotyps mindestens dreimal auf Typ-2-Biomarker getestet werden, da die Biomarker starken individuellen Schwankungen ausgesetzt sind. Bei Nachweis niedriger Typ-2-Marker sollte laut S2k-Asthma-Leitlinie geprüft werden, ob möglicherweise eine andere Diagnose vorliegt, welche ein Asthma imitiert, ob eine chronische Infektion das Entzündungsgeschehen überlagert und ob die Typ-2-Marker durch die Glukokortikoidtherapie iatrogen supprimiert sind.1
Auswahl des Biologikums
Der vorgestellte Patient wies als Therapieoption auf die „6-Monate-Spritze“ hin – gemeint ist Depemokimab, ein ultralang wirkendes Folgepräparat von Mepolizumab. Der Interleukin(IL)-5-Hemmer wurde in Phase-III-Studien als Begleittherapie zu mittel bis hoch dosiertem ICS (Standardtherapie) bei schwerem eosinophilem Asthma mit Steroid-pflichtigen Exazerbationen im Vorjahr versus Placebo und Standardtherapie untersucht und damit wurde eine Reduktion der Exazerbationen erreicht.4 Im Jänner 2025 akzeptierte die Europäische Arzneimittelagentur (EMA) den Zulassungsantrag für Depemokimab für die Indikationen Typ-2-Asthma und CRSwNP. Abgesehen davon, dass Depemokimab in Österreich noch nicht erhältlich ist, schätzt Löffler-Ragg das Präparat auch nicht als geeignetes „Einsteiger-Biologikum“ bei schwerem Asthma ein.
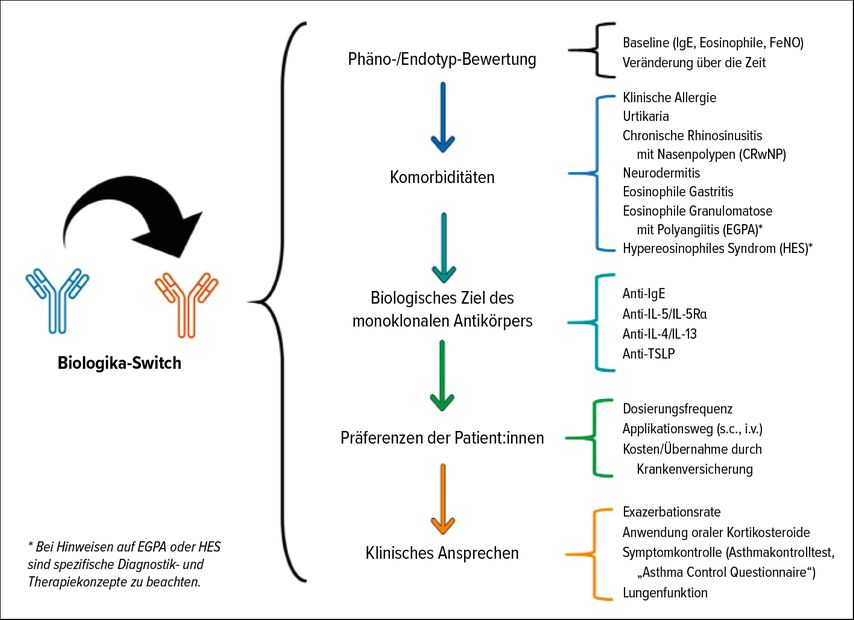
Bei diesem Patienten bot sich hinsichtlich der beträchtlichen Eosinophilie der Anti-Interleukin(IL)-5-Rezeptor-Antikörper Benralizumab an, der sich nebst Mepolizumab bei eosinophilem Phänotyp in der Praxis bewährt hat. Wider Erwarten bewirkte die Therapie aber keine Besserung der chronischen Rhinosinusitis. Daher wurde der Patient nach erneuter Analyse der Biomarkerprofile und der bestimmenden Komorbidität CRSwNP auf Dupilumab umgestellt, das sich gegen den gemeinsamen Rezeptor für IL-4 und IL-13 richtet – zwei Schlüsselmediatoren der Typ-2-Inflammation. Unter Monitoring bzgl. einer peripheren Hypereosinophilie sprach der Patient sofort auf die Behandlung an: Binnen zwei Tagen hörte das Rinnen der Nase auf. Wichtige Parameter für einen geplanten Switch auf ein anderes Biologikum bei schwerem Asthma listet die Abbildung 1 auf.
Abb. 1: Parameter für einen geplanten Biologika-Switch bei schwerem Asthma (modifiziert nach Dragonieri S et al. 2024)11
Nebenniereninsuffizienz nach Absetzen des OCS
Bei der Kontrolle einige Wochen später waren die CRSwNP und das Asthma zwar gut kontrolliert, nach dem Absetzen von Dexamethason wurde aber eine Nebenniereninsuffizienz diagnostiziert, die sich mit Schwäche und starker Übelkeit gezeigt hatte. Diese relativ häufige unerwünschte Auswirkung einer systemischen Cortisontherapie wurde nun mit Hydrocortone behandelt. „Das ist für mich eine Gelegenheit, Ihnen diese nicht unbedeutende Problematik bei der Reduktion von Kortikosteroiddosen in Erinnerung zu rufen. In der OCS-Reduktionsstudie PONENTE5 mit Benralizumab hatten bis zu 20% der Patienten, d.h. jeder Fünfte, am Ende der Reduktionsphase eine gemessene Nebenniereninsuffizienz“, erklärte Löffler-Ragg.
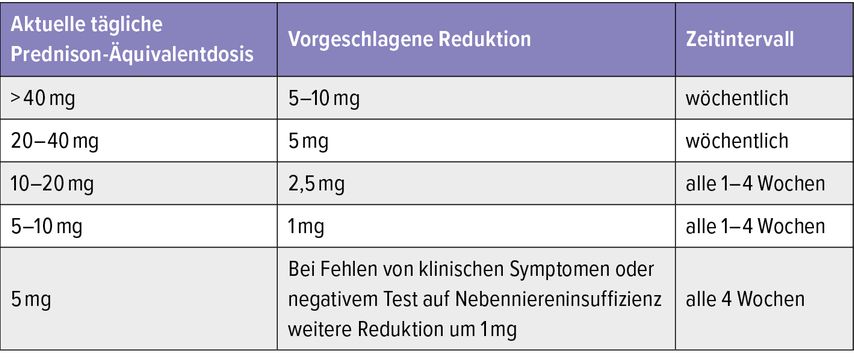
Tab. 2: Schema zur Reduktion von oralen Glukokortikoiden abhängig von der Dosis (modifiziert nach Beuschlein F et al.)6
2024 wurde von der Europäischen Endokrinologischen Gesellschaft eine Empfehlung zur OCS-Reduktion publiziert (Tab.2).6 Darin wird z.B. angeraten, bei einer täglichen Dosis von 5mg OCS die Reduktion in 1-mg-Schritten alle 4 Wochen durchzuführen. In den Empfehlungen wird auch auf die Nebenwirkungen von inhalativen Kortikosteroiden hingewiesen: Unter Patient:innen mit Höchstdosis gibt es langfristig immerhin einen Anteil von 20%, die eine Nebenniereninsuffizienz entwickeln, gefährdet sind v.a. Menschen mit einem niedrigen BMI bzw. Personen unter Ritonavir-Therapie. „Beachten Sie auch, dass es nicht mehr Zielsetzung ist, ICS unter Biologikatherapie hoch dosiert einzusetzen. Viele Patient:innen sagen auch, dass sie das Gefühl haben, die inhalative Therapie dann gar nicht mehr zu brauchen – was aber auch keine Zielsetzung ist“, so Löffler-Ragg. Diesbezüglich erwähnte sie die Daten der SHAMAL-Studie, in der die Reduktion der inhalativen Basistherapie unter Biologikatherapie analysiert wurde. Löffler-Ragg: „Als Orientierung daraus kann man ablesen, dass man bei guter Asthmakontrolle inhalative Kortikosteroide zumindest bis auf die halbe Dosis mit einem weiterhin guten klinischen Benefit reduzieren kann.“ Kontrollen der Biomarker wie des FeNO-Werts könnten dazu beitragen, jene Patient:innen zu detektieren, bei denen das Risiko für eine Verschlechterung der Lungenfunktion erhöht ist.7 Löffler-Ragg: „Für mich zeigt dieses Fallbeispiel eindrücklich die Risiken bei Langzeit-Cortisongabe auf, die unter anderem zu Gewichtszunahme, Fettleber, Adipositas, Osteoporose und Glukoseintoleranz führt. Interessanterweise unterscheidet sich der Einfluss auf systemische Inflammation und das Entstehen einer Cortisonresistenz abhängig von der Dauer der Cortisongabe (Abb.2).“8
Abb. 2: Gegensätzliche Wirkungen der akuten und chronischen Glukokortikoid-Exposition (modifiziert nach Martinez GJ et al. 2024)8
Das erfreuliche Fazit bei diesem Patienten nach 6 Monaten Biologikatherapie: Freiheit von Asthmasymptomen, Rückgang der Nasenpolypen, Gewichtsabnahme von 11 Kilogramm und kein Diabetes mehr, bei einem HbA1c-Wert von 5,6%.
Fokus auf Symptomprävention und Remission
In der Asthmatherapie ist wie bei der Therapie der COPD ein grundlegender Wandel zu beobachten: weg von der Symptombekämpfung hin zur Symptomprävention, so Löffler-Ragg: „Wir wollen systemische Steroide vermeiden, wir wollen zielgerichtet therapieren und wir wollen, dass der Patient in die Praxis kommt und sagt: ‚Ich führe ein Leben ohne Einschränkungen im Alltag und ohne Nebenwirkungen‘.“
Als angepeiltes Ziel der Therapie etabliert sich zunehmend das Konzept der Asthmaremission: In diesem Sinn haben Prof. Dr. Marek Lommatzsch und Univ.-Prof. Dr. Johann Christian Virchow, beide Universitätsmedizin Rostock, im Jänner 2025 in ihrem Artikel im Lancet ihre Forderung nach einer standardisierten Definition der Asthmaremission untermauert. Kurz zusammengefasst umfasst diese drei Hauptkriterien: sehr milde oder keine Symptome, keine Exazerbationen, keine Verwendung von systemischen Kortikosteroiden – wobei noch weitere Faktoren wie Lungenfunktion, Biomarker und bronchiale Hyperreagibilität berücksichtigt werden sollten.9 Löffler-Ragg: „Diese Zielsetzungen unter Therapie könnten künftig den Krankheitsverlauf günstig beeinflussen, allerdings tritt mit den bisherigen Biologikakonzepten keine Heilung der Erkrankung ein.“
Daten zu Benralizumab bei akuten Exazerbationen
Das Einsatzgebiet von Biologika bleibt ein spannender Schwerpunkt klinischer Forschung: Beim ERS Congress 2024 in Wien berichtete Prof. Dr. Mona Bafadhel, King’s Centre for Lung Health, London, über die einmalige Biologikaapplikation bei akuten Asthma- und COPD-Exazerbationen. Dazu stellt sie die Ergebnisse der Studie ABRA („Acute exacerbations treated with BenRAlizumab“) vor, in der die Intervention mit Benralizumab analysiert wurde.10 In diese Phase-II-Studie wurden Patient:innen aus Notfallambulanzen sowohl mit Asthma- als auch COPD-Exazerbationen und mit Bluteosinophilen über 300 Zellen/μl eingeschlossen und in drei Behandlungsarme aufgeteilt. Der Standardarm erhielt 30mg Prednisolon p.o. über 5 Tage + Placebo s.c. (PRED), der zweite Arm Prednisolon + Benralizumab 1x100 mg s.c. (BENRA plus PRED) und der dritte Arm Placebo p.o. + Benralizumab 1x100mg s.c. (BENRA). Als primäre Endpunkte waren die Rate von Therapieversagen innerhalb von 90 Tagen und eine Symptomverbesserung nach 28 Tagen festgelegt. Die Studienergebnisse zeigten ein Therapieversagen in der PRED-Gruppe von 74%, in der BENRA-Gruppe von 47% und in der BENRA+PRED-Gruppe von 42%. Das Resümee der Studienautor:innen:Benralizumab zeigte bei guter Verträglichkeit eine überlegene Wirksamkeit gegenüber Prednisolon bei eosinophilen Exazerbationen und bietet demnach eine biologisch fundierte Alternative zu einer Intervention mit systemischen Glukokortikoiden, was in weiteren Studien mit klarer Patientenselektion zu reproduzieren ist.10
Quelle:
„State of the Art COPD & Asthma“, Vortrag von Prim. Ao. Univ.-Prof. Dr. Judith Löffler-Ragg, Natters, im Rahmen des 12. Pneumo Aktuell am 25. Jänner 2025 in Wien
Literatur:
1 Lommatzsch M et al.: S2k-Leitlinie zur fachärztlichen Diagnostik von Asthma 2023. https://register.awmf.org/assets/guidelines/020-009l_S2k_Fachaerztliche-Diagnostik-Therapie-von-Asthma_2023-03.pdf ; zuletzt aufgerufen am 11.3.2025 2 Breyer-Kohansal B et al.: Asthma prevalence and phenotyping in the general population: the LEAD (Lung, hEart, sociAl, boDy) Study. J Asthma and Allergy 2023; 16: 367-82 3 Global Initiative for Asthma: GINA Main Report 2024. https://ginasthma.org/2024-report/ ; zuletzt aufgerufen am 11.3.2025 4 Jackson DJ et al.: Twice-yearly depemokimab in severe asthma with an eosinophilic phenotype. N Engl J Med 2024; 391: 2337-49 5 Menzies-Gow A et al.: Adrenal function recovery after durable oral corticosteroid sparing with benralizumab in the PONENTE study. Eur Respir J 2022; 60(6): 2103226 6 Beuschlein F et al.: European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: Diagnosis and therapy of glucocorticoid-induced adrenal insufficiency. J Clin Endocrinol Metab 2024; 109(7): 1657-83 7 Jackson DJ et al.: Reduction of daily maintenance inhaled corticosteroids in patients with severe eosinophilic asthma treated with benralizumab (SHAMAL): a randomised, multicentre, open-label, phase 4 study. Lancet 2024; 403: 271-81 8 Martinez GJ et al.: Glucocorticoids, their uses, sexual dimorphisms, and diseases: new concepts, mechanisms, and discoveries. Physiol Rev 2024; 104: 473-532 9 Lommatzsch M, Virchow JC: Asthma remission: a call for a globally standardised definition. Lancet Respir Med 2025; 13(1): 2-3 10 Ramakrishnan S et al.: Treting eosinophilic exacerbations of asthma and COPD with benralizumab (ABRA): a double-blind, double-dummy, active placebo-controlled randomised trial. Lancet Respir Med 2025; 13(1): 59-68 11 Dragonieri S et al.: Advancing care in severe asthma: the art of switching biologics. Adv Respir Med 2024; 92(2): 110-122
Das könnte Sie auch interessieren:
Welche Allergene bringt der Frühling?
Der Frühling ist da und viele Pflanzen blühen bereits. Somit stellt diese Jahreszeit für Pollenallergiker:innen eine besondere Herausforderung dar. Ostern ist zwar schon vorbei, aber es ...
Die kindliche Lunge: Infektionen verhindern, Komplikationen vorbeugen
Infektionen der unteren Atemwege in der Kindheit stellen einen relevanten Risikofaktor für eine frühe Abnahme der Lungenfunktion im späteren Leben sowie für frühen Tod dar. Dieses Risiko ...