Polymyalgia rheumatica – Was suchen? Wie behandeln?
Autorin:
Dr. med. Stella Mollet
FMH Rheumatologie und Allgemeine Innere Medizin
RheumaClinic Bethanien, Zürich
E-Mail: rheumaclinic@hin.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Polymyalgia rheumatica (PMR) gehört zu den häufigsten autoimmunen/entzündlichen rheumatischen Erkrankungen im Alter von >50 Jahren mit einer Inzidenz von 111/100000 Personen.1,2 Nicht selten steckt allerdings eine andere Grunderkrankung hinter den polymyalgischen Beschwerden, sodass wir zunächst vom «polymyalgischen Syndrom» als Arbeitsdiagnose sprechen sollten, bevor wir die definitive Diagnose einer PMR stellen. Welche Differenzialdiagnosen sollten bei der Verdachtsdiagnose einer PMR gesucht werden? Welche Therapie sollte eingeleitet werden, wenn sich nach Ausschluss der Differenzialdiagnosen die Diagnose einer PMR bestätigt? Diese Fragen sollen im folgenden Artikel beantwortet werden.
KEYPOINTS
Was suchen bei Verdacht auf eine Polymyalgia rheumatica?
-
Kalziumpyrophosphaterkrankung (CPPD)
-
Rheumatoide Arthritis oder Zeichen für eine Psoriasisarthritis
-
Grossgefässvaskulitis (mindestens gezielte Anamnese und klinische Untersuchung)
-
Die Differenzialdiagnose ist breit. Suche nach anderer Diagnose bei unzureichendem Ansprechen auf Prednison.
Was suchen bei Verdacht auf eine Polymyalgia rheumatica?
Wie behandeln bei Diagnose einer Polymyalgia rheumatica?
Prednison primär mit <25mg/d beginnen
Evaluation Glukokortikoid-sparender Medikation bei Glukokortikoidnebenwirkungen, Komorbiditäten oder unzureichendem Ausschleichen von Prednison
Als Glukokortikoid-sparende Medikamente kommen in erster Linie Interleukin-6-Rezeptor-Antagonisten, alternativ Methotrexat oder Rituximab zum Einsatz.
Das klinische Bild der Polymyalgia rheumatica
Die Schlüsselmerkmale der PMR sind gekennzeichnet durch proximale Schmerzen im Schulter- und Beckengürtelbereich, typischerweise assoziiert mit einer Morgensteifigkeit von >45 Minuten und einer erhöhten humoralen Entzündungsaktivität mit erhöhtem CRP und/oder erhöhter BSR. Teilweise bestehen auch konstitutionelle Symptome wie Fieber, Nachtschweiss, Fatigue und seltener auch Gewichtsverlust.
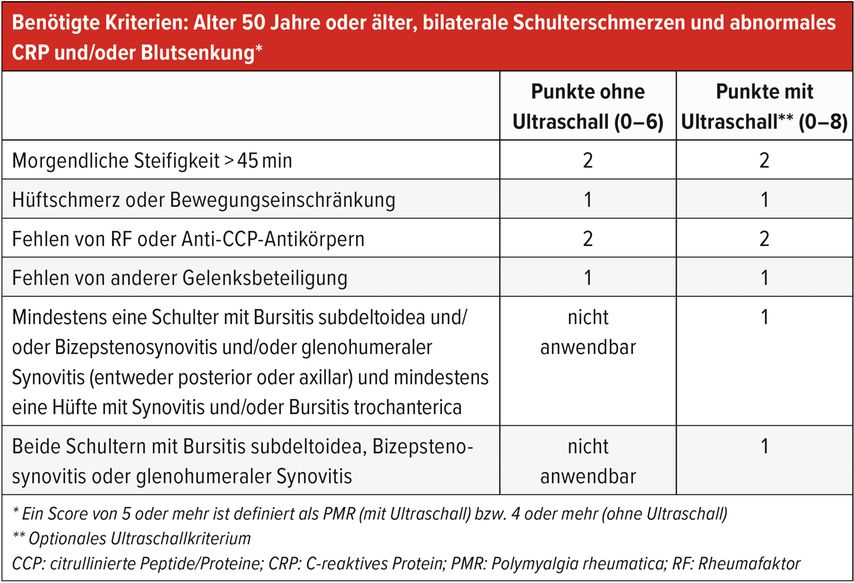
Die EULAR (European Alliance of Associations for Rheumatology) hat 2012 Klassifikationskriterien erstellt,3 welche diese Schlüsselmerkmale beinhalten (Tab.1). Nebst diesen Schlüsselmerkmalen werden auch Punkte für eine Negativität von Rheumafaktor und Anti-CCP-Antikörpern sowie für das Fehlen anderer Gelenkschmerzen vergeben. Zu beachten ist aber, dass es sich hierbei um Klassifikationskriterien handelt, die in der Regel für Studien zum Einschluss von Probanden verwendet werden. Es sind keine Diagnosekriterien, mit denen man im Sinne einer Checkliste bei Erfüllen der Kriterien die Diagnose stellen kann. Und so ist denn auch die Sensitivität mit 68% und Spezifität mit 78% eher niedrig. Mit Hinzunahme der Ultraschalldiagnostik von Schultern und Hüften können die Sensitivität mit 66% und die Spezifität mit 81% nur wenig beeinflusst werden. Typische Zeichen für eine PMR im Ultraschall sind eine in der Regel beidseitige Bursitis subdeltoidea, ein Erguss um die Bizepssehne bei glenohumeraler Synovitis sowie eine Bursitis trochanterica oder Synovitis femoroazetabulär am Hüftgelenk.
Tab. 1: EULAR/ACR-Klassifikationskriterien für die Polymyalgia rheumatica (adaptiert nach Dasgupta B et al. 2012)3
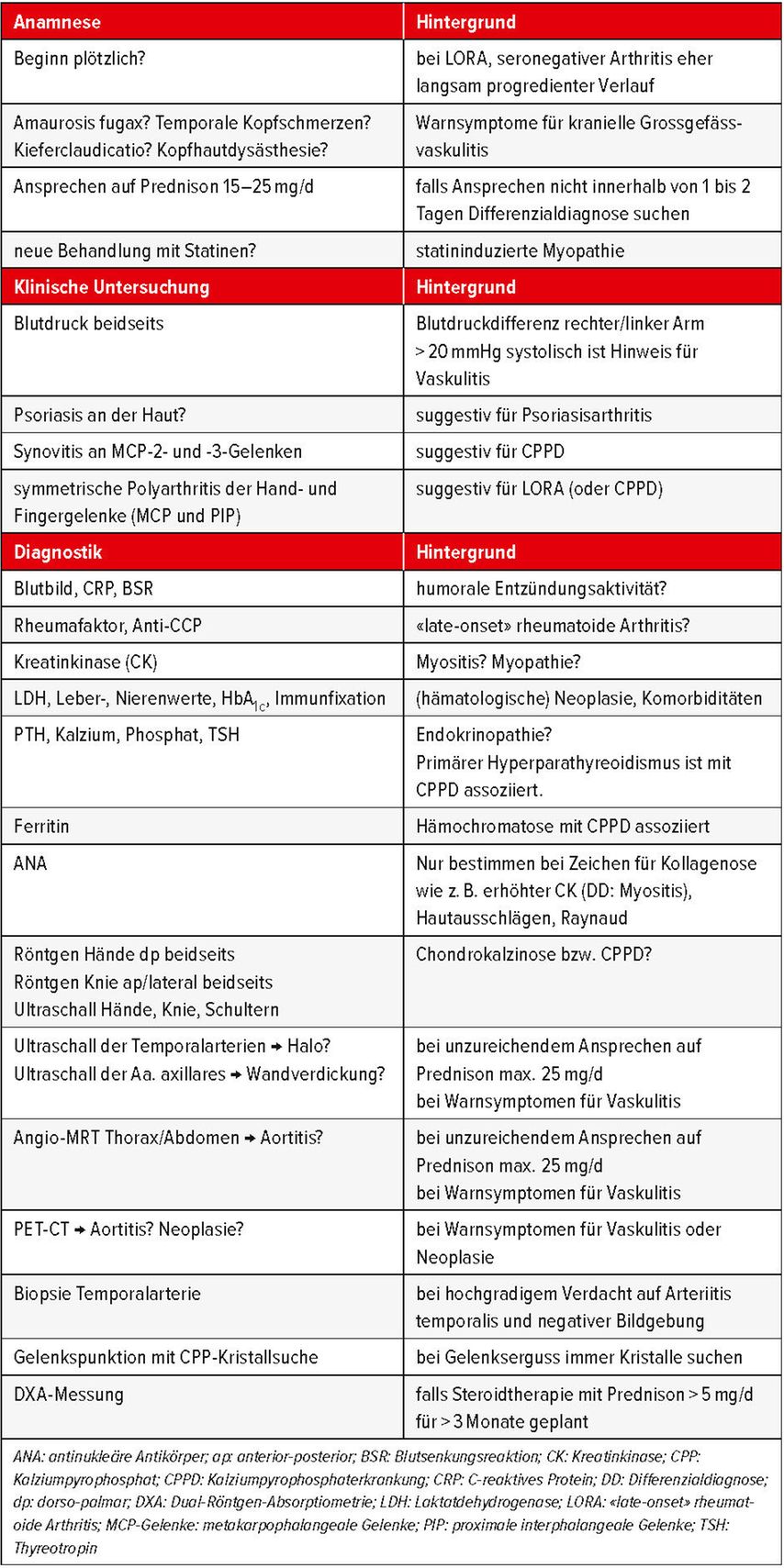
Schliesslich handelt es sich bei der PMR um eine Ausschlussdiagnose. Anhand der Arbeitsdiagnose «polymyalgisches Syndrom» sollten vor definitiver Diagnosestellung die wichtigsten Differenzialdiagnosen gesucht werden.
Die häufigsten Differenzialdiagnosen der PMR
Kalziumpyrophosphaterkrankung (CPPD)
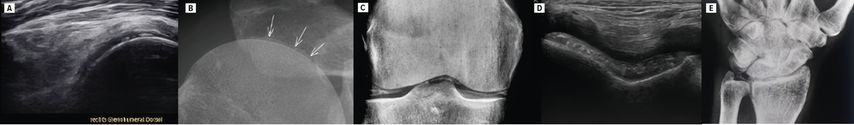
Bei einem polymyalgischen Syndrom sollte immer an eine Kalziumpyrophosphaterkrankung (CPPD) gedacht werden. So ist die Prävalenz der CPPD mit 5% noch höher als die der PMR mit 1%.4 Bei der CPPD (auch Pseudogicht genannt) kommt es zur Ablagerung von Kalziumpyrophosphat-Dihydrat in kristalliner Form in Knorpel, Gelenken, Ligamenten, Sehnen und Bursen. Diese Ablagerungen können in Form von Verkalkungen im konventionellen Röntgen und im Ultraschall der Gelenke festgestellt werden (Abb.1). Dieser röntgenologische Befund, der bei 15% der >60-Jährigen auch asymptomatisch gefunden werden kann, wird als Chondrokalzinose bezeichnet. Typischerweise finden sich Ablagerungen am Schultergelenk (am hyalinen Knorpel des Humeruskopfs und am Faserknorpel des Labrum glenoidale sowie des AC-Gelenksdiskus), am Hüftgelenk (am Faserknorpel des Labrum acetabuli), am Kniegelenk (am hyalinen Knorpel von Femur und Tibia, am Faserknorpel der Menisken) sowie an den Handgelenken am Faserknorpel des Discus triangularis («triangular fibrocartilage complex», TFCC). Auch eine dominante STT-Arthrose bei vergleichsweise geringer Rizarthrose, Osteophyten an den MCP(metakarpophalangealen)-2- und -3-Gelenken der Finger sind typische Zeichen im Röntgen und Ultraschall. In selteneren Fällen kann auch die Halswirbelsäule betroffen sein mit Verkalkungen am Ligamentum transversum atlantis um den Dens axis, was zum Bild eines sogenannten «crowned dens syndrome» mit akuten Nackenschmerzen führen kann. In 20% der Fälle finden sich im Röntgen keine Verkalkungen im Sinne einer Chondrokalzinose. Sensitiver ist die Suche nach Kalziumpyrophosphat-Kristallen in der Synovialflüssigkeit, sodass im Falle eines Gelenksergusses, wann immer möglich, eine diagnostische Gelenkspunktion erfolgen sollte.
Abb. 1: Röntgen und Ultraschallbilder von Patienten mit Kalziumpyrophosphaterkrankung als wichtigste Differenzialdiagnose der Polymyalgia rheumatica. Verkalkungen im hyalinen Knorpel des Humeruskopfs in Ultraschall (A) und Röntgen (B); Verkalkungen im hyalinen Knorpel des Femurs sowie im Faserknorpel des Meniskus im Röntgen (C) und im hyalinen Knorpel des Femurs im Ultraschall (D); Verkalkungen im Discus triangularis («triangular fibrocartilage complex», TFCC) im Röntgen (E)
«Late-onset» rheumatoide Arthritis (LORA)
Auch eine rheumatoide Arthritis, welche bei Auftreten im höheren Alter als «late-onset» rheumatoide Arthritis (LORA) bezeichnet wird, sollte gezielt gesucht werden. Hinweisend hierfür sind eine symmetrische Polyarthritis, die in der Regel im Verlauf auch die Hand- und Fingergelenke, vor allem die MCP- und die proximalen interphalangealen (PIP) Gelenke betrifft. Teilweise sind auch die metatarsophalangealen (MTP) Gelenke der Zehen betroffen. Serologisch können zum Teil positive Rheumafaktoren und Anti-CCP-Antikörper nachgewiesen werden. Der Nachweis hochtitrig positiver Anti-CCP-Antikörper sowie der Nachweis marginaler Erosionen im Röntgen an Händen und Füssen ist sehr spezifisch für das Vorliegen einer rheumatoiden Arthritis und spricht dann klar gegen eine PMR.
Periphere Spondyloarthritis/Psoriasisarthritis
Weniger häufig, aber nicht minder wichtig ist eine periphere Spondyloarthritis, im Besonderen eine Psoriasisarthritis, welche sich ebenfalls erst mit >50 Jahren erstmalig manifestieren kann. Hierfür sollten Patienten nach bekannter Psoriasis in der Eigen- und Familienanamnese befragt werden. Bei genauer klinischer Untersuchung können mitunter versteckte Psoriasisherde an Rima ani, Bauchnabel, Gehörgang oder der Kopfhaut gefunden werden.
Grossgefässvaskulitis
Die Polymyalgia rheumatica ist in 20% der Fälle assoziiert mit einer Grossgefässvaskulitis (Riesenzellarteriitis),2 sodass Warnsymptome einer Grossgefässvaskulitis immer anamnestisch erfragt werden sollten. Diese umfassen kranielle Symptome wie temporale Kopfschmerzen, Sehstörungen (z.B. kurzzeitiger Visusverlust), Kauclaudicatio oder Kopfhautdysästhesie. Hinweise auf eine extrakranielle Grossgefässvaskulitis sind eine Blutdruckdifferenz der Arme (>20mmHg systolisch) und/oder ein unzureichendes Ansprechen auf Prednison 15–25mg/d.
Bei kraniellen Symptomen sollte unverzüglich ein Ultraschall der Aa. temporales und axillares veranlasst werden mit Suche nach Gefässwandverdickung mit sogenanntem Halozeichen. Auch ein Schädel-MRI kann zur Suche nach einer Vaskulitis mit kranieller Beteiligung durchgeführt werden. Hierzu sollte aber ein gezieltes sogenanntes «vessel wall imaging» erfolgen, welches die Methode des sogenannten Black-Blood-MRT nutzt, um die Gefässwände sichtbar zu machen. Eine Grossgefässvaskulitis der Aorta und der aortalen Abgänge sollte bei Verdacht zeitnah (innerhalb von 3 Tagen nach Therapiebeginn mit Prednison) mittels thorakoabdominaler PET-CT oder MR-Angiografie gesucht werden. Welche Bildgebung zum Einsatz kommt, sollte von der am schnellsten möglichen Verfügbarkeit abhängig gemacht werden. Die Diagnostik sollte den Therapiebeginn nicht verzögern.
Weitere Differenzialdiagnosen
Weitere häufige Differenzialdiagnosen der PMR sind das zerviko- und lumbospondylogene Syndrom und die Fibromyalgie.5 Diese manifestieren sich allerdings typischerweise mit mechanisch anmutenden Beschwerden, welche durch belastungsinduzierte Beschwerden ganztägig oder abendlich betont ohne akzentuierte Morgensteifigkeit gekennzeichnet sind. Auch eine symptomatische Arthrose oder eine mechanisch bedingte Bursitis subdeltoidea der Schultern kann in der Regel anamnestisch und klinisch durch den belastungsabhängigen Schmerz differenziert werden.
Autoimmunbedingte oder statininduzierte Myopathien hingegen präsentieren sich klinisch sehr ähnlich wie eine PMR und müssen laboranalytisch mittels Bestimmung der Kreatinkinase abgegrenzt werden. Auch infektassoziierte Myalgien oder Paraneoplasien, insbesondere Lymphome, können das Bild einer PMR immitieren. Bei therapierefraktären Fällen sollten diese gesucht werden.
Bei PMR kommt es typischerweise zu einem raschen Ansprechen auf Prednison in einer Dosis von <25mg/d innerhalb von ein bis zwei Tagen. Bleibt dieses Ansprechen aus, sollte nach anderen Diagnosen, insbesondere Grossgefässvaskulitis, Neoplasien oder Infekten gesucht werden. Eine Temporalarterienbiopsie kann bei hohem Verdacht auf kranielle Grossgefässvaskulitis, aber negativer Bildgebung sinnvoll sein. Die wichtigsten Differenzialdiagnosen samt Checkliste zur Suche danach sind in Tabelle 2 zusammengefasst.
Behandlung der PMR
Glukokortikoide/Prednison
Die europäischen und amerikanischen rheumatologischen Fachgesellschaften (EULAR – European Alliance of Associations for Rheumatology und ACR – American College of Rheumatology) haben 2015 Richtlinien für die Behandlung der PMR erstellt.6
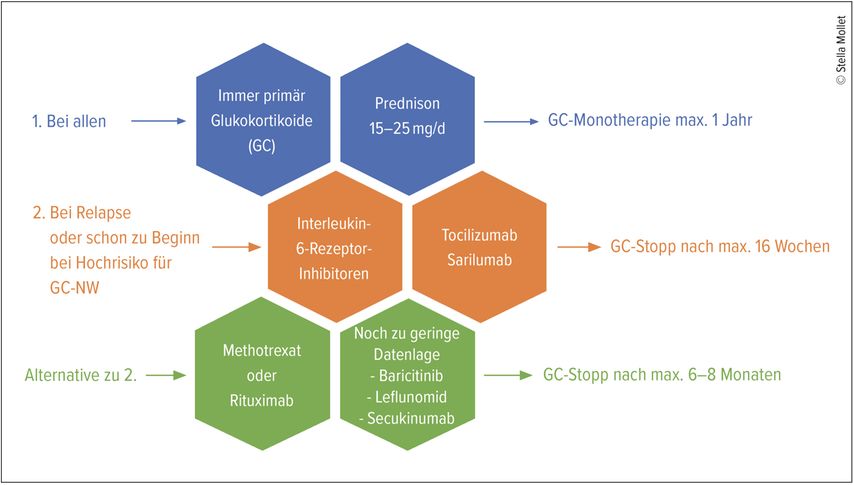
Mittel der 1. Wahl ist weiterhin eine primäre Behandlung mittels Glukokortikoiden wie Prednison. Um das Vorliegen einer allenfalls assoziierten Grossgefässvaskulitis nicht zu maskieren, sollte die initiale Dosis von Prednison nicht über 15–25mg/d liegen. Ein sofortiges Ansprechen auf Prednison, in der Regel innerhalb von ein bis zwei Tagen, ist typisch für eine PMR und untermauert die klinische Diagnose. Bei raschem Ansprechen kann nach Normalisierung der humoralen Entzündungsaktivität eine Reduktion des Prednisons auf 10mg/d innerhalb von 4 bis 8 Wochen erfolgen. Bei Remission (keine Symptome, Entzündungswerte normal) sollte die Dosis von 10mg/d alle 4 Wochen um jeweils 1,25mg reduziert werden (5-mg-Tabletten vierteln).
Bei einem Rückfall empfiehlt sich eine Erhöhung der Dosis zurück auf die vorherige Dosis, bei welcher die Symptome noch kontrolliert waren. Sollte eine Prednison-Monotherapie erfolgen, soll diese maximal 1 Jahr durchgeführt werden.
Glukokortikoid-assoziierte Nebenwirkungen sind häufig. Bei 65% der Behandelten tritt mindestens eine solche Nebenwirkung auf. Es wird daher empfohlen, während der Therapie ein Monitoring der häufigsten Nebenwirkungen zu veranlassen und nach Komorbiditäten zu suchen, bei welchen eine Glukokortikoid-Dauertherapie zu vermeiden ist. Hierzu gehören die Evaluation von Diabetes mellitus und Gewichtszunahme, kardiovaskulären Begleiterkrankungen, Osteoporose, Infekten, Katarakt, Glaukom, Steroidmyopathie, Hautfragilität, Schlafstörungen oder Steroidpsychose.
Erfreulicherweise haben sich in den letzten Jahren in Studien zunehmend Alternativen zum Prednison im Sinne einer Glukokortikoid-sparenden Medikation als erfolgreich erwiesen. So haben die Deutsche, die Österreichische und die Schweizerische Gesellschaft für Rheumatologie (DGRh, ÖGR, SGR) 2024 ein Update zur Therapie der PMR im Rahmen von S2-Leitlinien publiziert.7
Glukokortikoid-sparende Medikamente
Der Einsatz Glukokortikoid-sparender Medikamente wird empfohlen, wenn Komorbiditäten (z.B. Osteoporose, Diabetes, stattgehabte kardiovaskuläre Ereignisse) vorliegen, eine Reduktion von Prednison <5mg/d nicht möglich ist, wenn zusätzlich eine periphere Arthritis besteht oder wenn im Verlauf Gluokortikoid-assoziierte Nebenwirkungen auftreten. Da bei Frauen und bei hoher BSR >40mm/h häufig ein Rezidiv auftritt, soll auch hier frühzeitig der Einsatz Glukokortikoid-sparender Medikamente in Betracht gezogen werden (Abb.2).
Die bedeutsamste Änderung der Leitlinien von 2024 ist die Empfehlung, bei Rezidiv oder hohem Risiko für Glukokortikoid-induzierte Nebenwirkungen eine Biologikatherapie mit einem Interleukin(IL)-6-Rezeptor-Antagonisten zu beginnen. Aufgrund neuer Studien mit hoher Evidenzqualität rücken diese Medikamente sogar vor den Einsatz von Methotrexat.
Die IL-6-Inhibitoren Tocilizumab und Sarilumab konnten in randomisiert kontrollierten Studien eine Überlegenheit gegenüber Placebo für das Erreichen einer Glukokortikoid-freien Remission und in Bezug auf die kumulative Glukokortikoiddosis zeigen. Aufgrund der Studienlage wird ein Stopp der Glukokortikoide unter Einsatz von IL-6-Rezeptor-Inhibitoren bereits nach 16 Wochen empfohlen.
Sarilumab ist sowohl in den USA (von der FDA) wie auch in der EU (von der EMA) für die PMR zugelassen. In der Schweiz gilt der Einsatz noch immer als «off-label», auf eine zeitnahe Zulassung darf aber gehofft werden.
Als Alternative zu den IL-6-Rezeptor-Antagonisten stehen Methotrexat (MTX) oder auch Rituximab zur Verfügung.
Im Vergleich zu den bisherigen Leitlinien wurde MTX damit neu positioniert und steht nicht mehr an erster Stelle der Glukokortikoid-sparenden Medikamente. Dies, weil sich der Effekt von MTX als nur moderat erwiesen hat, während er bei den IL-6-Inhibitoren konsistent und beachtlich ist. MTX kann subkutan (Zieldosis 10–20mg/Woche) oder peroral (in Studien in der Regel 10mg 1x/Woche) verabreicht werden. Dies ist vor allem sinnvoll bei Kontraindikationen für IL-6-Inhibitoren wie stattgehabten Divertikulitiden oder bei Nadelphobie.
Für Rituximab gibt es eine randomisierte Studie, die bei PMR einen signifikanten Unterschied bezüglich Erreichen einer niedrigen Krankheitsaktivität im Vergleich zu Placebo zeigte, nachdem einmalig 1000mg Rituximab infundiert wurden. Allerdings waren in dieser Studie die Anzahl an Probanden niedrig und die Studiendauer kurz, weshalb der Evidenzgrad und die Empfehlung im Vergleich zu den IL-6-Inhibitoren niedriger ausfallen.
Sollten Methotrexat oder Rituximab zum Einsatz kommen, wird empfohlen, die Glukokortikoide innerhalb von 6 bis 8 Monaten auszuschleichen.
Der JAK-Inhibitor Baricitinib zeigte in einer randomisierten, placebokontrollierten Studie mit einer peroralen Dosis von 4mg/d eine niedrigere Glukokortikoiddosis zum Erreichen einer niedrigen Krankheitsaktivität, sodass eine Empfehlung auch für dieses Medikament in Zukunft zu erwarten sein dürfte. Auch hierfür fehlt aber bislang die Zulassung.
Die Tatsache, dass der JAK-Inhibitor Upadacitinib in der Schweiz neu für die Therapie bei Riesenzellarteriitis zugelassen wurde, gibt Hoffnung, dass auch bald ein Einsatz von JAK-Inhibitoren bei alleiniger PMR möglich ist.
Eine unzureichende Datenlage besteht für Leflunomid oder den IL-17-Hemmer Secukinumab. Hier bleibt das Ergebnis grösserer Studien abzuwarten.
Um die Evaluation Glukokortikoid-sparender Medikamente nicht zu verzögern, wird empfohlen, zumindest einmalig eine Mitbeurteilung durch eine Rheumatologin bzw. einen Rheumatologen zu gewährleisten.
Klinische Kontrollen sollten bis zum Erreichen der Remission alle 1–4 Wochen und bei stabiler Remission alle 3–6 Monate erfolgen.
Nichtmedikamentöse Therapie
Nicht zu vergessen sind die nichtmedikamentösen Therapiemassnahmen, die bei allen Patientinnen und Patienten mit PMR zum Einsatz kommen sollten. Krafttraining, gegebenenfalls mit physiotherapeutischer Unterstützung, dient dem Erhalt der Muskelmasse, der Sturzprophylaxe und damit auch einer Prävention osteoporotischer Frakturen.
Literatur:
1 Schmidt WA et al.: Frequency, diagnosis, and management of polymyalgia rheumatica in Germany-database analysis of medical insurance data. Rheumatology 2025; keaf367 2 Dejaco C et al.: Diagnostik und Therapie der Polymyalgia rheumatica. Z Rheumatol 2016; 75: 687-700 3 Dasgupta B et al.: 2012 classification criteria for polymyalgia rheumatica: a European League Against Rheumatism/American College of Rheumatology collaborative initiative. Ann Rheum Dis 2012; 71: 484-92 4 Hameed M et al.: Prevalence and incidence of non-gout crystal arthropathy in southern Sweden. Arthritis Res Ther 2019; 21: 29 5 Salvarani C et al.: Polymyalgia rheumatica and giant-cell arteritis. Lancet 2008; 372: 234-45 6 Dejaco C et al.: 2015 Recommendations for the management of polymyalgia rheumatica. Ann Rheum Dis 2015; 74: 1799-807 7 Buttgereit F et al.: [S2e guidelines on the treatment of polymyalgia rheumatica: update 2024 : Evidence-based guidelines of the German Society for Rheumatology and Clinical Immunology (DGRh), the Austrian Society for Rheumatology and Rehabilitation (ÖGR) and the Swiss Society for Rheumatology (SGR) and the participating medical scientific specialist societies and other organizations]. Z Rheumatol 2025; 84: 494-505
Das könnte Sie auch interessieren:
Frühprävention des Hirnschlags
Schlaganfälle zählen weltweit zu den häufigsten Ursachen für Tod und dauerhafte Behinderung. Trotz einer durch Fortschritte in der Prävention rückläufigen altersadjustierten Inzidenz ...
Biomarker, Ethik und Translation in die Praxis
Die Alzheimererkrankung beginnt Jahrzehnte, bevor erste Gedächtnisprobleme sichtbar werden. In dieser langen stillen Phase werden im Gehirn Prozesse angestossen, die später zu ...
Kognitive und soziale Folgen eines Schlaganfalls
Jährlich erleiden in der Schweiz rund 249 von 100000 Menschen einen Schlaganfall, dessen Folgen weit über die akute medizinische Versorgung hinausreichen. Neben motorischen ...