MPN: therapeutische Neubewertungen
Autorin:
Prim. Priv.-Doz. Dr. Sonja Heibl
Vorstand
Abteilung für Innere Medizin IV
Hämatologie, internistische Onkologie und Palliativmedizin, Nephrologie und Dialyse
Klinikum Wels-Grieskirchen GmbH
Eine Einrichtung der Kreuzschwestern und Franziskanerinnen
E-Mail: sonja.heibl@klinikum-wegr.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Beim ASH-Jahrestreffen 2023 hat es zu den BCR-ABL-negativen myeloproliferativen Neoplasien (MPN) sehr viele interessante Beiträge zu aktuellen Studiendaten gegeben, die unsere Behandlungsmöglichkeiten in naher Zukunft deutlich erweitern werden. Mit den neuen Substanzklassen zeichnen sich in der Therapie der Myelofibrose große Fortschritte ab, die uns dem Ziel der Krankheitsmodifikation voraussichtlich näherbringen werden.
Keypoints
-
Eine Analyse an jungen ET-und PV-Patient:innen zeigt zwar keinen Einfluss einer zytoreduktiven Therapie auf das thrombosefreie Überleben, weist aber auf einen signifikanten Effekt von Interferon auf das myelofibrosefreie Überleben hin.
-
Myelofibrose: Kombinationstherapien von neuen Substanzen mit JAK-Inhibitoren weisen ein signifikant besseres Milzansprechen auf und sind vielversprechend in Hinblick auf eine Krankheitsmodifikation.
-
Essenzielle Thrombozythämie: Bomedemstat zeigt bei auf die Ersttherapie resistenten oder intoleranten Patient:innen nicht nur ein hämatologisches, sondern auch ein molekulares Ansprechen.
Polycythaemia vera und essenzielle Thrombozythämie
Rusfertide
Die Daten der REVIVE-Studie sind bemekenswert: Rusfertide – ein Hepcidin-Mimetikum, das die Produktion der Erythrozyten bei Patient:innen mit Polycythaemia vera (PV) durch die limitierte Verfügbarkeit von Eisen kontrolliert – erreichte bei Patient:innen mit einem bestimmten Phlebotomiebedarf zusätzlich zur laufenden Standardtherapie (zytoreduktive Therapie oder nicht) eine lang anhaltende Kontrolle des Hämatokrits ohne Phlebotomie.
37 Patient:innen wurden mehr als zwei Jahre lang in der Studie behandelt. Die Verträglichkeit der Substanz war sehr gut, die meisten Nebenwirkungen waren Grad 1 oder 2. Die Anprechrate betrug 69,2% im Rusfertide-Arm und 18,5% im Placebo-Arm (p=0,0003). Es haben sich außerdem die Ferritinspiegel normalisiert und es gibt Hinweise, dass sich Symptome wie Fatigue, frühes Sättigungsgefühl, Nachtschweiß, Konzentrationsprobleme, Inaktivität und Juckreiz verbessern.1
Diese Substanz scheint insbesondere für PV-Patient:innen mit höherem Phlebotomiebedarf von großer Bedeutung zu sein, da in diesem Setting der Eisenmangel oft zu Problemen führt.
Ruxolitinib
Ein Nutzen von Ruxolitinib wurde bei der Polycythaemia vera in der zweiten Therapielinie nach Versagen von Hydroxyurea gezeigt. Die Substanz ist in dieser Indikation auch zugelassen und wird häufig eingesetzt. In der ersten Linie ist Ruxolitinib bislang nicht verfügbar. Der Einsatz von Ruxolitinib in der Erstlinientherapie wurde nun in der RuxoBEAT-Studie von der deutschen Studiengruppe für myeloproliferative Neoplasien (MPN) untersucht. Es wurde angenommen, dass Ruxolitinib in früherer Linie effektiver in der Kontrolle der Erkrankung sowie der Symptome im Vergleich zu BAT („best available therapy“ – vorwiegend Hydroxyurea) ist. In die Studie wurden sowohl Patient:innen mit PV als auch mit essenzieller Thrombozythämie eingeschlossen. Aktuell wurden die Daten der Patient:innen mit PV präsentiert.
Der primäre Endpunkt der Studie war negativ (komplettes Ansprechen [CR] nach sechs Monaten). Es konnte eine komplette Remission bei 2,3% der Patient:innen im Ruxolitinib-Arm vs. 2,9% der Patient:innen im BAT-Arm erreicht werden. Beim Gesamtansprechen (ORR) zeigt sich mit 77,3% vs. 58,8% aber ein Trend für die Überlegenheit von Ruxolitinib. Ebenfalls ein Trend für eine bessere Wirkung von Ruxolitinib gegenüber BAT zeigt sich in der Verbesserung von Pruritus und Fatigue.
Was das Milzansprechen angeht, war dieses in der Ruxolitinib-Gruppe signifikant besser.2 In der Diskussion wurden die Ergebnisse als überraschend bezeichnet, wobei erwartet wird, dass sich mit längerem Follow-up auch noch eine Änderung der CR-Raten ergeben kann.
Bomedemstat
Erfreulicherweise hat es beim ASH-Jahrestreffen 2023 auch wieder einmal eine Studie mit einer ET-Kohorte gegeben. Der oral verfügbare LSD1-Inhibitor Bomedemstat wurde bei Patient:innen mit essenzieller Thrombozythämie eingesetzt, die resistent oder intolerant gegen zumindest eine Standardtherapie waren. Bomedemstat reduziert im Mausmodell nicht nur Thrombozyten, sondern auch inflammatorische Zytokine und mutierte Zellen.3
Der primäre Endpunkt war die Reduktion der Thrombozyten auf <400G/l bei gleichzeitigem Fehlen von thromboembolischen Komplikationen. Bei 77% der Patient:innen konnte dieser Endpunkt erreicht werden. 20% der Patient:innen hatten zu Beginn einen Leukozytenwert von über 10G/l, bei allen konnte ein Absinken auf unter 10G/l nach 24 Wochen nachgewiesen werden. Die Tatsache, dass Patient:innen mit einer Leukozytose eingeschlossen wurden, spricht dafür, dass es sich nicht um eine reine ET-Kohorte handelt.
Es konnte mit der Substanz auch ein molekulares Ansprechen erzielt werden – insbesondere für Patient:innen mit homozygoten Treibermutationen (JAK2, CALR, MPL). Einschränkend ist zu bemerken, dass keine wesentliche Symptomkontrolle erreicht werden konnte.3
Insgesamt handelt es sich hier um sehr spannende Ergebnisse. Es läuft ein umfassendes translationales Programm, sodass noch viele interessante Ergebnisse zu erwarten sind. Eine Phase-III-Studie mit der Substanz wird aufgesetzt.
Zytoreduktive Therapie
In derselben Sitzung wurde noch eine sehr interessante Auswertung zum Einfluss von zytoreduktiver Therapie auf das Outcome einer Kohorte von adoleszenten und jungen Erwachsenen mit ET oder PV präsentiert.
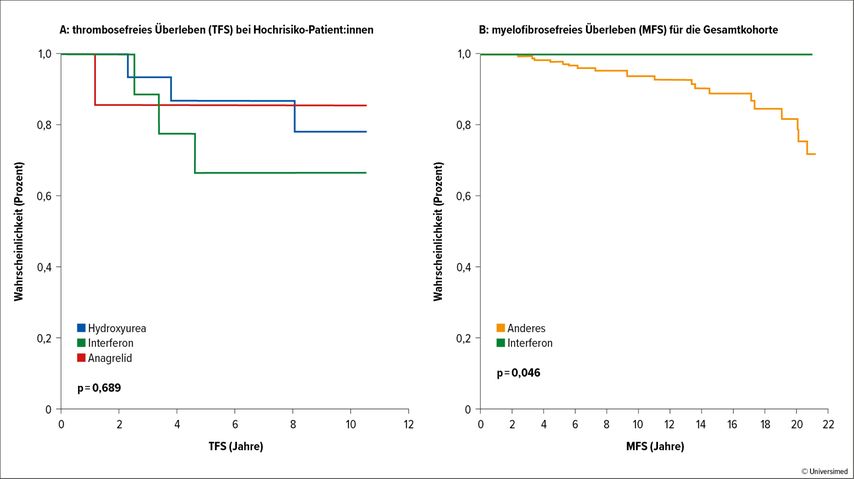
Es wurden 348 Patient:innen mit einem medianen Alter von 20 Jahren eingeschlossen. Es konnte gezeigt werden, dass bei Low-Risk-Patient:innen ein früher Einsatz einer zytoreduktiven Therapie keinen Einfluss auf das thrombosefreie Überleben hat. Auch die Wahl des zytoreduktiven Medikaments hat keine Auswirkung. Außerdem wurde ermittelt, dass eine Therapie mit Interferon (IFN), insbesondere im Vergleich mit anderen zytoreduktiven Substanzen, zu einem signifikant längeren MFS (myelofibrosefreies Überleben) führt.4
Diese Beobachtung unterstützt den Einsatz von IFN als krankheitsmodifizierende Substanz mit Verlängerung des Langzeit-MFS. Sie regt auch zu einer Neubewertung bzgl. der früheren Behandlung von Patient:innen mit ET und PV mit IFN in Hinblick auf eine Verlängerung des MFS an.
Abb. 1: Thrombosefreies Überleben (TFS) bei Hochrisiko-Patient:innen nach European-LeukemiaNET-Klassifikation (A) und myelofibrosefreies Überleben (MFS) für die Gesamtkohorte (B). (modifiziert nach Beauverd Y et al.)4
Myelofibrose
Durch die sehr gute Wirkung von JAK-Inhibitoren auf Symptome tritt nun durch die Kombination mit anderen Angriffspunkten als JAK1/2 das Ziel der Krankheitsmodifikation weiter in den Vordergrund. Es wurde im Dezember 2023 in San Diego eine Reihe von Studien präsentiert, unter denen zwei Phase-III-Studien hervorgehoben werden sollten.
Ruxolitinib+Navitoclax oder Placebo
Die Studie TRANSFORM-1 hat MF-Patient:innen mit Höherrisiko-Erkrankung (DIPSS-plus-Score: „intermediate 2“ und „high risk“) eingeschlossen, die nicht mit einem JAK-Inhibitor vorbehandelt waren. Die Patient:innen erhielten Ruxolitinib in Kombination mit Navitoclax oder Placebo. Der primäre Endpunkt (Milzvolumenreduktion um zumindest 35% zur Woche 24) wurde mit 63,2% signifikant häufiger in der Kombinationsgruppe als mit 31,5% in der Ruxolitinib+Placebo-Gruppe erreicht. Der sekundäre Endpunkt Symptomkontrolle unterschied sich nicht signifikant zwischen beiden Gruppen.
Bemerkenswert ist die doch deutlich höhere Nebenwirkungsrate insbesondere hämatologischer Natur. Die Rate an Thrombopenien Grad ≥3 ist in der Ruxolitinib+Navitoclax-Gruppe dreimal so hoch, die Rate an Anämie Grad ≥3 1,3-mal und die Neutropenierate von Grad ≥3 10-mal so hoch.5
Pelabresib+Ruxolitinib oder Placebo
Die Kombination des BET-Inhibitors Pelabresib mit Ruxolitinib oder Placebo wurde in der Studie MANIFEST-2 bei nicht vorbehandelten Patient:innen untersucht. Es zeigte sich ein signifikant besseres Milzansprechen (Milzvolumenreduktion um zumindest 35% zur Woche 24) mit sehr ähnlichen Daten wie in der zuvor besprochenen Studie (65,9% vs. 35,2%).
Auch hier konnte keine signifikante Symptomverbesserung durch die Kombination erzielt werden, aber es war zumindest ein Trend dahingehend festzustellen. Pelabresib zeigte einen Effekt auf proinflammatorische Zytokine, ein Anämieansprechen sowie eine Abnahme der Knochenmarksfibrose.6
Insgesamt zeigen die Kombinationen eine doch signifikant bessere Wirksamkeit das Milzansprechen betreffend, sodass hier noch weitere Auswertungen insbesondere des Fibroseverlaufs im Knochenmark sowie ein längeres Follow-up mit Überlebensdaten spannend wären.
Literatur:
1 Ritchie EK et al.: Durability of hematocrit control in polycythemia vera with the first-in-class hepcidin mimetic Rusfertidee: two-year follow up results from the REVIVE study. ASH 2023; Abstr. #745 2 Koschmieder S et al.: Firstline treatment with ruxolitinib versus best available therapy in patients with polycythemia vera: pre-specified interim analysis of the randomized phase 2b ruxobeat clinical trial of the german study group for myeloproliferative neoplasms (GSG-MPN). ASH 2023; Abstr. #619 3 Goethert JR et al.: Bomedemstat (IMG-7289), an LSD1 inhibitor, manages the signs and symptoms of essential thrombocythemia (ET) while reducing the burden of cells homozygous for driver mutations. ASH 2023; Abstr. #747 4 Beauverd Y et al.: Impact of cytoreductive drugs upon outcomes in a contemporary cohort of adolescent and young adults with essential thrombocythemia and polycythemia vera. ASH 2023; Abstr. #748 5 Pemmaraju N et al.: Transform-1: a randomized, double-blind, placebo-controlled, multicenter, international phase 3 study of navitoclax in combination with ruxolitinib versus ruxolitinib plus placebo in patients with untreated myelofibrosis. ASH 2023; Abstr. #620 6 Rampal RK et al.: Pelabresib in combination with ruxolitinib for janus kinase inhibitor treatment-naïve patients with myelofibrosis: results of the MANIFEST-2 randomized, double-blind, phase 3 study. ASH 2023; Abstr. #628
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...