Aktuelle Empfehlungen zur Systemtherapie des Melanoms
Autorin:
OÄ Dr. Sonja Hiemer
Krukenberg-Krebszentrum Halle (KKH)
Universitätsmedizin Halle
Universitätsklinikum Halle (Saale)
E-Mail: sonja.hiemer@uk-halle.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
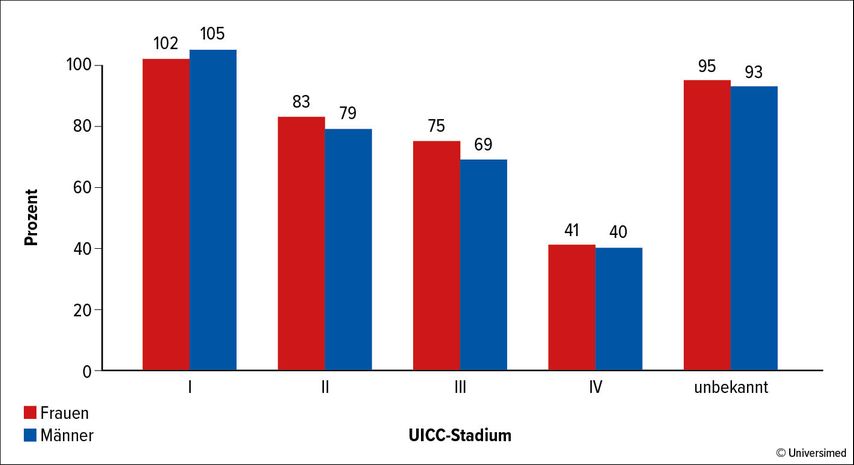
Die Systemtherapie beim Melanom hat in den letzten zehn Jahren erhebliche Fortschritte verzeichnet. Ab einem UICC-Stadium II kann durch eine adjuvante Systemtherapie das Rezidivrisiko gesenkt werden. Im inkurablen Stadium IV (palliative Situation) konnte der Einsatz neuer Wirkstoffe nicht nur das ereignisfreie Überleben, sondern vor allem auch das Gesamtüberleben verlängern. Während im UICC-Stadium I die 5-Jahres-Überlebensrate bei 100% liegt, beträgt sie im UICC-Stadium IV nur noch 40%, was die Dringlichkeit der Suche nach neuen Behandlungsoptionen unterstreicht (Abb. 1).1
Keypoints
-
Melanompatient:innen profitieren ab einem UICC-Stadium IIB signifikant mit einem verlängerten Gesamtüberleben von einer adjuvanten Immunmonotherapie mit einem PD-1-Ak.
-
Der perioperative Therapieansatz konnte das rezidivfreie Überleben für Patient:innen in Stadium III und IV deutlich verlängern und sollte insbesondere für Patient:innen erwogen werden, denen eine kosmetisch entstellende Resektion (z.B. im Gesicht) droht.
-
Eine Dreifachkombination aus PD-1-Ak und BRAF/MEK-Inhibitor ist aktuell keine Standardoption und kann für ausgewählte Patient:innen mit schlechter Prognose erwogen werden.
-
In Deutschland erfolgte bisher trotz signifikant verlängertem PFS und Zulassung sowohl durch die FDA als auch die EMA keine Markteinführung der fixen Kombination aus Nivolumab und Relatlimab durch den Hersteller.
Adjuvante Systemtherapie:UICC-Stadien II, III und operables Stadium IV
Der Goldstandard in der Behandlung des Melanoms in den Stadien I–IV ist die vollständige Resektion. Im Falle einer R1-bzw. R2-Situation muss die Möglichkeit einer Nachresektion geprüft werden.
Abb. 1: Relative 5-Jahres-Überlebensrate nach UICC-Stadium und Geschlecht. Modifiziert nach Robert- Koch-Institut
Systemtherapie im UICC-Stadium II
Das Rezidivrisiko von Patient:innen mit Melanom im Stadium II mit 1–2mm dicken oder ulzerierten Primärtumoren ist ähnlich hoch wie im UICC-Stadium III. Aufgrund der Ergebnisse der Studien KEYNOTE-716 und CheckMate 76K besteht die Empfehlung einer adjuvanten Immunmonotherapie mit Pembrolizumab2 oder Nivolumab3 für insgesamt zwölf Monate. Durch die Therapie mittels Checkpoint-Inhibitoren (CPI) konnten sowohl das rezidivfreie als auch das metastasenfreie Überleben signifikant verlängert werden.
Es ist davon auszugehen, dass die Ergebnisse einen Wechsel des Therapiestandards des Melanoms nach sich ziehen und die Empfehlung im Update der S3-Leitlinie berücksichtigt werden wird. Die aktuell laufende Phase-III-Studie COLUMBUS-AD untersucht die Wirksamkeit von BRAF/MEK-Inhibitoren bei Patient:innen mit nachgewiesener BRAF-V600-Mutation im Vergleich zu Placebo.
Systemtherapie im UICC-Stadium III und im operablen Stadium IV
Patient:innen ab einem UICC-Stadium IIIA soll eine adjuvante Monotherapie mit CPI oder bei Nachweis einer BRAF-V600-Mutation eine Therapie mit BRAF/MEK-Inhibitoren angeboten werden.4–7 Beide Therapiestrategien verlängerten deutlich nicht nur das rezidivfreie, sondern auch das Gesamtüberleben und sind für Patient:innen mit lokal fortgeschrittenem oder metastasiertem Melanom der Goldstandard.8
Zur Verbesserung der lokalen Tumorkontrolle wird bei Vorliegen von Risikofaktoren eine postoperative Radiatio empfohlen. Ob die adjuvante Radiatio bei Indikation zur adjuvanten Systemtherapie noch durchgeführt werden sollte oder nicht, führt in den interdisziplinären Tumorkonferenzen regelmäßig zu kontroversen Diskussionen und sollte in einer prospektiven Studie untersucht werden.
Neoadjuvanter oder perioperativerTherapieansatz
Die neoadjuvante Therapie mit CPI stellt einen vielversprechenden Ansatz dar. Patient:innen mit sehr gutem pathologischem Ansprechen (Vorhandensein von ≤10% lebensfähigen Tumorzellen) haben ein sehr geringes Rezidivrisiko.9
In der SWOG-S1801-Studie wurde ein perioperativer Ansatz geprüft. Hier erhielten die Patient:innen vor geplanter Resektion neoadjuvant drei Zyklen Pembrolizumab als Monotherapie. Nach erfolgter Resektion wurde die Systemtherapie adjuvant mit weiteren fünfzehn Zyklen fortgeführt. Im Vergleichsarm erhielten die Patient:innen adjuvant achtzehn Zyklen Pembrolizumab als Monotherapie. Das ereignisfreie Überleben (EFÜ) wurde durch den perioperativen Behandlungsansatz hochsignifikant verlängert (EFÜ: 72% vs. 49%; HR: 0,58; 95% CI: 0,39–0,87; p=0,004)und sollte entsprechenden Patient:innen angeboten werden.10
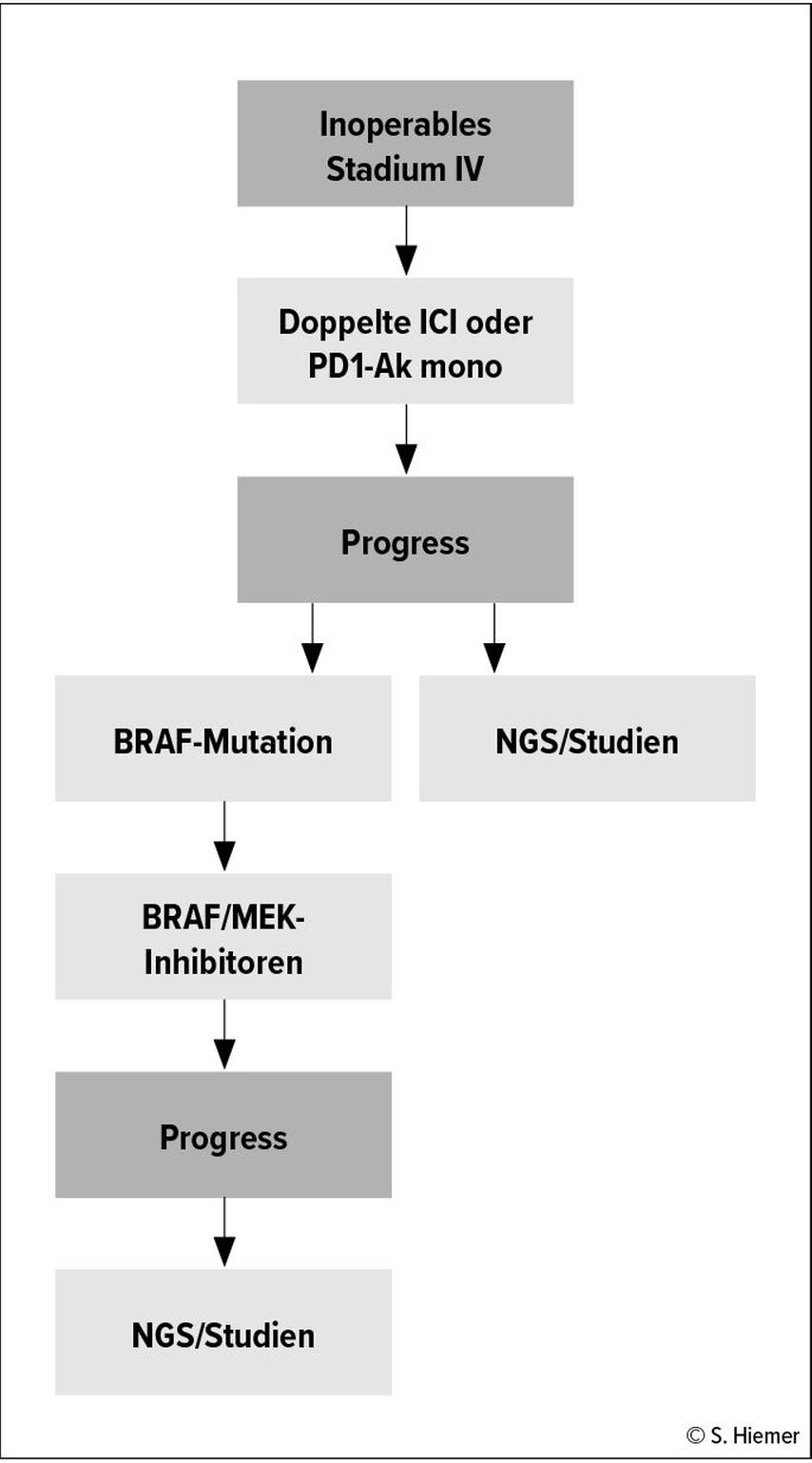
Inoperables UICC-Stadium IV – palliative Systemtherapie
Im inkurablen Stadium IV stehen CPI in Mono- oder als Kombinationstherapie zur Verfügung. Die Kombination aus PD-1-Antikörper (Ak) und CTLA4-Ak ist der Monotherapie überlegen und sollte daher bevorzugt verabreicht werden.11 Zusätzlich hat sich für Patient:innen mit nachgewiesener BRAF-V600-Mutation die Therapie mit BRAF/MEK-Inhibitoren etabliert. Beide Wirkstoffklassen verlängern deutlich das Gesamtüberleben im Vergleich zur klassischen zytostatischen Therapie mit Dacarbazin oder Interferon-alpha.12
Die Frage nach der optimalen Therapiesequenz für Patient:innen mit nachgewiesener BRAF-V600-Mutation konnte durch die DREAMseq-Studie geklärt werden. Patient:innen, die mit der kombinierten CPI in der Erstlinie behandelt wurden und im Falle eines Progresses auf eine Therapie mit BRAF/MEK-Inhibitoren wechselten, hatten ein signifikant längeres Gesamtüberleben.13 Aufgrund des deutlich schnelleren Therapieansprechens der zielgerichteten Therapie mit BRAF/MEK-Inhibitoren im Vergleich zu CPI kann bei bestehendem Remissionsdruck mit einer BRAF/MEK-Inhibition auch in der Erstlinie begonnen werden.
Für Patient:innen mit nachgewiesener c-KIT-Mutation in EXON 11 bzw. in EXON 13 besteht die Option einer zielgerichteten Therapie mit Imatinib.14,15 Falls überlegene Therapieschemata nicht infrage kommen, kann auch weiterhin eine Polychemotherapie angeboten werden. Die Kombination aus Carboplatin/Paclitaxel erreichte in einer Phase-III-Studie eine progressionsfreie Überlebenszeit von vier Monaten und wird daher bevorzugt eingesetzt.16
Larotrectinib ist ein Tyrosinkinasehemmer (TKI), der die drei TRK-Subtypen A, B und C hemmt. Die NTRK-Genfusion ist eine starke Treibermutation bei vielen Tumoren. Larotrectinib ist eine neue, wirksame Therapieoption für Tumorpatient:innen mit nachgewiesenen, erworbenen NTRK-Genfusionen in den Tumorzellen. Die in der Basket-Studie LOXO-TRK-15002 erreichte Remissionsrate nach zwölf Monaten lag bei 75%, die Rate des progressionsfreien Überlebens bei 55%.17 Die EU-Kommission hat 2019 für den NTRK-Inhibitor Larotrectinib erstmals eine vollständig tumoragnostische Zulassung ausgesprochen.
Tripeltherapie und neue Wirkstoffklassen
Anstatt die beiden vorhandenen Therapiestrategien sequenziell nacheinander einzusetzen, wurde in mehreren Studien die Kombination aus CPI und TKI untersucht (z.B. KEYNOTE-22, COMBI-i). Die IMspire150-Studie zeigte einen Vorteil beim progressionsfreien Überleben zugunsten der Dreifachkombination Vemurafenib, Cobimetinib und Atezolizumab, was zu einer Zulassung der Kombination aus CPI und BRAF/MEK-Inhibitor für BRAF-mutierte Melanome durch die FDA führte und damit ggf. für ausgewählte Patient:innen mit schlechter Prognose eine Option darstellt.18
Relatlimab ist ein humaner IgG4-Antikörper, der LAG-3 blockiert und die Effektorfunktion erschöpfter T-Zellen wiederherstellt. Im Rahmen der RELATIVITY-047-Studie wurde die Kombination aus Nivolumab und Relatlimab gegen eine Monotherapie mit Nivolumab getestet. Die Kombination zeigte im Vergleich zur Monotherapie einen signifikanten Vorteil hinsichtlich des PFS (10,1 vs. 4,6 Monate; HR: 0,78; 95% CI: 0,6–0,9; p=0,0055).19 Die von der EMA im September 2022 zugelassene fixe Kombination von Nivolumab und Relatlimab wurde seitens des Unternehmens nicht auf dem deutschen Markt eingeführt. Als Begründung wird die Befürchtung angegeben, keinen Zusatznutzen zuerkannt zu bekommen und in den Preisverhandlungen nicht den gewünschten Preis zu erzielen.20
Tebentafusp ist ein bispezifischer Antikörper, der hochselektiv zum einen spezifisch das Protein S100 auf Melanomzellen bindet und zum anderen über einen T-Zell-Rezeptor T-Zellen aktiviert. Tebentafusp verlängerte erstmals das Gesamtüberleben bei Patient:innen mit HLA-A2-positivem, metastasiertem Aderhautmelanom und wurde in dieser Indikation zugelassen. Inwieweit die Ergebnisse beim kutanen Melanom reproduzierbar sind, muss in prospektiven Studien untersucht werden.21
Literatur:
1 Robert-Koch-Institut: Krebs in Deutschland für 2019/2020. Zentrum für Krebsregisterdaten. Berlin 2023 2 Luke JJ et al.: KEYNOTE-716: Phase III study of adjuvant pembrolizumab versus placebo in resected high-risk stage II melanoma. Future Oncol 2020; 16(3): 4429-38 3 Kirkwood JM et al.: Adjuvant nivolumab in resected stage IIB/C melanoma: primary results from the randomized, phase 3 CheckMate 76K trial. Nat Med 2023; 29(11): 2835-43 4 Eggermont AMM et al.: Adjuvant pembrolizumab versus placebo in resected stage III melanoma. NEngl J Med 2018; 378(19): 1789-801 5 Weber J et al.: Adjuvant nivolumab versus ipilimumab in resected stage III or IV melanoma. Engl J Med 2017; 377(19): 1824-35 6 Long GV et al.: Adjuvant dabrafenib plus trametinib in stage III BRAF-mutated melanoma. N Engl J Med 2017; 377(19): 1813-23 7 Maio M et al.: Adjuvant vemurafenib in resected, BRAF(V600) mutation-positive melanoma (BRIM8): arandomised, double-blind, placebo-controlled, multicentre, phase 3 trial. Lancet Oncol 2018; 19(4): 510-20 8 Ascierto P et al.: Adjuvant nivolumab versus ipilimumab in resected stage IIIB–C and stage IV melanoma (CheckMate 238): 4-year results from a multicentre, double-blind, randomised, controlled, phase 3 trial. Lancet Oncol 2020; 21: 1465-77 9 Lucas MW et al.: Personalizing neoadjuvant immune-checkpoint inhibition in patients with melanoma. Nat Rev Clin Oncol 2023; 20(6): 408-22 10 Patel S et al.: Neoadjvuant versus adjuvant pembrolizumab for resected stage III-IV melanoma (SWOG S1801). Ann Oncol 2022; 33(Suppl. 7): S1408 11 Wolchok JD et al.: Long-term outcomes with nivolumab plus ipilimumab or nivolumab alone versus ipilimumab in patients with advanced melanoma. J Clin Oncol 2021; 40(2): 127-37 12 Leitlinienprogramm Onkologie (Juli 2020). S3-Leitlinie zur Diagnostik, Therapie und Nachsorge des Melanoms; Version 3.3. AWMF-Register-Nummer: 032/024OL13 Atkins MB et al.: DREAMseq (Doublet, Randomized Evaluation in Advanced Melanoma Sequencing): A phase III trial—ECOG-ACRIN EA6134. J Clin Oncol 2021; 39(Suppl. 36): 356154 14 Carvajal RD et al.: KIT as a therapeutic target in metastatic melanoma. JAMA 2011; 305(22): 2327-34 15 Guo J et al.: Phase II, open-label, single-arm trial of imatinib mesylate in patients with metastatic melanoma harboring c-Kit mutation or amplification. J Clin Oncol 2011; 29(21): 2904-9 16 Hauschild A et al.: Results of a phase III, randomized, placebo-controlled study of sorafenib in combination with carboplatin and paclitaxel as second-line treatment in patients with unresectable stage III or stage IV melanoma. JClin Oncol 2009; 27(17): 2823-30 17 Drilon A et al.: Efficacy of larotrectinib in TRK fusion–positive cancers in adults and children. N Engl J Med 2018; 378(8): 731-9 18 Gutzmer R et al.: Atezolizumab, vemurafenib, and cobimetinib as first-line treatment for unresectable advanced BRAF-V600 Mutation positive Melanome (IMspire150): primary analysis of the randomised, double blind, placebo-controlled, phase-III-trial. Lancet 2020; 395(10240): 1835-44 19 Lipson E J et al.: Relatlimab (RELA) plus nivolumab (NIVO) versus NIVO in first-line advanced melanoma: primary phase III results from RELATIVITY-047 (CA224-047).J Clin Oncol 2021; 39(Suppl. 15): 9503 20 DGHO Pressemitteilung: Keine Markteinführung von Opdualeg – besseres AMNOG oder bessere Studien? 7.3.2023. Online unter https://www.dgho.de/aktuelles/news/news/2023/keine-markteinfuehrung-von-opdulag-r-besseres-amnog-oder-bessere-studien . Abgerufen am 17.1.2024 21 Chen LN et al.: Tebentafusp for the treatment of HLA-A*02:01-positive adult patients with unresectable or metastatic uveal melanoma. Expert Rev Anticancer Ther 2022; 22(10): 1017-27
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...