Urothelkarzinom – Update der THOR- und der THOR-2-Studie
Autorin:
Dr. Johanna Krauter
Universitätsklinik für Urologie
Comprehensive Cancer Center (CCC)Medizinische Universität Wien
E-Mail: johanna.krauter@meduniwien.ac.at
Im Jahr 2023 gab es sowohl in der Therapie des lokalisierten als auch des fortgeschrittenen Urothelkarzinoms Fortschritte. Maßgeblich daran beteiligt sind zielgerichtete Therapien bzw. die zunehmende molekularbasierte Präzisionsmedizin. In diesem Artikel sollen zielgerichtete Therapien mit Erdafitinib bei Patienten mit Alterationen des Fibroblasten-Wachstumsfaktor-Rezeptors (FGFR) im Rahmen der THOR-Studie bei metastasiertem Urothelkarzinom und im Rahmen der THOR-2-Studie beim nichtmuskelinvasiven Blasenkarzinom (NMIBC) vorgestellt werden.
Keypoints
-
Erdafitinib verlängert das mediane Gesamtüberleben bei Patienten mit metastasiertem/fortgeschrittenem Urothelkarzinom und FGFR3/2-Alteration nach Therapie mit einem Checkpoint-Inhibitor im Vergleich zu Chemotherapie.
-
Um Patienten mit metastasiertem/fortgeschrittenem Urothelkarzinom alle Optionen bieten zu können, ist eine molekulargenetische Testung frühzeitig und unbedingt notwendig.
-
Erdafitinib zeigt auch bei Patienten mit IR- oder HR-NMIBC ein gutes Ansprechen, allerdings wiegt der Therapieerfolg i.S. einer Verzögerung des Rezidivs kaum die potenzielle Toxizität auf.
FGFR-Blockade
Durch das zunehmende Verständnis für molekulare Veränderungen und neue, verbreitete Testmethoden sind individuelle Tumormutationen im Urothelkarzinom als Therapieziel von zunehmendem Interesse. Vielversprechende Daten liegen für FGFR-Alterationen vor.
FGFR ist eine zellmembrangebundene Rezeptortyrosinkinase. Nach ihrer Aktivierung schaltet sie weitere intrazelluläre Signalkaskaden über (Phosphatidylinositol-3-Kinase-)AKT-, STAT(„signal transducers and activators of transcription“) oder Ras-MAPK(„mitogen-activated protein kinase“)-Pathways an.1 Durch konstitutiv aktive oder überaktivierte Rezeptorvarianten (welche z.B. durch aktivierende Genfusionen oder Genamplifikationen entstehen) werden diese Proliferation-induzierenden Signalkaskaden durchgehend aktiviert, was in weiterer Folge die Tumorentstehung und -progression beeinflussen kann. Alterationen von FGFR1–4 finden sich bei ca. 5–10% aller Krebsarten, wobei sich beim Urothelkarzinom und beim intrahepatischen Cholangiokarzinom ein deutlich höherer Anteil von ca. 10–30% zeigt.2
Beim Urothelkarzinom sind die 4 Isoformen FGFR1–4 die relevantesten, besonders das FGFR3-Gen, welches auf dem Chromosom 4 lokalisiert ist. FGFR3-Alterationen werden häufiger beim Urothelkarzinom des oberen Harntrakts (UTUC) (zwischen 37% und 47%) und „lowgrade“/„lowrisk“ Urothelkarzinom detektiert (bis zu 70%).3–6 Die häufigsten Alterationen sind S249C9 (60%) auf Exon 7, R248C2 (20%), Y373C2 (10%) sowie die FGFR3-TACC3-Fusion4 (24%).7 Der spezifische Mutationsstatus steht in engem Zusammenhang mit dem Ansprechen auf FGFR-Inhibitoren.
Erdafitinib
Erdafitinib ist ein oraler Pan-FGFR-Tyrosinkinase-Inhibitor, er inhibiert alle 4 FGF-Rezeptoren. Die Verabreichung erfolgt oral in einer Dosierung von 8mg/Tag, ein Zyklus dauert 28 Tage. Erdafitinib als Spätlinientherapie beim metastasierten/fortgeschrittenen Urothelkarzinom ist seit den Ergebnissen der multizentrischen Phase-2-BLC2001-Studie8 von der Food and Drug Administration (FDA) zugelassen, die Zulassung durch die European Medicines Agency (EMA) ist noch ausstehend.
THOR-Studie9
2023 wurden die Studienergebnisse zu THOR von Loriot et al. veröffentlicht. In dieser Phase-III-Studie erhielten Patienten mit einer nachgewiesenen FGFR2/3-Alteration nach Erst- oder Zweitlinientherapie Erdafitinib vs. eine Chemotherapie mit Docetaxel oder Vinflunin nach Ermessen des Prüfarztes. Insgesamt erhielten 136 Patienten Erdafitinib (30% UTUC) und 130 Patienten (37% UTUC) Chemotherapie. Es fanden sich bei 215 (80,8%) der Patienten eine FGFR-Mutation, bei 44 (16,5%) eine FGFR-Fusion und bei 5 Patienten (1,9%) sowohl eine Mutation als auch eine Fusion. Keiner der Patienten hatte eine FGFR2-Alteration; die am häufigsten detektierte Mutation war FGFR3 S249C (46,6%) gefolgt von FGFR Y373C (16,9%) und von der FGFR-TACC3-Fusion (9,8%).
Die Patienten erhielten Erdafitinib 8mg einmal täglich mit Aufdosierung bis 9mg. Die Open-Label-Studie analysierte zwei unabhängige Kohorten separat:
-
Kohorte 1 analysierte Erdafitinib versus Chemotherapie (CHT) bei Patienten mit FGFR-Alteration, die nach ≥1 Therapielinie inklusive PD-(L)1-Inhibitor in den Progress gingen;
-
Kohorte 2 analysierte Erdafitinib versus Pembrolizumab bei Patienten mit mUC, die nach der Erstlinientherapie in den Progress gingen und noch keine Immuntherapie erhalten haben. Primärer Endpunkt war das Gesamtüberleben (OS), sekundäre Endpunkte waren progressionsfreies Überleben (PFS) und die objektive Ansprechrate (ORR).
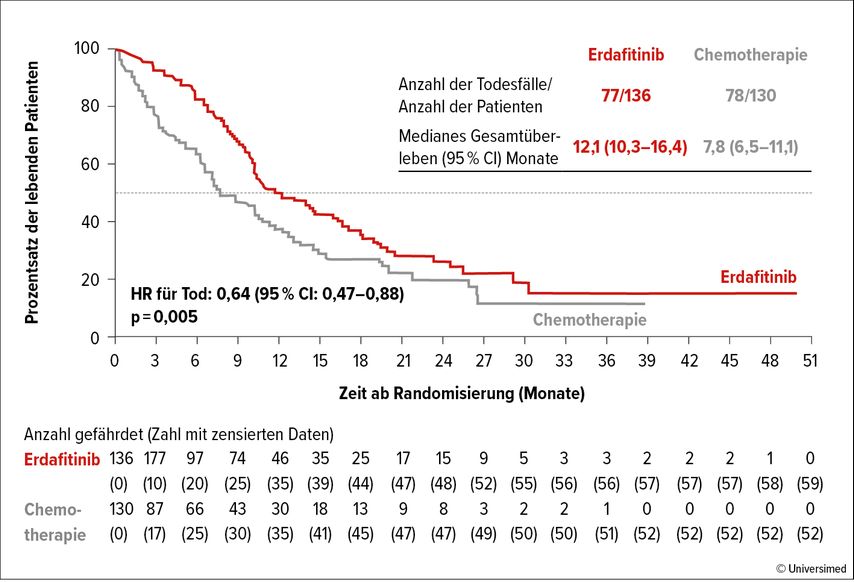
Versus Chemotherapie: Mortalitätsrisiko um 36% reduziert (Abb. 1)
In Kohorte 1 lag das mediane Follow-up bei 15,9 Monaten. Das OS in der Erdafitinib-Gruppe lag bei 12,1 Monaten (95%-Konfidenzintervall [CI]: 10,3 bis 16,4) und bei 7,8 Monaten (95% CI: 6,5 bis 11,1) in der CHT-Gruppe, die Hazard-Ratio (HR) lag bei 0,64 (95% CI: 0,47 bis 0,88; p=0,005). Das mediane PFS lag bei 5,6 Monaten in der Erdafitinib-Gruppe und bei 2,7 Monaten in der CHT-Gruppe. In der Erdafitinib-Gruppe zeigte sich weiters eine höhere ORR als in der CHT-Gruppe (45,6% vs. 11,5%). Ein komplettes Ansprechen (CR) zeigte sich unter Erdafitinib bei 9 Patienten (6,6%) und in der CHT-Gruppe bei einem Patienten. Bei 53 Patienten (39%) fand sich ein partielles Ansprechen (PR) unter Erdafitinib gegenüber 14 Patienten in der CHT-Gruppe (10,8%).
Nebenwirkungen (AE) traten bei 98,5% der Erdafitinib-Gruppe auf und bei 97,3% der CHT-Gruppe. Die Inzidenz von Grad-3-oder -4-Therapie-assoziierten AE war in beiden Gruppen vergleichbar (45,9% in der Erdafitinib-Gruppe und 46,4% in der CHT-Gruppe). Die häufigsten Therapie-assoziierten Nebenwirkungen (trAE) von Erdafitinib umfassten Hyperphosphatämie (80%), Diarrhö(62%), Stomatitis (48%), Mundtrockenheit (39%) sowie Hand-Fuß-Syndrom (30%). Letzteres (9,6%) sowie Stomatitis (8,1%), Onycholysis (5,9) und die Hyperphosphatämie (5,2%) waren die häufigsten Grad-≥-3-Nebenwirkungen. 6 (4,4%) Patienten in der Erdafitinib-Gruppe und 7 (6,2%) Patienten in der CHT-Gruppe hatten AE, die zum Tod führten.
Zusammenfassend zeigte die Erdafitinib-Therapie im Vergleich mit der Chemotherapie ein signifikant längeres medianes Gesamtüberleben bei Patienten mit FGFR2/3-Alteration und nach vorangegangener Therapie inkl. eines PD(L)-1-Inhibitors. Das Nebenwirkungsprofil ist tolerabel, aber Fälle mit letalen Nebenwirkungen sind beschrieben. Somit sollte die Therapie in spezialisierten Zentren mit entsprechender Expertise angewandt werden.
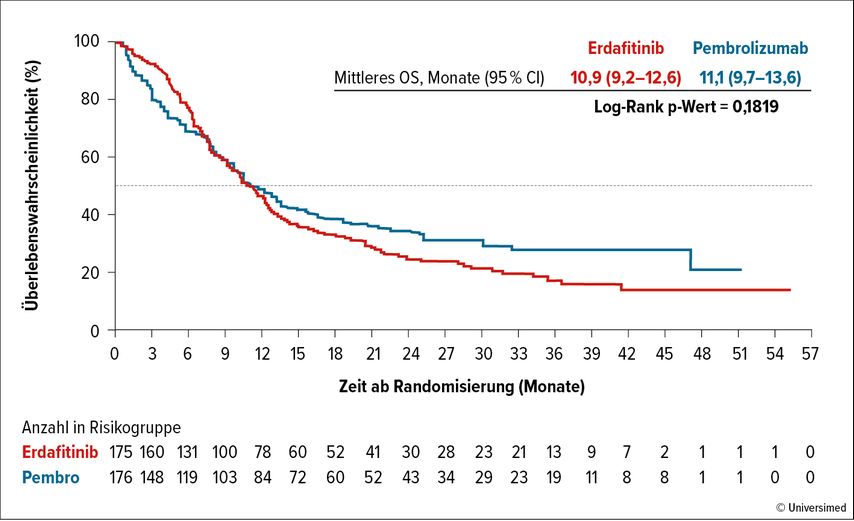
Versus Pembrolizumab: Unterschied nicht signifikant (Abb. 2)
Die Ergebnisse von Kohorte 2 (Erdafitinib vs. Pembrolizumab bei metastasierten oder fortgeschrittenen Patienten mit FGFR-Alterationen) wurden von Siefker-Radtke et al.10 2023 veröffentlicht. Nach einem medianen Follow-up von 33 Monaten wurden die Daten von 175 Patienten im Erdafitinib-Arm mit 176 im Pembrolizumab-Arm verglichen. Hier zeigte sich kein signifikanter Unterschied im OS zwischen dem Erdafitinib-Arm und dem Pembrolizumab-Arm (medianes OS 10,9 versus 11,1 Monate; HR: 1,18; 95% CI). Das mediane PFS betrug 4,4 Monate im Erdafitinib-Arm und 2,7 Monate im Pembrolizumab-Arm (HR: 0,88; 95% CI: 0,70–1,10). Es fanden sich eine ORR von 40% unter Erdafitinib und 21,6% mit Pembrolizumab und eine mediane Ansprechdauer von 4,3 Monaten versus 14,4 Monate. Unerwünschte Nebenwirkungen waren im Erdafitinib-Arm etwas häufiger mit 64,7% versus 50,9% im Pembrolizumab-Arm. Das weitere Nebenwirkungsprofil zeigte sich konsistent zu den Daten in Kohorte 1. Somit zeigten die beiden Therapien ein ähnliches medianes OS, wobei die Ergebnisse des Pembrolizumab-Arms mit einem deutlich längeren Ansprechen besser als ursprünglich gedacht waren, allerdings konsistent mit vorbekannten Daten zu Checkpoint-Inhibitoren in diesem Setting.
Abb. 2: Medianes Gesamtüberleben THOR-Studie Kohorte 2 (modifiziert nach Siefker-Radtke AO et al. 2024)10
Fazit THOR-Studie
Die THOR-Studie hat somit zwei wichtige und interessante Fragestellungen beantwortet:
-
Erdafitinib ist für Patienten mit metastasiertem oder fortgeschrittenem Urothelkarzinom und FGFR2/3-Alteration eine valide Option als Later-Line-Therapie.
-
Betreffend die immer komplexer werdende Therapiesequenz zeigte sich, dass Erdafitinib erst nach einer Therapie mit PD(L)-1-Inhibitoren angewandt werden sollte. Von der FDA ist die Therapie bereits in der Indikation metastasiertes/fortgeschrittenes Urothelkarzinom mit FGFR2/3-Alteration nach zumindest einer Therapie mit PD(L)-1-Inhibitor zugelassen, ein Statement der EMA ist derzeit weiterhin ausstehend.
In den sich immer rascher ändernden Therapiealgorithmen des metastasierten/fortgeschrittenen Urothelkarzinoms kommen laufend neue Therapieoptionen hinzu oder bestehende werden verbessert. Hier stellt sich nun, nachdem sich gemäß der EV-30111-Studie Enfortumab vedotin (EV) und Pembrolizumab als neuer Standard etabliert haben, die Frage, zu welchem Zeitpunkt die Gabe von Erdafitinib bei vorliegender Alteration erfolgen sollte.11 Eine Option ist sicher die Zweitlinie, da eine Immuntherapie hier bereits in der Erstlinie gegeben wurde, allerdings könnten auch Platin-haltige Chemotherapien oder das Antibody-Drug-Konjugat Sacituzumab Govitecan als Alternative diskutiert werden. Um alle Möglichkeiten adäquat mit dem Patienten diskutieren zu können, ist eine frühzeitige molekulargenetische Aufarbeitung notwendig, und diese sollte spätestens nach Versagen der Erstlinientherapie erfolgen.
THOR-2-Studie
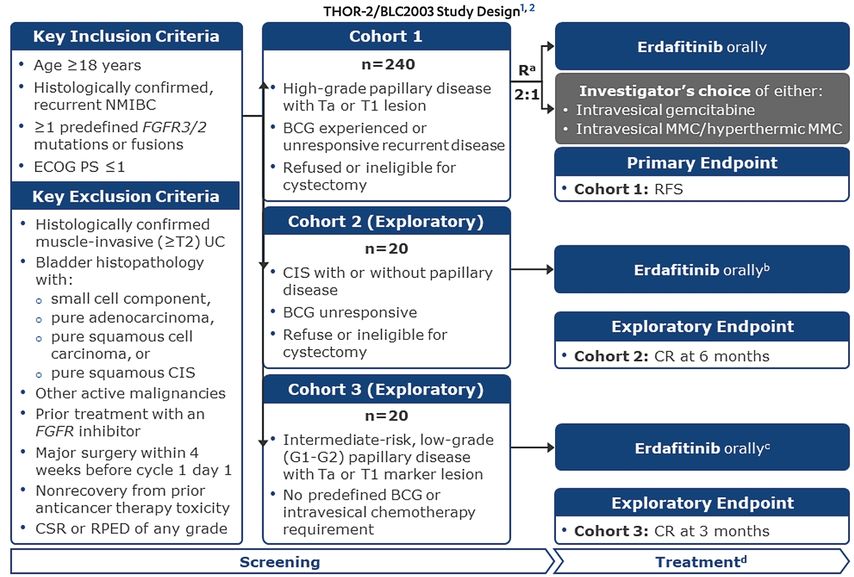
Bei 12–78% der Patienten mit nicht muskelinvasivem Blasenkrebs mit Hochrisiko (HR-NMIBC) kommt es nach transurethraler Resektion und anschließender intravesikaler Therapie mit Bacillus Calmette-Guérin (BCG) zu einem Rezidiv bzw. zu einem Progress in bis zu 46% der Patienten.12,13 In diesen Fällen ist die Zystektomie weiterhin Standard, Alternativen sind nur eingeschränkt vorhanden (z.B. BCG ReChallenge, EMDA, Synergo). Daher sind hier weiterhin neue und bessere Therapien für unsere Patienten notwendig, um die mit hoher Morbidität und Mortalität verbundene Zystektomie zu vermeiden. FGFR-Alterationen werden bei Patienten mit „lowrisk“ NMIBC in ca. 60–70% und bei HR-NMIBC in 20–30% detektiert.14,15 THOR-2 ist eine randomisierte Phase-II-Studie, in der Erdafitinib oral bei Patienten mit NMIBC zur Anwendung kommt, wobei insgesamt 3 Kohorten untersucht werden (Abb. 3):
-
Kohorte 1 evaluiert, ob Erdafitinib das Rezidiv-freie Überleben bei Patienten mit rezidivierendem papillärem Urothelkarzinom (HR-NMIBC ohne Carcinoma in situ; CIS) nach BCG-Therapie (min. 5/6 BCG-Gaben im Induktionszyklus bzw. nach den gängigen Kriterien für BCG-Non-Responder) und FGFR2/3-Alterationen verlängert.
-
Kohorte 2 untersucht Patienten mit CIS plus/minus pTa/pT1-Befund ohne Ansprechen auf BCG.
-
Kohorte 3 untersucht Patienten mit „intermediate risk“ NMIBC oder inkompletter Resektion ohne vorheriges BCG.
Die Patienten wurden 2:1 in den Erdafitinib-Arm oder den Arm mit einer intravesikalen Therapie nach Ermessen des Prüfarztes randomisiert. Initial wurde mit 8mg per os Erdafitinib täglich gestartet, nach Reevaluation der Nebenwirkungen und Sicherheit der ersten 4 Patienten wurde die Dosis auf 6mg Erdafitinib reduziert und für die weitere Studie auf 6mg belassen. Die Behandlung erfolgte für maximal 2 Jahre. Im Vergleichsarm erhielten die Patienten entweder Mitomycin C 40mg oder Gemcitabin 2000mg intravesikal. Patienten mit HR-Rezidiv in der Vergleichsgruppe konnten in den Erdafitinib-Arm übertreten. Primärer Endpunkt war das Rezidiv-freie Überleben (RFS), definiert als Zeit von der Randomisierung bis zum Auftreten eines HR(„high-grade“ Ta/T1 oder CIS)-Rezidivs. Geplant war der Einschluss von 240 Patienten, allerdings konnten nur 73 Patienten aufgrund der langsamen Rekrutierung eingeschlossen werden.
Kohorte 1: Vorteile für Erdafitinib, aber relevante Nebenwirkungen
In der Kohorte 1 erhielten 49 Patienten Erdafitinib und 24 erhielten CHT intravesikal, das mediane Follow-up betrug 13,4 Monate für beide Gruppen. Das mediane RFS war in der Erdafitinib-Gruppe noch nicht erreicht (CI: 95% 16,9 Monate – nicht abschätzbar) und 11,6 Monate für die CHT-Gruppe, mit einer HR von 0,28. Allerdings haben 28 Patienten (57%) die Therapie mit Erdafitinib abgebrochen gegenüber 14 (58%) in der CHT-Gruppe. Die Nebenwirkungen waren in der Erdafitinib-Gruppe der Hauptgrund (28%) für den Therapieabbruch und in der CHT-Gruppe war der Tumorprogress hauptsächlich dafür verantwortlich. Nebenwirkungen zeigten sich bei allen Patienten (100%), welche Erdafitinib erhalten haben, und bei 83% der CHT-Patienten. Das grundsätzliche Nebenwirkungsprofil war ähnlich zu den Daten der THOR-Studie, allerdings dominiertenbei den Nebenwirkungen von Grad≥3 Stomatitis (10%), Nageldystrophie (4%) und Glossitis (4%), deutlich seltener fand sich das Hand-Fuß-Syndrom. Obwohl sich klinisch ein klarer Vorteil für die Erdafitinib-Gruppe zeigte, sind Nebenwirkungen und Therapieabbrüche in relevanter Anzahl vorliegend.
Kohorte 2: gutes Ansprechen bei bekanntem AE-Profil
In der Interimsanalyse von Kohorte 216 (HR-NMIBC mit CIS ± papillären Läsionen, FGFR2/3-Alteration) haben nach einem medianen Follow-up von 10 Monaten 10 Patienten Erdafitinib erhalten. 90% davon hatten CIS, und bei allen Patienten war die Dosierung 6mg Erdafitinib pro Tag. Bei der ersten und zweiten Evaluation (C3D1/C6D1) zeigte sich in 100%/75% ein komplettes Ansprechen (CR). Das mediane Anhalten des Ansprechens lag bei 3 Monaten. Die häufigsten Therapie-assoziierten Nebenwirkungen (trAE) waren Mundtrockenheit (60%), Hyperphosphatämie (50%), Dysgeusie (50%) und Diarrhö (50%). Ein Patient hatte eine Grad-2-Retinaablösung, dies führte zum Therapieabbruch. Nebenwirkungen von Grad ≥3 kamen bei 3 Patienten (30%) vor; dies waren Mundtrockenheit, Stomatitis, Nagelveränderungen, akute Nierenschädigung und -insuffizienz sowie Sepsis. Es kam zu keinen Therapie-assoziierten Todesfällen. Somit zeigte sich auch bei diesen Patienten ein gutes Ansprechen bei dem bekannten Nebenwirkungsprofil.
Kohorte 3: Ansprechen bei bekanntem AE-Profil
In der Interimsanalyse von Kohorte 317 (rezidivierendes IR-NMIBC und FGFR2/3-Alteration) erhielten 10 Patienten Erdafitinib und das mediane Follow-up lag bei 6,2 Monaten. 9 Patienten davon hatten pTa-Tumoren. 6 Patienten zeigten eine CR (75%) und ein Patient hatte ein partielles Ansprechen. Bei diesen Patienten zeigte sich ein medianes Therapieansprechen von 2,8 Monaten. Die trAEs waren konsistent mit den vorangegangenen Ergebnissen (Hyperphosphatämie 90%, Diarrhö 60%, Mundtrockenheit 50%). Zwei Patienten hatten eine trAE von Grad ≥3 (Dysurie, Diarrhö). Es gab keine Therapieabbrüche und es kam zu keinem Therapie-assoziierten Ableben. Soweit man das im Rahmen des kurzen Follow-ups sagen kann, zeigt sich auch hier ein Ansprechen auf Erdafitinib bei bekanntem Nebenwirkungsprofil.
Fazit der THOR-2-Studie
THOR-2 zeigt, dass Erdafitinib eine interessante Alternative für Patienten mit NMIBC und FGFR2/3-Alterationen darstellen kann, das Nebenwirkungsprofil ist allerdings herausfordernd. Die wahrscheinlich bedenklichste Nebenwirkung ist die Retinopathie und die häufigsten NW betreffen Mund, Nägel und Haut. Insgesamt wiegen die Nebenwirkungen kaum die potenzielle Wirkung auf, da man hier nur von einer Verzögerung des Rezidivs und nicht von Heilung sprechen kann. Trotzdem ist die FGFR-Inhibition beim NMIBC weiterhin ein spannender Ansatzpunkt für Therapien, welcher unter anderem in der TAR-210-Studie weiterverfolgt wird.
Literatur:
1 Ornitz DM, Itoh N: The fibroblast growth factor signaling pathway. Wiley Interdiscip Rev Dev Biol 2015; 4(3): 215-66 2 HelstenT et al.: The FGFR landscape in cancer: analysis of 4,853 tumors by next-generation sequencing. Clin Cancer Res 2016; 22(1): 259-67 3 Robinson BD et al.: Upper tract urothelial carcinoma has a luminal-papillary T-cell depleted contexture and activated FGFR3 signaling. Nat Commun 2019; 10(1): 2977 4 Audenet F et al.: Clonal relatedness and mutational differences between upper tract and bladder urothelial carcinoma. Clin Cancer Res 2019; 25(3): 967-76 5 Hernández S et al.: Prospective study of FGFR3 mutations as a prognostic factor in nonmuscle invasive urothelial bladder carcinomas. J Clin Oncol 2006; 24(22): 3664-71 6 Kim K et al.: Modeling biological and genetic diversity in upper tract urothelial carcinoma with patient derived xenografts. Nat Commun 2020; 11(1): 1975 7 Tony I et al.: Clinical development of FGFR3 inhibitors for the treatment of urothelial cancer. Bl Cancer Preprint 2019; 1-15 8 Loriot Y et al.: Erdafitinib in locally advanced or metastatic urothelial carcinoma. N Engl J Med 2019; 381(14): 338-48 9 Loriot Y et al.: Erdafitinib or chemotherapy in advanced or metastatic urothelial carcinoma. N Engl J Med 2023; 389(21): 1961-71 10 Siefker-Radtke AO et al.: Erdafitinib versus pembrolizumab in pretreated patients with advanced or metastatic urothelial cancer with select FGFR alterations: cohort 2 of the randomized phase III THOR trial. Ann Oncol 2024; 35(1): 107-17 11 Powles T et al.: Enfortumab vedotin and pembrolizumab in untreated advanced urothelial cancer. N Engl J Med 2024; 390(10): 875-88 12 Grimm MO et al.: Treatment of high-grade non-muscle-invasive bladder carcinoma by standard number and dose of BCG instillations versus reduced number and standard dose of BCG instillations: results of the European Association of Urology Research Foundation randomised phase III clinical trial “NIMBUS.” Eur Urol 2020; 78(5): 690-8 13 Sylvester RJ et al.: Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: acombined analysis of 2596 patients from seven EORTC trials. Eur Urol 2006; 49(3): 466-77 14 Knowles MA, Hurst CD: Molecular biology of bladder cancer: new insights into pathogenesis and clinical diversity. Nat Rev Cancer 2015; 15(1): 25-41 15 Eich ML et al.: Incidence and distribution of UroSEEK gene panel in a multi-institutional cohort of bladder urothelial carcinoma. Mod Pathol 2019; 32(10): 1544-50 16 Catto JW F et al.: Phase 2 study of the efficacy and safety of erdafitinib in patients (pts) with bacillus Calmette-Guérin (BCG)-unresponsive, high-risk non–muscle-invasive bladder cancer (HR-NMIBC) with FGFR3/2 alterations (alt) in THOR-2: cohort 2 interim analysis results. J Clin Oncol 2023; 41: ASCO Abstr. 503 17 Daneshmand S et al.: Phase 2 study of the efficacy and safety of erdafitinib in patients (pts) with intermediate-risk non–muscle-invasive bladder cancer (IR-NMIBC) with FGFR3/2 alterations (alt) in THOR-2: cohort 3 interim analysis. J Clin Oncol 2023; 41: ASCO Abstr. 504
Das könnte Sie auch interessieren:
Korrelation von Stoffwechselmetaboliten mit bildmorphologischen, genetischen und biologischen Markern bei Verdacht auf ein Prostatakarzinom
Das Prostata-spezifische Antigen (PSA), die multiparametrische Magnetresonanztomografie (mpMRT) der Prostata und seltener noch der Prostate-Cancer-Antigen-3-Test (PCA-3) haben sich als ...
Active Surveillance beim Low-Risk-PCa: was uns Studien wirklich lehren
Active Surveillance (AS) bei Prostatakarzinom gewinnt unter den Ärzt:innen zunehmend an Akzeptanz. Patienten wünschen sich vermehrt Informationen dazu, um qualifiziert entscheiden zu ...
Klassifikationssysteme für intraoperative Komplikationen in der Urologie
Intraoperative Komplikationen gehören zum chirurgischen Alltag, deren systematische Erfassung ist jedoch in der Urologie nach wie vor lückenhaft. Vorhandene Klassifikationssysteme werden ...