Neue Therapieperspektiven bei hohem Risiko für biochemisches Rezidiv
Autor:innen:
Dr. Sarah Meiser
Prim. Priv.-Doz. DDr. Stefan Aufderklamm, FEBU
Abteilung für Urologie
Landeskrankenhaus Bregenz
E-Mail: stefan.aufderklamm@lkhb.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das biochemische Rezidiv (BCR) nach lokaler Therapie des Prostatakarzinoms (PCa) stellt eine klinische Herausforderung dar. DieEntscheidung über den optimalen Zeitpunkt und die Art der Therapie ist in diesem Stadium von entscheidender Bedeutung, da sie das Fortschreiten der Erkrankung maßgeblich beeinflussen kann. Durch die EMBARK-Studie ist Enzalutamid (in Kombination mit einer Androgendeprivationstherapie; ADT) seit April 2024 in der Europäischen Union (EU) zur Behandlung eines High-Risk-BCR bei PCa zugelassen. Dies führte zu einem Paradigmenwechsel im Behandlungsstandard von Patienten mit nicht metastasiertem hormonsensitivem PCa (nmHSPC).
Keypoints
-
Bei Patienten mit Hochrisiko-BCR zeigte die Kombination aus Enzalutamid und Leuprolidacetat eine statistisch signifikante und klinisch bedeutsame Verlängerung des MFS vs. ADT.
-
Sie beeinträchtigt die allgemeine Lebensqualität bei Patienten mit nmHSPC nicht.
-
Zusätzlich zeigt sich ein Trend zu einem verlängerten Überleben in der Zwischenanalyse.
-
Die Enzalutamid-Monotherapie zeigte ebenso eine statistisch signifikante und klinisch bedeutsame Verlängerung im MFS.
-
Zusätzlich war eine Verlängerung der Zeit bis zur PSA-Progression und zu einer neuen antineoplastischen Therapie zu verzeichnen.
-
Die intermittierende Hormontherapie kann sowohl die Therapienebenwirkungen als auch die Kosten reduzieren.
Etwa 30% der Patienten, die eine lokale Prostatakarzinomtherapie durchlaufen, entwickeln im Verlauf ein biochemisches Rezidiv (BCR).1,2 Anhand der BCR-Risikogruppierung der European Association of Urology (EAU) werden diese Rezidive in Hoch- und Niedrigrisikorezidive unterteilt.3 Insbesondere bei Patienten mit einem hohen Risiko für ein BCR (PSA-Verdopplungszeit ≤9Monate) besteht ein erhöhtes Risiko für eine schnelle Progression bis hin zur Metastasierung.4–6
Aktuelle Evidenz- und Studienlage zur Therapie des nmHSPC
Die Evidenzlage zu Behandlungsmöglichkeiten für Patienten mit nicht metastasiertem, hormonsensitivem Prostatakarzinom (nmHSPC) und einem hohen Risiko für ein BCR ohne erkennbare Metastasen war bisher begrenzt.3 Zu den Standardtherapien zählten die systemische Behandlung mit einer Androgendeprivationstherapie (ADT) oder eine Salvage-Strahlentherapie bzw. die Beobachtung mittels „Active Surveillance“ (AS).3 Bisher gibt es keinen allgemeinen klinischen Konsens über das optimale Timing der ADT.7 Für Patienten, die lokale Behandlungsoptionen ausgeschöpft haben, empfehlen aktuelle Leitlinien der American Urological Association (AUA), der American Society for Radiation Oncology (ASTRO) und der Society for Urologic Oncology (SUO), ADT nicht routinemäßig einzuleiten und, falls initiiert, sie intermittierend anzuwenden.8 Es existieren bislang zwei randomisierte Studien, die den Einsatz des Hormonentzugs bei BCR untersucht haben. Crook etal. zeigten 2012, dass eine intermittierende Hormontherapie bei einem PSA-Anstieg nach Prostatabestrahlung hinsichtlich des Gesamtüberlebens einer kontinuierlichen Hormontherapie nicht unterlegen ist.9 Die TOAD-Studie verglich eine sofortige mit einer verzögerten Hormontherapie bei Patienten mit PSA-Rezidiv. Ein Überlebensvorteil wurde bei sofortiger Hormontherapie beobachtet, allerdings waren die Ergebnisse in der Untergruppe mit PSA-Rezidiv nicht signifikant.10
Die Datenlage zum Einsatz der Hormontherapie bei biochemischem Rezidiv war somit bisher nicht ganz klar. Meist bestand die einzige Möglichkeit darin, den PSA-Verlauf weiter abzuwarten, bis Metastasen sichtbar würden, bevor eine systemische Therapie begonnen werden konnte.
Im April 2024 wurde Enzalutamid für die Therapie eines biochemischen Rezidivs des High-Risk-Prostatakarzinoms nach initial lokaler Therapie in der EU zugelassen. Grundlage hierfür sind die Ergebnisse der EMBARK-Studie, die den Nutzen neuer hormoneller Substanzen untersuchten. Insbesondere wurde geprüft, ob Patienten mit High-Risk-BCR von einer Kombinationstherapie aus Enzalutamid und ADT profitieren.
Ziel der EMBARK-Studie
Das Ziel der Studie bestand darin, den Nutzen einer Hormonentzugstherapie mit Enzalutamid in Kombination mit Leuprorelin im Vergleich zur alleinigen Behandlung mit Leuprorelin bei Patienten mit einem High-Risk-BCR zu bewerten. Zusätzlich wurde eine Enzalutamid-Monotherapie als dritter Behandlungsarm untersucht.
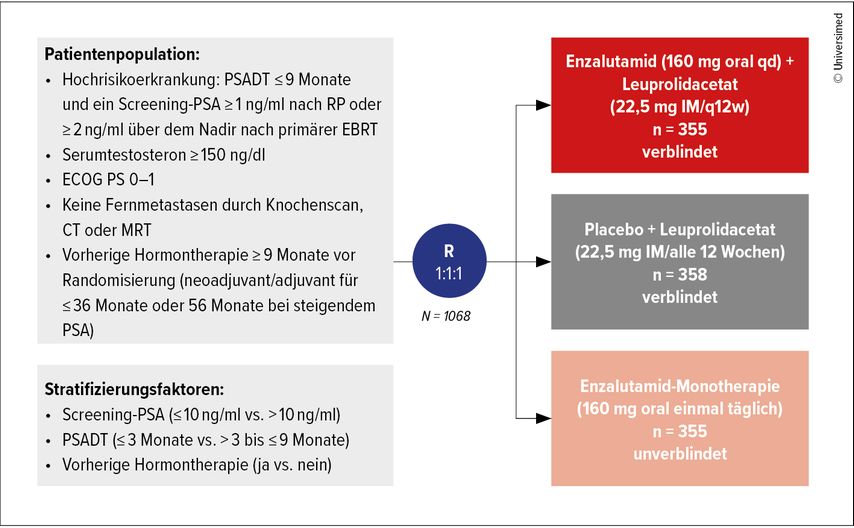
Die EMBARK-Studie ist eine randomisierte, multizentrische Phase-III-Studie mit drei Behandlungsarmen: 1.Kombinationstherapie Enzalutamid (160mg täglich) plus Leuprorelin (22,5mg alle 12 Wochen); 2.Monotherapie mit Enzalutamid allein; 3.Kontrollarm mit Placebo plus Leuprorelin. Eingeschlossen wurden Patienten mit einem High-Risk-BCR, definiert durch eine PSA-Verdopplungszeit≤9 Monate und spezifische PSA-Werte je nach vorangegangener Therapie (≥1ng/ml nach Prostatektomie und ≥2ng/ml nach Radiatio). Der primäre Endpunkt war das metastasenfreie Überleben (MFS), sekundäre Endpunkte umfassten die Lebensqualität, die PSA-Progression und die Therapiesicherheit. Insgesamt wurden 1068 Patienten im Verhältnis 1:1:1 randomisiert (Abb. 1).11
Abb. 1: Studiendesign mit Patientenpopulation und Stratifizierungsfaktoren (nach Freedland SJ et al. 2023)11
Ergebnisse
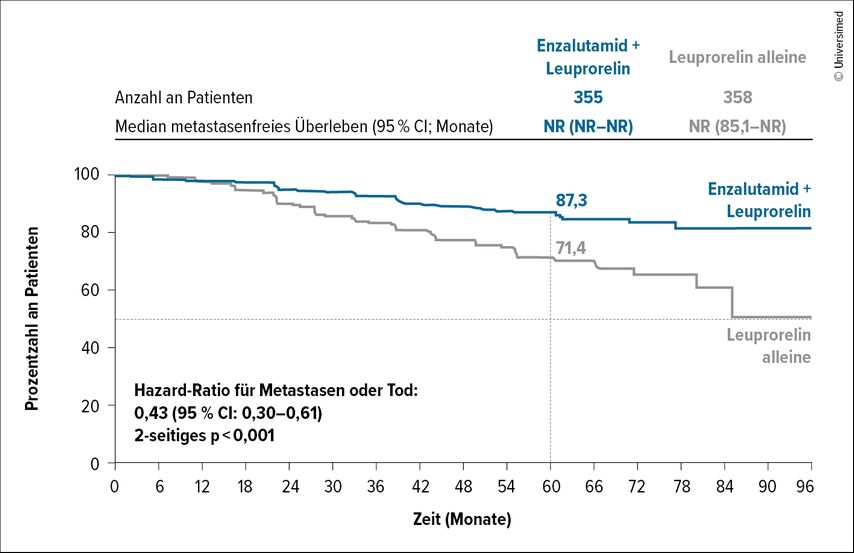
Nach einer medianen Nachbeobachtungszeit von 60,7 Monaten zeigte die Kombinationstherapie signifikante Vorteile gegenüber der Monotherapie. Die Kombinationstherapie war der alleinigen Leuprorelin-Behandlung hinsichtlich des MFS überlegen. Auch die Monotherapie mit Enzalutamid zeigte eine Verbesserung gegenüber Leuprorelin allein. Es traten keine neuen Sicherheitsbedenken auf. Auch in Bezug auf die Lebensqualität gab es keine signifikanten Unterschiede zwischen den drei Armen der Studie. Die Rate des 5-Jahres-MFS lag in der Kombinationstherapiegruppe bei 87,3% (95%CI: 83,0–90,6), in der Enzalutamid-Monotherapie bei 80,0% (95%CI: 75,0–84,1) und in der Gruppe mit Leuprorelin allein bei 71,4% (95%CI: 65,7–76,3; Abb. 2).11
Abb. 2: Metastasenfreies Überleben mit Enzalutamid plus Leuprorelin vs. Leuprorelin alleine (nach Freedland SJ et al. 2023)11
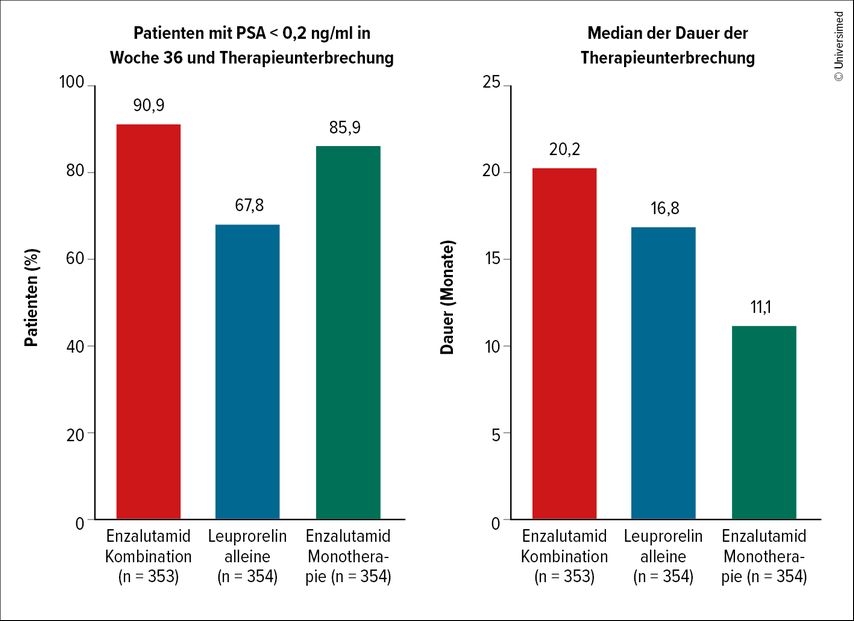
Ein besonderes Merkmal des Studienprotokolls war die Therapiepause bei Patienten mit nicht nachweisbarem PSA (<0,2ng/ml) nach 36 Wochen, während die Studienbehandlung bei Teilnehmern mit nachweisbarem PSA fortgesetzt wurde, bis die Kriterien für einen dauerhaften Behandlungsabbruch erfüllt waren (d.h. Progress in einer konventionellen radiologischen Bildgebung; Abb. 3).11 Die Behandlung wurde wieder aufgenommen, wenn die nachfolgenden PSA-Werte auf≥2,0ng/ml bei Teilnehmern mit vorheriger Prostatektomie oder ≥5,0ng/ml bei Patienten ohne Prostatektomie angestiegen waren.
Abb. 3: Prozentsatz der Patienten, bei denen eine Therapiepause möglich war (PSA<0,2ng/ml in Woche 36) und mittlere Dauer der Therapiepause (nach Freedland SJ et al. 2023)11
Fazit
Im Kombinationsarm konnte die Hormontherapie bei über 90% der Patienten pausiert werden und in diesem Arm war die Pause am längsten möglich (20,2 Monate). Auch im Enzalutamid-Monotherapie-Arm konnte die Therapie in 85,9% der Fälle pausiert werden, allerdings war die Therapiepause hier am kürzesten (11,1 Monate). Bei der alleinigen Therapie mit Leuprorelin war eine Pausierung in zwei Dritteln (67,8%) der Fälle möglich. Die mediane Pause betrug hier 16,8 Monate.
Die Ergebnisse der EMBARK-Studie eröffnen neue Therapieoptionen für Patienten mit High-Risk-BCR nach Ausschöpfung lokaler Therapieoptionen. Die Kombinationstherapie aus Enzalutamid und Leuprorelin zeigte die effektivste Strategie für Patienten mit High-Risk-BCR, insbesondere im Hinblick auf das MFS. In der Zwischenanalyse zeigt sich zusätzlich ein Trend zur Verlängerung des Gesamtüberlebens.
Auch die Enzalutamid-Monotherapie bietet Vorteile und könnte für Patienten eine weniger invasive Alternative darstellen. Außerdem können unerwünschte Ereignisse im Zusammenhang mit der GnRH-Therapie, einschließlich Diabetes mellitus, ischämischer Herzkrankheiten und Osteoporose, vermieden werden.12–14 Die sexuelle Aktivität blieb unter der Enzalutamid-Monotherapie in Bezug auf Interesse, Aktivität, Zufriedenheit und Aufrechterhaltung der Erektion besser erhalten. Nebenwirkungen wie Gynäkomastie, Brustverspannung und Schmerzen der Brustwarzen traten jedoch häufiger auf. Eine prophylaktische Bestrahlung der Brustdrüse vor Therapiebeginn könnte diese Nebenwirkung verringern.
Einschränkungen der Studie umfassen das konventionelle Staging (CT/MRT), wodurch Metastasen im Vergleich zum PSMA-PET/CT seltener erkannt werden. Es stellt sich die Frage, wie sich die Ergebnisse darstellen würden, wenn die Patienten ein negatives PSMA-PET/CT zum Studieneinschluss benötigt hätten.
In einer auf der ASCO 2023 vorgestellten Studie wurden PSMA-PET-Befunde bei 183 Patienten untersucht, die einem EMBARK-ähnlichen Kollektiv entsprachen. Dabei waren 85,2% der Patienten PSMA-PET-positiv und 46% des Gesamtkollektivs wiesen eine M1-Erkrankung auf. Sollten diese Ergebnisse mit dem Patientenkollektiv der EMBARK-Studie übereinstimmen, hätten sich 46% der Patienten direkt für eine erweiterte Hormontherapie qualifiziert.15 Es bleibt daher unklar, ob auch bei den verbleibenden M0-Patienten eine Verlängerung des MFS erreicht worden wäre.
Zwei weitere Möglichkeiten für die Behandlung eines High-Risk-BCR werden derzeit in noch laufenden Studien untersucht. Die PRESTO-Studie (AFT–19) untersucht die Hormontherapie mit Apalutamid beim High-Risk-BCR und die ersten Interimsanalysen zeigen sich vielversprechend. Beide Behandlungsarme, die Apalutamid enthielten, zeigten ein signifikant längeres biochemisches progressionsfreies Überleben als der Kontrollarm (unter ADT).16
Eine weitere laufende Studie, die ein PSMA-PET/CT-Staging beinhaltet, ist die ARASTEP-Studie, die den Einsatz von Darolutamid plus ADT bei High-Risk-BCR untersucht.
Die EMBARK-Studie stellt möglicherweise einen Paradigmenwechsel in der Behandlung des High-Risk-BCR dar und zeigt, dass eine personalisierte Kombinationstherapie nicht nur das MFS verlängert, sondern auch neue Möglichkeiten für die Therapiepause eröffnen kann – ein Ansatz, der die Lebensqualität von Patienten erheblich verbessern könnte.
Literatur:
1 Han M et al.: Long-term biochemical disease-free and cancer-specific survival following anatomic radical retropubic prostatectomy. Urol Clin North Am 2001; 28(3): 555-65 2 Liesenfeld L et al.: Prognostic factors for biochemical recurrence more than 10 years after radical prostatectomy. J Urol 2017; 197(1): 143-8 3 Mottet N et al.: EAU-EANM-ESTRO-ESUR-SIOG guidelines on prostate cancer — 2020 update. Part 1: screening, diagnosis, and local treatment with curative intent. Eur Urol 2021; 79(2): 243-62 4 Freedland SJ et al.: Death in patients with recurrent prostate cancer after radical prostatectomy: Prostate-specific antigen doubling time subgroups and their associated contributions to all-cause mortality. J Clin Oncol 2007; 25(13): 1765-71 5 Freedland SJ et al.: Risk of prostate cancer–specific mortality following biochemical recurrence after radical prostatectomy. JAMA 2005; 294(4): 433 6 Zelefsky MJ et al.: Outcome predictors for the increasing PSA state after definitive external-beam radiotherapy for prostate cancer. J Clin Oncol 2005; 23(4): 826-31 7 Garcia-Albeniz X et al.: Immediate versus deferred initiation of androgen deprivation therapy in prostate cancer patients with PSA-only relapse. An observational follow-up study. Eur J Cancer 2015; 51(7): 817-24 8 Lowrance WT et al.: Advanced prostate cancer: AUA/ASTRO/SUO Guideline Part 1. J Urol 2021; 205(1): 1-21 9 Crook JM et al.: Intermittent androgen suppression for rising PSA level after radiotherapy. N Engl J Med 2012; 367(10): 895-903 10 Duchesne GM et al.: Timing of androgen-deprivation therapy in patients with prostate cancer with a rising PSA (TROG 03.06 and VCOG PR 01-03 [TOAD]): a randomised, multicentre, non-blinded, phase 3 trial. Lancet Oncol 2016; 17(6): 727-37 11 Freedland SJ et al.: Improved outcomes with Enzalutamide in biochemically recurrent prostate cancer. N Engl J Med 2023; 389(16): 1453-65 12 Taylor LG et al.: Review of major adverse effects of androgen-deprivation therapy in men with prostate cancer. Cancer 2009; 115(11): 2388-99 13 Keating NL et al.: Diabetes and cardiovascular disease during androgen deprivation therapy: observational study of veterans with prostate cancer. J Natl Cancer Inst 2010; 102(1): 39-46 14 Shahinian VB et al.: Risk of fracture after androgen deprivation for prostate cancer. N Engl J Med 2005; 352(2): 154-64 15 Armstrong WR et al.: PSMA PET findings in an “EMBARK-like” cohort of patients with high-risk non-metastatic hormone-sensitive prostate cancer: a single center post-hoc retrospective analysis. J Clin Oncol 2023; 41(16): 5091 16 Aggarwal RR et al.: Baseline characteristics associated with PSA progression-free survival in patients (pts) with high-risk biochemically relapsed prostate cancer: results from the phase 3 PRESTO study (AFT-19). J Clin Oncol 2023; 41(6): 208
Das könnte Sie auch interessieren:
Psychische und körperliche Auswirkungen verschobener elektiver Operationen
Pflege- und Personalmangel führten in Österreichs Urologie zu deutlichen Einschränkungen in der elektiven operativen Versorgung. Eine Studie der Medizinischen Universität Graz zeigt, ...
Perioperative Therapie mit Enfortumab Vedotin + Pembrolizumab bei Cisplatin-ungeeigneten Patienten mit MIBC
Die Phase-III-Studie KEYNOTE-905/EV-303 schließt eine entscheidende und seit Langem offene Versorgungslücke bei muskelinvasivem Blasenkarzinom: Für Cisplatin-ungeeignete Patient:innen ...
„Ein hochintellektueller Mensch mit nahezu universellem Interesse“
Univ.-Prof. Dr. Lipsky ist am 9. September 2025 nach einem – wie in der Parte vermerkt – erfüllten Leben von uns gegangen und wir haben einen großen Urologen in unserer Mitte verloren!