Systemtherapie bei nichtklarzelligen Nierenzellkarzinomen
Autorin:
Ass.-Prof. PD Dr. Renate Pichler, PhD, FEBU
Univ.-Klinik für Urologie
Comprehensive Cancer Center Innsbruck (CCCI)
Medizinische Universität Innsbruck
E-Mail: renate.pichler@i-med.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das nichtklarzellige Nierenzellkarzinom (nccRCC) vereint unter anderem die Subtypen des papillären und chromophoben RCC in seiner Kategorie. Gerade im metastasierten Setting gestalten sich die Leitlinienempfehlungen für eine Systemtherapie des nccRCC sehr dünn und Therapieregime schwierig. Im Folgenden eine Zusammenfassung der rezentesten Daten.
Keypoints
-
Das nichtklarzellige RCC stellt eine heterogene Erkrankungsgruppe dar.
-
Die Mutationslandschaft unterscheidet sich beim nichtklarzelligen RCC je nach histologischem Subtyp wesentlich.
-
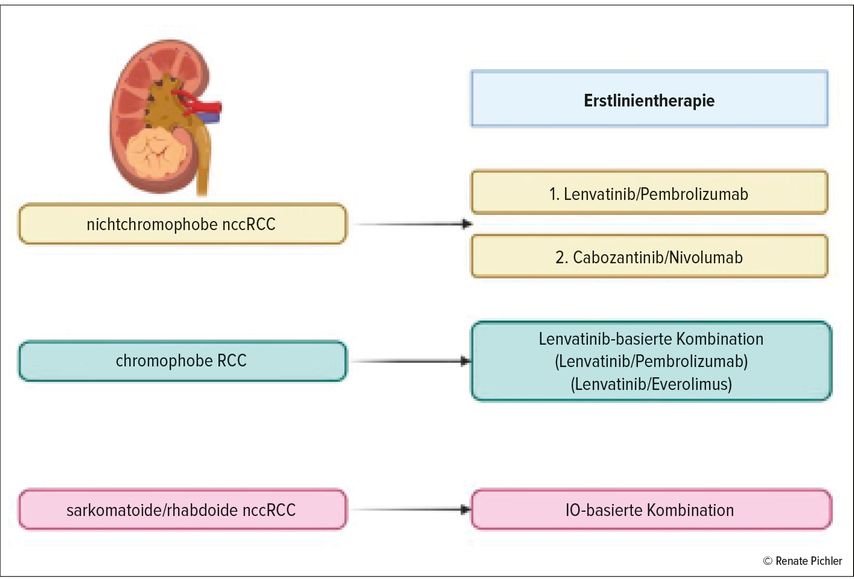
IO-basierte Kombinationen (IO plus TKI) wie Lenvatinib/Pembrolizumab und Cabozantinib/Nivolumab zeigen die höchste Effizienz bei der Gruppe nichtchromophober nichtklarzelliger RCC.
-
Das chromophobe RCC zeigte bis dato die besten Ansprechraten bei Lenvatinib-basierten Kombinationen.
-
Sarkomatoide nccRCC sollten, wie sarkomatoide ccRCC, mit IO-basierten Kombinationen behandelt werden.
Die heterogene Gruppe der nichtklarzelligen RCC (nccRCC) zeigt eine Häufigkeit von ca. 20–25%. Zu den häufigsten histologischen Subtypen dieser Gruppe gehören das papilläre RCC und das chromophobe RCC. Im lokalisierten Setting ist die chirurgische Resektion wie beim hellzelligen RCC die Therapie der Wahl und zeigt ein vergleichbares Überleben zwischen den einzelnen Subtypen (5-Jahres-Gesamtüberleben bei nichtmetastasierten chromophoben, papillären und hellzelligen RCC: 91% vs. 82% vs. 81%).
Systemtherapie
Im metastasierten Status gestaltet sich die Therapie der nccRCC deutlich schwieriger im Vergleich zu den ccRCC. Die Empfehlungen der Leitlinien (EAU, ESMO und NCCN) sind dazu sehr schwach, da in den versierten immunonkologisch (IO) basierten Zulassungsstudien der Erstlinienkombinationstherapie zumeist nur ccRCCs eingeschlossen wurden.
Tyrosinkinaseinhibitor(TKI)-Monotherapien (idem zu den ccRCCs) zeigten bis dato nur geringe Erfolge mit einer objektiven Ansprechrate zwischen 4 und 28%. Das durchschnittliche progressionsfreie Überleben (PFS) lag nur bei knapp 8 Monaten. Neue therapeutische Entwicklungen zeigen jedoch ein verbessertes Outcome (objektive Ansprechrate 23–72%; PFS bis 21 Monate) durch eine personalisiertere Therapie mit MET-Inhibitoren bei „MET-driven“-Tumoren oder eine Kombination aus Immuntherapie und zielgerichteten Therapien bei molekular basierten RCC („FH-deficient“ RCC; „SDH-deficient“ RCC; „ALK-rearranged“ RCC; „TFEB-alteriertes“ RCC; „TFE3-rearranged“ RCC oder ELOC-mutiertes RCC).
Die nccRCCs sind eine sehr heterogene Erkrankungsgruppe, gekennzeichnet durch eine signifikant unterschiedliche Mutationslandschaft. Die molekulare Analyse von 161 papillären RCC der TCGA-Kohorte zeigte, dass der papilläre RCC-Typ1 vor allem durch MET-Alterationen geprägt ist, während der papilläre RCC-Typ2 somatische Mutationen im NRF2-ARE-Signalweg hat, mit einem Verlust von CDKN2A. Im Unterschied dazu zeigen chromophobe RCC hauptsächlich TP53- und PTEN-Mutationen, Alterationen in der mitochondrialen DNA und Alterationen im mTOR-Signalweg (23%). Diese unterschiedlichen Mutationen innerhalb der nccRCC-Gruppe liefern eine essenzielle Erklärung, warum nccRCCs auf die verschiedenen IO-basierten Kombinationen unterschiedlich ansprechen.
nccRCC (ausgenommen chromophobe RCC)
Die objektiven Ansprechraten beim papillären RCC liegen bei 23% (Cabozantinib-Monotherapie), 25,4% (Pembrolizumab-Monotherapie), 15% (Lenvatinib/Everolimus), 29% (Savolitinib/Durvalumab) und sind somit deutlich geringer als bei den folgenden Kombinationen aus Nivolumab/Cabozantinib (ORR: 47%), Atezolizumab/Cabozantinib (COSMIC-021, ORR: 47%) und Lenvatinib/Pembrolizumab (ORR: 52,9%). Ein Update zu den Kombinationen Lenvatinib/Pembrolizumab (Lee CH et al.: Keynote-B61-Studie: Abstract No.4518) und Nivolumab/Cabozantinib (Lee CH et al.: Abstract No.4537) gab es am ASCO-Kongress 2023. Somit liefern die beiden Kombinationen Lenvatinib/Pembrolizumab und Cabozantinib/Nivolumab im Moment die Daten mit dem höchsten Evidenzlevel bei nichtchromophoben nccRCC.
Die KNB61-Studie ist die größte prospektive Phase-II-Studie, welche die Kombination aus Lenvatinib/Pembrolizumab bei nccRCC in der Erstlinie untersuchte. Eingeschlossen wurden 158 nccRCC-Patienten, davon waren 59% papilläre RCC, knapp 18% chromophobe RCC, 13% nichtklassifizierte RCC und 3% Translokationskarzinome. Nach einem Follow-up von 14,9 Monaten lag die ORR der Gesamtpopulation bei 49,4%. Nach 12 Monaten waren 63% aller Patienten progressionsfrei und 82% waren am Leben. Das mediane PFS lag erstaunlicherweise bei 17,9 Monaten. Die Ansprechraten waren homogen und kongruent zwischen den einzelnen histologischen Subtypen (papilläres RCC: 53,8%; Translokationskarzinom: 66,7%; nichtklassifizierte RCC: 52,4%). Die Nebenwirkungsprofile waren ähnlich zu den Vorergebnissen ohne neue Toxizitäten.
Das Update zur Phase-II-Studie aus Nivolumab/Cabozantinib (McGregor BA et al.: Abstract No. 4520) wurde ebenfalls am ASCO 2023 präsentiert. Es wurden im Vergleich zur KNB61-Studie deutlich weniger Patienten eingeschlossen, primär 47, und nach Ausschluss der chromophoben RCC erhielten 40 Patienten ein Follow-up von 34 Monaten. Ein weiterer negativer Punkt ist, dass in dieser Studie nicht alle Patienten Nivolumab/Cabozantinib in der Erstlinie erhielten. 14 (35%) Patienten hatten bereits eine vorangegangene Therapielinie. Die Ansprechraten waren insgesamt 41% und 54% bei den nichtchromophoben nccRCC und somit vergleichbar mit den KNB61-Daten. Das mediane PFS war 13 Monate und das mediane Gesamtüberleben lag bei 28 Monaten.
Chromophobes RCC
Interessanterweise zeigen die unterschiedlichsten Systemtherapien beim chromophoben RCC ein deutlich geringeres Ansprechen im Vergleich zu den non-chromophoben nccRCC. Die objektive Ansprechrate liegt bei 9% (Pembrolizumab-Monotherapie) und 11% (Cabozantinib/Atezolizumab). Es muss stets erwähnt werden, dass die Fallzahlen der chromophoben RCC in den jeweiligen Studien sehr klein waren. Die höchsten Ansprechraten konnte man bis dato in einer sehr kleinen Fallserie (n=9) durch eine Lenvatinib-basierte Kombination erzielen. Im Detail lag die objektive Ansprechrate bei 44% durch die Kombination aus Lenvatinib und Everolimus, während die Ansprechrate für diese Kombination beim papillären RCC gering war (ORR: 15%). Eine mögliche Erklärung der sehr hohen ORR liegt im Mutationsprofil (Alterationen im mTOR-Signalweg). Die KNB61-Studie (Lenvatinib/Pembrolizumab) inkludierte insgesamt 29 chromophobe RCC und präsentiert somit die größte Fallserie beim chromophoben RCC. Die objektive Ansprechrate lag hier immerhin bei 27,6%.
Sarkomatoide/rhabdoide nccRCC
Wie wir bereits aus der explorativen Subgruppenanalyse der CM214-Studie wissen, ist die duale IO-Therapie (Nivolumab/Ipilimumab) in der Erstlinie beim sarkomatoiden ccRCC primär vorzuziehen. Das mediane PFS lag in dieser speziellen Population bei 26,5 Monaten. Die ORR war 61% mit einer kompletten Remissionsrate von 19%. Bei PD-L1- und sarkomatoiden ccRCC sind die Daten zu Nivolumab/Ipilimumab nochmals besser (ORR: 70%, CR: 22%). Das mediane PFS und OS sind noch immer nicht erreicht. Mit der Fragestellung, ob man diese Daten auch auf die sarkomatoiden/rhabdoiden (s/r) nccRCC übertragen kann, hat sich Chris Labaki (Labaki C et al.: Abstract No. 4519) beim ASCO 2023 auseinandergesetzt. Es handelt sich dabei um die bisher größte retrospektive Fallserie an nccRCC mit insgesamt 533 Patienten, 103 Patienten (s/r nccRCC) im Vergleich zu 430 Patienten und einem ns/nr nccRCC. Der primäre Endpunkt war das Gesamtüberleben, der sekundäre Endpunkt die Ansprechrate. Eine IO-basierte Kombinationstherapie wurde mit einer zielgerichteten TKI-Therapie in der jeweiligen Gruppe verglichen. Bei den s/r nccRCC und IO-basierter Kombinationstherapie erhielten 70% der Patienten die duale IO (Nivolumab/Ipilimumab). Die IO-basierten Kombinationen zeigten, kongruent zu den Daten beim sarkomatoiden ccRCC, ein signifikant besseres Ansprechen (ORR: 34,5% vs. 10,9%) und Überleben (medianes OS: NR vs. 7 Monate) in der Gruppe mit s/r nccRCC im Vergleich zum zielgerichteten TKI-Therapiearm. Dadurch erzielt man eine 75%ige Reduktion des Risikos, am Tumor zu sterben, und eine 60%ige Reduktion des Risikos für ein Therapieversagen.
Triplet-Therapie bei nccRCC?
Der therapeutische Nutzen einer Triplet-Therapie (Cabozantinib+Nivolumab/Ipilimumab) im Vergleich zu Nivolumab/Ipilimumab wurde beim ccRCC bereits in der Phase-III-Studie COSMIC-313 untersucht. Obwohl das PFS in der Triplet-Therapie signifikant länger als bei Nivolumab/Ipilimumab war (HR: 0,73), gab es jedoch auch signifikant mehr dementsprechende Toxizitäten (Grad-3–4-Nebenwirkungen: 79% vs. 56%). Am ASCO-Kongress 2023 wurden nun die ersten Daten derselben Triplet-Therapie beim nccRCC präsentiert (McGregor BA et al.: Abstract No. 4520). Von den 38 nccRCC-Patienten hatten 19 papilläre RCC und 11 chromophobe RCC. Die ORR war 21% mit einem medianen PFS von 8,9 Monaten. Interessanterweise zeigte die Triplet-Kombination ein gutes Ansprechen auch bei den chromophoben RCC. Die Toxizitätsrate war jedoch sehr hoch. Insgesamt entwickelten 73% aller Patienten Grad-3–4-Toxizitäten. Die häufigste davon waren Transaminasenerhöhungen (34%). 29% aller Patienten brauchten zudem Hochdosiskortisontherapien und 13% haben die Therapie wegen Nebenwirkungen abbrechen müssen.
Persönliches Fazit
Trotz Phase-II-Daten präsentiert sich die Kombination aus Lenvatinib/Pembroli-zumab als Gamechanger in der Erstlinienbehandlung des metastasierten nccRCC. Auch Nivolumab/Cabozantinib zeigen eine ähnliche Effizienz, jedoch bei deutlich geringerer Fallzahl an Patienten. Die chromophoben RCC stellen durch ihr Mutationsprofil eine therapeutische Besonderheit und Herausforderung dar. Kleine Fallserien zeigen hierzu ein gutes Ansprechen auf Lenvatinib-basierte Kombinationen (Lenvatinib/Everolimus oder Lenvatinib/Pembrolizumab). Sarkomatoide/rhabdoide ncc-RCC sollten ebenso wie die sarkomatoiden ccRCC mit einer IO-basierten Kombination und nicht mit einer zielgerichteten TKI-basierten Therapie alleine behandelt werden (Abb.1).
Literatur:
● An J et al.: Patient characteristics and survival outcomes of non-metastatic, non-clear cell renal cell carcinoma. Front Oncol 2021; 11: 786307 ● Bedke J et al.: The 2022 updated European Association of Urology Guidelines on the use of adjuvant immune checkpoint inhibitor therapy for renal cell carcinoma. Eur Urol 2023; 83(1): 10-4 ● Choueiri TK et al.; COSMIC-313 investigators: Cabozantinib plus nivolumab and ipilimumab in renal-cell carcinoma. N Engl J Med 2023; 388(19): 1767-78 ● Garje R et al.: Comprehensive review of chromophobe renal cell carcinoma. Crit Rev Oncol Hematol 2021; 160: 103287 ● Hutson TE et al.: A single-arm, multicenter, phase 2 study of lenvatinib plus everolimus in patients with advanced non-clear cell renal cell carcinoma. Eur Urol 2021; 80(2): 162-70 ● Labaki C et al.: Efficacy of first-line (1L) immunotherapy (IO)-based regimens in patients with sarcomatoid and/or rhabdoid (S/R) metastatic non-clear cell renal cell carcinoma (nccRCC): results from the International Metastatic Renal Cell Carcinoma Database Consortium (IMDC). J Clin Oncol 2023; 41(16): Abstract No. 4519 ● Lee CH et al.: First-line lenvatinib + pembrolizumab treatment across non-clear cell renal cell carcinomas: results of the phase 2 KEYNOTE-B61 study. J Clin Oncol 2023; 41(16): Abstract No. 4518 ● Lee CH et al.: Nivolumab plus cabozantinib in patients with non-clear cell renal cell carcinoma: updated results from a phase 2 trial. J Clin Oncol 2023; 41(16): Abstract No. 4537 ● Malouf GG et al.: Non-clear cell renal cell carcinomas: biological insights and therapeutic challenges and opportunities. Clin Adv Hematol Oncol 2017; 15(5): 409-18 ● Marchetti A et al.: The molecular characteristics of non-clear cell renal cell carcinoma: Whatʼs the story morning glory? Int J Mol Sci 2021; 22(12): 6237 ● McGregor BA et al.: Phase II study of cabozantinib (Cabo) with nivolumab (Nivo) and ipilimumab (Ipi) in advanced renal cell carcinoma with variant histologies (RCCvh). J Clin Oncol 2023; 41(16): Abstract No. 4520 ● Pal SK et al.: Cabozantinib in combination with atezolizumab for advanced renal cell carcinoma: results from the COSMIC-021 study. J Clin Oncol 2021; 39(33): 3725-36 ● Tannir NM et al.: Efficacy and safety of nivolumab plus ipilimumab versus sunitinib in first-line treatment of patients with advanced sarcomatoid renal cell carcinoma. Clin Cancer Res 2021; 27(1): 78-86
Das könnte Sie auch interessieren:
Aktuelle Entwicklungen und Erkenntnisse beim Urothelkarzinom
Auf dem diesjährigen Genitourinary Cancers Symposium der American Society of Clinical Oncology (ASCO-GU-Kongress) wurden bedeutende Fortschritte in der Diagnose und Behandlung des ...
Aktuelles aus der 7. Version der S3-Leitlinie: wesentliche Leitlinienänderungen
Im Mai 2024 wurde die Prostatakarzinom-S3-Leitlinie unter der Federführung der Deutschen Gesellschaft für Urologie e.V. (DGU) im Rahmen des Leitlinienprogramms Onkologie in ihrer 7. ...
Neues vom ASCO GU zum Prostatakarzinom
Im Rahmen des ASCO GU 2025 in San Francisco wurden eine Vielfalt von neuen praxisrelevanten Studien zum Prostatakarzinom präsentiert. Mit Spannung wurde unter andem auch auf die finalen ...