SOC in Diagnose und Management
Bericht:
Mag. Dr. Anita Schreiberhuber
Unter dem Vorsitz von Prim. Priv.-Doz. Dr. Birgit Volgger, Bezirkskrankenhaus Lienz, und Univ.-Prof. Dr. Christian Marth, MedUni Innsbruck, fand am 10. Mai 2025 im Rahmen der diesjährigen AGO-Jahrestagung die Session „Therapiesequenz – State of the Art 2024“ statt, in der die aktuellen Therapiestandards bei den gynäkologischen Tumoren Zervix-, Endometrium-, Ovarial- und Mammakarzinom sowie relevante Innovationen präsentiert wurden.
Diagnose und Managementdes Zervixkarzinoms
Trotz Einführung der HPV-Impfung und Implementierung neuer Therapien innerhalb der vergangenen Jahre stellt das Zervixkarzinom (Zervix-CA) immer noch eine Tumorentität dar, die mit einer hohen Morbidität und Mortalität einhergeht.1 Das Zervix-CA tritt mit einem Häufigkeitsgipfel zwischen dem 35. und 40. bzw. dem 60. und 70. Lebensjahr auf. 70% aller Zervix-CA werden durch die HPV-Typen 16 und 18 ausgelöst.2
Im Gegensatz zur Vorgängerversion3 wird in den aktuellen Guidelines der ESGO/ESTRO/ESP (European Society of Gynaecological Oncology/European Society for Radiotherapy and Oncology/European Society of Pathology) das FIGO-Stadium (Fédération Internationale de Gynécologie et d’Obstétrique) nicht mehr nur als rein klinisches Stadium erachtet, sondern auch der histologische Befund und die Bildgebung fließen zusätzlich zu den klinischen Befunden in das Staging ein.1
„Angesichts der Tatsache, dass das Zervixkarzinom ein langsam wachsender Tumor ist und wir über ein gutes Screening verfügen, würde man meinen, dass die meisten Karzinome schon früh diagnostiziert werden“, warf Assoc. Prof. Priv.-Doz. Dr. Gerda Trutnovsky, MedUni Graz, ein.
Die tatsächlichen Zahlen dazu zeigen allerdings das Gegenteil: Bei Erstdiagnose sind nur 50% der CA auf die Zervix beschränkt, ein Drittel der Patient:innen weist bereits regionäre Metastasen in den Lymphknoten (LN) auf und 12% haben bereits primäre Metastasen. Die Rezidivrate liegt zwischen 22% und 31% und auch nach radikaler Hysterektomie (RH) beträgt die 5-Jahres-Gesamtüberlebensrate (OS-Rate) nur 10%.4
Das radiologisch-diagnostische Work-up umfasst zwingend eine Untersuchung des Beckens einschließlich einer Biopsie ± einer Koloskopie sowie eine Bildgebung mittels MRT. Die Bildgebung mittels PET-CT sollte frühzeitig vor Durchführung einer Chemoradiotherapie (CRT) miteinbezogen werden. Ggf. kann das Work-up zusätzlich mit einer Ultraschalluntersuchung durch erfahrene Radiolog:innen ergänzt werden.1
Das therapeutische Management richtet sich nach dem Stadium der Erkrankung: In den Stadien T1a1–T1a2 (Stromainvasion <5mm) sind eine Konisation bzw. einfache Hysterektomie (SH; Resektion von Uterus und Zervix) ausreichend. Bei Tumoren der Stadien T1b1, T1b2 und T2a1 (Stromainvasion >5mm und <4cm) richtet sich die Vorgehensweise nach LN-Negativität bzw. -Positivität. Die daraus resultierenden Behandlungsmodalitäten umfassen CRT, bildgebungsgelenkte RT (IGRT) sowie RH.1
In der Studie SHAPE wurde die SH mit der RH bei Tumoren der Stadien T1a2 und T1b1 verglichen. Dabei war die Rate an pelvinen Rezidiven nach drei Jahren nach SH jener nach RH nicht unterlegen und die Morbidität entsprechend geringer.5 „Die SH sollte bei diesen Stadien jetzt der ‚Standard of Care‘ sein, denn wir wissen, dass die RH mit Langzeitkomplikationen wie Blasenentleerungsstörungen einhergeht, was insbesondere für junge Patient:innen lebenslange Auswirkungen auf die Lebensqualität mit sich bringt“, betonte Trutnovsky.
OS-Verlängerung durch Einführung der IO
Das OS hat sich durch die Einführung der Immuntherapie (IO) zumindest etwas verlängert. In der Studie KEYNOTE-826 zum persistierenden, rezidivierten bzw. metastasierten Zervix-CA mit Zugabe von Pembrolizumab (Pembro) zur Chemotherapie (CTx) vs. CTx lag die 2-Jahres-OS-Rate bei 53% vs. 41,7% (HR: 0,64; p<0,001).6
Ermutigend sind die Ergebnisse zum Immuncheckpoint-Inhibitor (ICI) Cemiplimab, der sich bei Patient:innen mit rezidivierendem CA der Zervix nicht nur hinsichtlich der OS-Verlängerung, sondern auch hinsichtlich der Verträglichkeit der CTx gegenüber als überlegen erwiesen hat: Das mediane OS (mOS) lag bei 12,0 vs. 8,5 Monaten (HR: 0,56; 2-seitiger p-Wert <0,001). Die Rate an Nebenwirkungen (AE) der Grade >3 betrug 45% vs. 53%.7
Beim neu diagnostizierten Zervix-CA hat sich basierend auf den Ergebnissen der Studie KEYNOTE-A18 die Zugabe von Pembro zur CRT als SOC („Standard of Care“) etabliert.8
Auch Antikörper-Wirkstoff-Konjugate (ADC) sind dabei, Einzug in die Therapie des Zervix-CA zu finden. So wurde Tisotumab Vedotin als 2nd- oder 3rd-Line-Therapie im 1:1-Design vs. CTx nach Wahl der Prüfärzt:innenuntersucht und dabei ein signifikanter OS-Benefit zugunsten des ADC im Ausmaß von 11,5 Monaten vs. 9,5 Monate verzeichnet, was einer Reduktion des Risikos zu sterben um 30% gleichkommt (HR: 0,70; 2-seitiger p-Wert=0,004).9 Zurzeit sind viele Studien zu weiteren Substanzen im Gange.
Frühe Impfung ist der beste Schutz
Die Primärprävention für das Zervixkarzinom besteht in der HPV-Impfung.4 Die Sekundärprävention wird in Österreich ab dem 30. Lebensjahr empfohlen, ist aber noch nicht flächendeckend. V.a. gibt es kein organisiertes Screening auf Zervixkarzinome.10
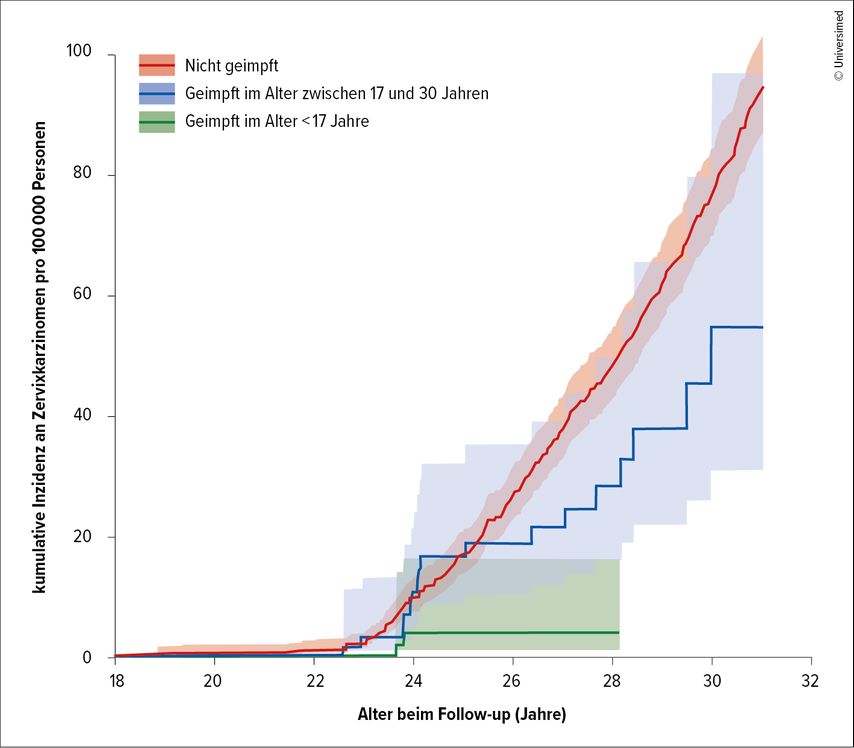
Die Ausweitung der Gratisimpfung bis zum 30. Lebensjahr11 findet Trutnovsky zwar begrüßenswert, dennoch wurde in einer schwedischen Registerstudie ein klarer Zusammenhang zwischen dem Alter bei der Impfung und der Inzidenz von Zervix-CA nachgewiesen: Mädchen und junge Frauen, die mit <17 Jahren vakziniert worden sind, haben den höchsten Benefit durch die Impfung, d.h. diese Gruppe weist das niedrigste Risiko für die Entwicklung eines Zervix-CA auf (Abb. 1).12
Abb. 1: Kumulative Inzidenz an invasiven Zervixkarzinomen gemäß dem HPV-Vakzinierungsstatus (modifiziert nach Lei J et al.)12
„Unser Ziel sollte es sein, das Zervixkarzinom zu verhindern und dadurch vielen Frauen die damit assoziierte Morbidität und Mortalität zu ersparen!“, appellierte Trutnovsky, die Prophylaxe frühzeitig wahrzunehmen.
Endometriumkarzinom
Während Univ.-Prof. Dr. Nicole Concin, MedUni Wien, über die Neuerungen in den ESGO/ESTRO/ESP-Leitlinien13 im adjuvanten Setting referierte, berichtete Univ.-Prof. Dr. Christian Marth, MedUni Innsbruck, über die Therapiestandards beim fortgeschrittenen/metastasierten Endometriumkarzinom (EC).
Neu etabliert hat sich die IO im adjuvanten Setting bei Patient:innen mit Hochrisiko-EC. So wurden in der Studie KEYNOTE-B21 Pembro+Carboplatin/Paclitaxel (Carbo/Pac) vs. Placebo (PBO) +Carbo/Pac für je sechs Zyklen, gefolgt von einer Pembro-Monotherapie bzw. PBO ebenfalls für je sechs Zyklen nach R0-Resektion bei neu diagnostizierten EC-Patient:innen untersucht. Eine RT konnte im Anschluss an die CTx verabreicht werden. Dabei zeigte sich klar, dass die MMR-profiziente (MMRp) Population keinen Benefit durch die IO hatte (HR: 1,11), das MMRd-Setting jedoch in hoch relevantem Ausmaß hinsichtlich des DFS (krankheitsfreies Überleben) profitierte (HR: 0,17).14
Bezüglich des nichtlokoregionären, rezidivierenden EC betonte Marth, dass die Differenzierung zwischen oligometastatischer und disseminierter Erkrankung aufgrund der entsprechenden therapeutischen Konsequenzen entscheidend ist.
„Die oligometastatische Erkrankung ist ganz klar auch eine Domäne der lokalen Therapie und umfasst die Optionen einer Operation, einer Radiatio und ablativer Verfahren. Die anschließende Durchführung einer systemischen Therapie kann erwogen werden“, informierte Marth über die Empfehlungen in den aktualisierten Guidelines. Bei den disseminierten Rezidiven ist meist keine Operation im Sinne einer kompletten makroskopischen Resektion mit akzeptabler Morbidität und Lebensqualität (QoL) realisierbar, vielmehr wird in den meisten Fällen eine palliative systemische Therapie durchgeführt.13
Gegenüber den Vorgänger-Guidelines15 hat sich verändert, dass der MMR-Status bekannt sein muss, da dieser maßgeblich therapieentscheidend ist: Beim MMRd-EC wird SOC-mäßig ein ICI mit Dostarlimab, Durvalumab oder Pembro plus eine CTx mit Carbo+Pac, gefolgt von einer ICI-Erhaltungstherapie verabreicht. Hingegen sollte den Patient:innen mit MMRp Tumoren eine Carbo/Pac-CTx mit anschließender ICI-Erhaltungstherapie (Dostarlimab oder Pembro) angeboten werden bzw. kann der Zusatz eines ICI zur CTx, gefolgt von einer Erhaltungstherapie mit einem ICI oder PARP-I, in Betracht gezogen werden. Im Fall einer Kontraindikation (KI) gegen eine CTx oder bei Nichtdurchführbarkeit einer CTx könnte eine Kombination aus Pembro und Lenvatinib, im Fall einer KI gegen einen ICI und einen PARP-I bei HER2–3+-Tumoren die Gabe von Trastuzumab in Erwägung gezogen werden.13
Onkochirurgie beim OC: Timing matters!
Studien, die das Timing der Onkochirurgie (PDS [primäre „debulking surgery“] vs. IDS [Intervall-DS]) beim neu diagnostizierten Ovarialkarzinom (OC) in Hinsicht auf die Outcomes untersucht haben, weisen Limitationen auf. Zum Beispiel wurde keine Stratifizierung zwischen R0- und R-≥-1-Resektionen vorgenommen.16,17
Assoc. Prof. Priv.-Doz. Dr. Christoph Grimm, MedUni Wien, präsentierte unpublizierte Ergebnisse aus der ESGO-Datenbank zu ca. 8000 OC-Patient:innen. In der Datenbank wurden erstmals strukturiert entsprechende Untersuchungen durchgeführt. Demnach haben Patient:innen mit R0-Resektionen mit einer PDS vs. eine IDS mit 45% vs. 42% am meisten hinsichtlich ihrer Outcomes profitiert.
In einer Subanalyse der Studie PAOLA-1 wurde der Zeitpunkt der Operation im Kontext mit der Erhaltungstherapie (Olaparib+Bevacizumab [BEV] bzw. PBO+BEV) gesetzt: Auch hier war die PDS der IDS hinsichtlich des progressionsfreien Überlebens (PFS) überlegen (Olaparib+BEV: 29,6 vs. 21,4 Monate; HR: 0,52; PBO+BEV: 18,2 vs. 16,7 Monate; HR: 0,66). Den höchsten PFS-Benefit mit einem Zugewinn von 11,4 Monaten haben Patient:innen nach einer PDS und R0-Resektion unter einer Erhaltungstherapie mit Olaparib +BEV vs. PBO+BEV erzielt (39,3 vs. 22,1 Monate; HR: 0,47).18
„Aktuell wird in der Studie TRUST (NCT02828618) der Stellenwert der PDS vs. IDS und einer anschließenden Erhaltungstherapie mit Olaparib plus Bevacizumab untersucht, um methodische Mängel im Kontext mit unserer klinischen Praxis noch besser auszumerzen und noch mehr Daten zum Stellenwert des Timings beim Ovarialkarzinom zu generieren“, berichtete Grimm.
PARP-I: höchster Benefit bei BRCAm OC
Je stärker die Reparaturmechanismen einer Zelle gestört sind, umso effektiver sind PARP-I. Dies zieht sich wie ein roter Faden durch alle Studien – sowohl beim Erstlinien- als auch beim Rezidivsetting.19
In der Studie PAOLA-1 wurde bei Analyse nach Biomarker-Status sogar ein beachtlicher Benefit im 5-Jahres-OS nachgewiesen: Dieser kam bei BRCA-mutierten (BRCAm) Patient:innen unter Olaparib +BEV vs. PBO+BEV einem Zugewinn von 20% gleich (73,2 vs. 53,8%; HR: 0,60) und betrug in der HRD+ Gruppe (exkl. somatischer BRCAm; tBRCAm) immer noch 10% (54,7 vs. 44,2%; HR: 0,71).20
Die IO hingegen hat beim OC bislang keinen „Breakthrough-Status“ erzielt: Lediglich in der dreiarmigen Phase-III-Studie DUO-O zur Primärtherapie bei Patient:innen mit non-tBRCAm-OC konnte unter der Tripeltherapie mit Olaparib+Durvalumab+BEV (Arm 3) vs. Durvalumab + BEV (Arm 2) vs. BEV (Arm 1), jeweils als Zusatz zur CTx, das längste 18-Monats-PFS erzielt werden (71 vs. 56 vs. 55%) erzielt werden. Damit war der primäre Endpunkt, die statistisch signifikante PFS-Verlängerung, im Arm 3 vs. 1 erreicht (HR: 0,63; p<0,0001).
Dieser Benefit ging allerdings mit einem beachtlichen AE-Profil einher: Die AE-Rate der Grade ≥3 im Arm 3 belief sich unter der Erhaltungstherapie (Erhaltungstherapie, jeweils ohne CTx) auf 49% und war damit die höchste von allen Armen, was nicht zuletzt auch zu Therapieabbrüchen im Ausmaß von bis zu 26% führte.21
„Diese Ergebnisse bringen uns nicht wesentlich dabei weiter, den Stellenwert der Immuntherapie beim Ovarialkarzinom gut einschätzen zu können. Was wir aber sehr wohl sehen ist, dass wir durch das Hinzufügen jeder weiteren Substanz ein Mehr an unerwünschten Arzneimittelwirkungen beobachten, was ich als klinisch hoch relevant erachte“, äußerte sich Grimm zu diesen Daten.
HR+ HER2– EBC:N0 Status kann HR bedeuten
Ein Teil der frühen HR+ HER2- Mammakarzinome (EBC) sind Hochrisiko-Tumoren.
„Das Rezidivrisiko ist nicht vom Lymphknoten-Status abhängig, wie wir lange Zeit gedacht haben“, merkte OÄ Dr. Christine Brunner, MedUni Innsbruck, dazu an und argumentierte, dass dementsprechend ein riskoadaptiertes Therapiekonzept erforderlich sei. Diesem Bedarf wird die Einführung von CDK4/6-I ins Hochrisiko-EBC-Setting gerecht. Aus den ähnlich verlaufenden Kurven zum DFS zu Abemaciclib und Ribociclib geht die signifikante Überlegenheit des Zusatzes der CDK4/6-I zur endokrinen Therapie (ET) hervor.22,23
„Die Daten aus der Studie NATALEE zu Ribociclib sind insofern spannend, als hier auch N0-Patient:innen eingeschlossen worden sind. D.h., es gibt Hochrisiko-Patient:innen, die keinen Lymphknoten-Befall aufweisen – diese profitieren eindeutig vom Zusatz des CDK4/6-Inhibitors zur endokrinen Therapie“, unterstrich Brunner den Stellenwert des LN-Status für die Einstufung als Hochrisiko.
HR+ HER2– MBC: neue Substanzen
Während die CDK4/6-I im metastasierten Setting auch in den ESMO-Guidelines schon seit Längerem als fixer SOC in der Erstlinie angeführt sind,24 werden bereits mehrere Substanzen in klinischen Studien untersucht, die bei Rezidivierung/Resistenzentwicklung zum Einsatz kommen können. Ein vielversprechendes Medikament ist der hochselektive α-PI3K-I Inavolisib (Inavo), für den die EMA (Europäische Arzneimittel-Agentur) im Mai 2025 bereits eine „positive Opinion“ abgegeben hat.25
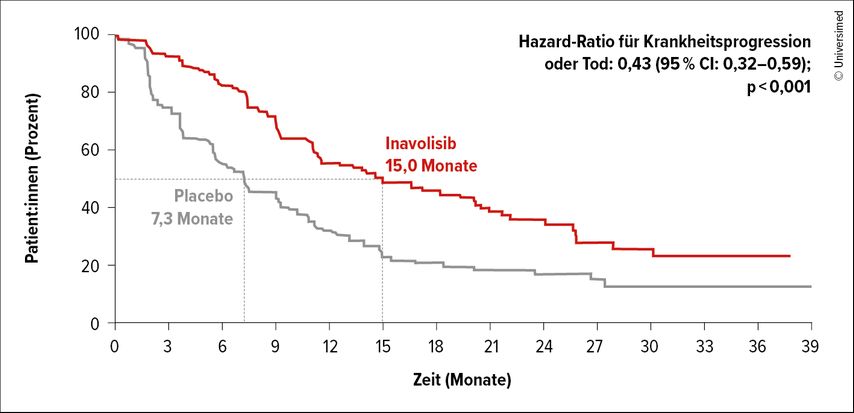
Inavo wurde in der Phase-III-Studie INAVO 120 bei Patient:innen mit MBC bzw. lokal fortgeschrittenem BC (laBC) untersucht, die während oder innerhalb von zwölf Monaten nach Beendigung der ET eine PIK3CAm entwickelt haben (Nachweis mittels ctDNA).
Die Patient:innen wurden zum Zusatz von Inavo zu Palbociclib+Fulvestrant (FUL) bzw. PBO+Palbociclib+FUL randomisiert, als primärer Endpunkt war das PFS definiert. Dieses war nach einem medianen Follow-up von 21 Monaten im Inavo-haltigen Arm vs. Kontrollarm mit 15,0 Monaten vs. 7,3 Monate mehr als verdoppelt, was einer Reduktion des Risikos für eine Progression oder den Tod von 57% gleichkommt (HR: 0,43; p<0,001; Abb. 2).26In den ESMO Living Guidelines, Version 1.2 vom April 2025, werden die PIK3CAm-Testung und ein entsprechender Zusatz von Inavo zur CDK4/6-I und FUL-Therapie bereits standardmäßig empfohlen.27
Zu den weiteren aktivierenden Mutationen, die eine häufige Ursache für die Entwicklung einer Resistenz auf einen Aromatase-I (AI) und CDK4/6-I darstellen, zählen ESR1-Mutationen. Der erste SERD (selektiver Östrogenrezeptor-Degrader), der für progrediente postmenopausale und Patient:innen mit lokaler Progredienz und mit ESR1m MBC als Zusatz zum AI und CDK4/6-I im September 2023 in dieser Indikation zugelassen wurde, ist Elacestrant.28,29
Camizestrant ist ein vielversprechender SERD der nächsten Generation, der in der Phase-III-Studie SERENA-6 (NCT04964934) untersucht wird. Die Patient:innen wurden bei Auftreten einer ESR1m zum Switch des AI auf Camizestrant vs. Fortsetzung des AI randomisiert, jeweils unter Beibehaltung des CDK4i. Als primärer Endpunkt ist das PFS definiert.30 Die Wirksamkeit von Camizestrant konnte bereits in der Phase-II-Studie SERENA-2 bestätigt werden, in der mit dem SERD vs. FUL beinahe eine Verdoppelung des PFS erzielt wurde.31
Quelle:
„Therapiesequenz – State of the Art 2024“ am 10.5.2025 im Rahmen der AGO-Jahrestagung, 7.–10.5.2025, Salzburg
Literatur:
1 Cibula D et al.: ESGO/ESTRO/ESP guidelines for the management of patients with cervical cancer, Update 2023. Int J Gynecol Cancer 2023; 33: 649-66 2 AGO Manual Zervixkarzinom. Online unter https://ago-austria.at/zervixkarzinom-epidemiologie/ . Abgerufen am 25.5.2025 3 Cibula D et al.: The European Society of Gynaecological Oncology/European Society for Radiotherapy and Oncology/European Society of Pathology Guidelines for the management of patients with cervical cancer. Int J Gynecol Cancer 2018; 28: 641-55 4 S3-Leitlinie Zervixkarzinom Version 2.2, Stand: März 2022. Online unter https://www.leitlinienprogramm-onkologie.de/fileadmin/user_upload/Downloads/Leitlinien/Zervixkarzinom/Version_2/LL_Zervixkarzinom_Langversion_2.2.pdf 5 Plante M et al.: Simple versus radical hysterectomy in women with low-risk cervical cancer. N Med 2024; 390(9): 819-29 6 Colombo N et al.: Pembrolizumab for persistent, recurrent, or metastatic cervical cancer. N Engl J Med 2021; 385(20): 1856-67 7 Tewari KS et al.: Survival with cemiplimab in recurrent cervical cancer. N Engl J Med 2022; 386(6): 544-55 8 Lorusso D et al.: Pembrolizumab or placebo with chemoradiotherapy followed by pembrolizumab or placebo for newly diagnosed, high-risk, locally advanced cervical cancer (ENGOT-cx11/GOG-3047/KEYNOTE-A18): a randomised, double-blind, phase 3 clinical trial Lancet 2024; 403(10434): 1341-50 9 Vergote I et al.: Tisotumab vedotin as second- or third-line therapy for recurrent cervical cancer. N Engl J Med 2024; 391(1): 44-55 10 Österreichischer Krebsreport, Stand: 2024. Online unter https://www.krebsreport.at/ 11 Bundesministerium für Arbeit: Soziales, Gesundheit, Pflege und Konsumentenschutz. Online unter https://www.sozialministerium.gv.at/Themen/Gesundheit/Impfen/Humane-Papillomaviren-(HPV).html 12 Lei J et al.: HPV vaccination and the risk of invasive cervical cancer. NEngl J Med 2020; 383(14): 1340-8 13 Concin N et al.: ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma, Update 2025. Lancet Oncol 2025 14 Halaska MJ et al.: Pembrolizumab or placebo plus adjuvant chemotherapy with or without radiotherapy in patients with newly diagnosed, high-risk endometrial cancer: exploratory analysis of disease-specific survival from the phase 3 ENGOT-En11/GOG-3053/KEYNOTE-B21 study. ESGO 2025; Abstr. #637 15 Concin N et al.: ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Int J Gynecol Cancer 2021; 31: 12-39 16 Vergote I et al.: Neoadjuvant chemotherapy or primary surgery in stage IIIC or IV ovarian cancer. N Engl J Med 2010, 363: 943-53 17 Kehoe S et al.: Primary chemotherapy versus primary surgery for newly diagnosed advanced ovarian cancer (CHORUS): an open-label, randomised, controlled, non-inferiority trial. Lancet 2015; 386(9990): 249-57 18 Grimm C et al.: Maintenance olaparib plus bevacizumab (bev) after platinum-based chemotherapy plus bev in patients (pts) with newly diagnosed advanced high-grade ovarian cancer (HGOC): efficacy by timing of surgery and residual tumor status in the phase III PAOLA-1 trial. Gyn Oncol 2020; doi: 10.1016/j.ygyno.2020.06.037 19 Miller RE et al.: ESMO recommendations on predictive biomarker testing for homologous recombination deficiency and PARP inhibitor benefit in ovarian cancer. Ann Oncol 2020; 31(12): 1606-22 20 Ray-Coquard I et al.: Olaparib plus bevacizumab first-line maintenance in ovarian cancer: final overall survival results from the PAOLA-1/ENGOT-ov25 trial. Ann Oncol 2023; 34(8): 681-92 21 Harter P et al.: Durvalumab with paclitaxel/carboplatin (PC) and bevacizumab (bev), followed by maintenance durvalumab, bev, and olaparib in patients (pts) with newly diagnosed advanced ovarian cancer (AOC) without a tumor BRCA1/2 mutation (non-tBRCAm): results from the randomized, placebo (pbo)-controlled phase III DUO-O trial. ASCO 2023; Abstr. #LBA5506 22 Rastogi P et al.: Adjuvant abemaciclib plus endocrine therapy for hormone receptor-positive, human epidermal growth factor receptor 2-negative, high-risk early breast cancer: results from a preplanned monarchE overall survival interim analysis, including 5-year efficacy outcomes. J Clin Oncol 2024; 42(9): 987-93 23 Hortobagyi GN et al.: A phase III trial of adjuvant ribociclib plus endocrine therapy versus endocrine therapy alone in patients with HR-positive/HER2-negative early breast cancer: final invasive disease-free survival results from the NATALEE trial. Ann Oncol 2025; 36(2): 149-57 24 Gennari A et al.: ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer. Ann Oncol 2021; 32(12): 1475-95 25 EMA-Website: https://www.ema.europa.eu/en/medicines/human/EPAR/itovebi . Abgerufen am 25.5.2025 26 Turner N et al.: Inavolisib-based therapy in PIK3CA-mutated advanced breast cancer. N Engl J Med 2024; 391(17): 1584-96 27 ESMO living guidelines metastatic breast cancer. Online unter https://www.esmo.org/guidelines/living-guidelines/esmo-living-guideline-metastatic-breast-cancer/hr-positive-her2-negative-metastatic-breast-cancer/hr-her2-mbc-recurrence-while-on-adjuvant-et-or-12-months-after-the-end-of-adjuvant-et-primary-or-secondary-et-resistance . Abgerufen am 25.5.2025 28 EMA-Website: https://www.ema.europa.eu/en/medicines/human/EPAR/orserdu#authorisation-details. . Abgerufen am 25.5.2025 29 Fachinformation Elacestrant, Stand: März 2025 30Turner N et al.: Design of SERENA-6, a phase III switching trial of camizestrant in ESR1-mutant breast cancer during first-line treatment. Future Oncol 2023; 19(8): 559-73 31 Oliveria M et al.: Camizestrant, a next-generation oral SERD, versus fulvestrant in post-menopausal women with oestrogen receptor-positive, HER2-negative advanced breast cancer (SERENA-2): a multi-dose, open-label, randomised, phase 2 trial. Lancet Oncol 2024; 25: 1424-39
Das könnte Sie auch interessieren:
Hautmanifestationen bei onkologischen Erkrankungen
Krebserkrankungen verschiedener Organsysteme können auch mit Symptomen an der Haut einhergehen, die manchmal bereits als frühe Warnzeichen auftreten. Dazu zählt ausgeprägter Pruritus. ...
Therapie des multiplen Myeloms
Dank vielfältiger neuer Therapieoptionen verbessert sich die Prognose beim multiplen Myelom (MM) stetig. Die bereits verfügbaren Therapien können oft eine langfristige, zum Teil auch ...
Neues zur GVHD-Prophylaxe und Risikobewertung bei Myelofibrose
Die Prophylaxe der Graft-versus-Host-Krankheit (GVHD) bleibt eine zentrale Herausforderung nach allogener Stammzelltransplantation. Auf dem diesjährigen EBMT-Kongress wurden dazu neue ...