Rezidivierende Anastomosenstriktur – was jetzt?
Autoren:
Dr. med. Carolin Siech
Quynh Chi Le
Priv.-Doz. Dr. med. Luis Kluth, F.E.B.U.
Klinik für Urologie Universitätsklinikum Frankfurt
Johann-Wolfgang Goethe Universität Frankfurt am Main, Deutschland
E-Mail: Luis.Kluth@kgu.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die vesikourethrale Anastomosenstriktur ist eine postoperative Herausforderung nach radikaler Prostatektomie. Insbesondere Rezidive erfordern eine patientenorientierte und standardisierte Diagnostik und Therapie. Die individuellen Ziele sollten hierbei ausführlich mit den Patienten diskutiert werden, um (operative) Therapieoptionen und damit den Behandlungserfolg zu optimieren.
Keypoints
-
Eine standardisierte Erhebung der Symptomatik und Lebensqualität sollte bei VUAS im Rahmen der diagnostischen Abklärung mittels „patient-reported outcome measurements“ evaluiert werden.
-
Eine Therapie sollte–wenn möglich – auch bei VUAS-Rezidiven endoskopisch erfolgen.
-
Eine offen-chirurgische oder robotisch assistierte laparoskopische Rekonstruktion kann bei endoskopischem Therapieversagen evaluiert werden.
-
Eine Harninkontinenz tritt nach operativer Reanastomose in 69–100% auf. Mit den Patienten sollte daher ein zweizeitiges Konzept, im Sinne einer konsekutiven Implantation eines artifiziellen Sphinkters, besprochen werden.
-
Die offen-chirurgische perineale Reanastomose sollte nur in ausgewiesenen Zentren erfolgen.
-
Die Vesikostomie mit Mitrofanoff-Stoma oder Harnableitung mittels MAINZ-Pouch stellt die Ultima Ratio in komplexen Fällen dar.
Die vesikourethrale Anastomosenstriktur (VUAS) ist eine herausfordernde Komplikation nach radikaler Prostatektomie. Sie stellt neben der Harninkontinenz und der erektilen Dysfunktion eine mittel- und langfristige behandlungsbedingte unerwünschte Nebenwirkung nach einer radikalen Prostatektomie zur Therapie eines Prostatakarzinoms dar.1,2 VUAS sind zudem mit doppelt so hohen Inkontinenzraten assoziiert.3 In der Regel tritt eine VUAS innerhalb der ersten 6 postoperativen Monate auf.4,5 Die mechanische Striktur bedingt langfristig Blasenentleerungsstörungen mit zunehmendem Restharn und dem damit einhergehenden Risiko für Harnwegsinfektionen und Harnverhalt bis hin zur Schädigung des oberen Harntraktes.
Von der VUAS ist die sogenannte Blasenhalsstenose, die u.a. nach transurethralen desobstruktiven Operationen bei benigner Prostatahyperplasie auftreten kann, abzugrenzen, bei der noch ein Blasenhals vorhanden ist.6 Der Begriff der Harnröhrenstriktur sollte unbedingt vermieden werden. Er ist den Bereichen der Harnröhre vorbehalten, die vom Corpus spongiosum umgeben sind.6Des Weiteren sind radiogen bedingte bulbo-membranöse Harnröhrenstrikturen, die im Rahmen der Radiotherapie des Prostatakarzinoms entstehen, abzugrenzen.7 Die terminologische Differenzierung ist nicht nur aufgrund der unterschiedlichen Ätiologie und anatomischen Situation sinnvoll, sondern auch aufgrund unterschiedlicher Rezidivraten, der Therapieoptionen und der entsprechenden funktionellen Ergebnisse notwendig.8–10
Epidemiologie
In den letzten Jahrzehnten nahm die Prävalenz von VUAS ab. Retrospektive Datenbankanalysen zeigten 2007 eine Prävalenz von 8,4% nach offener retropubischer radikaler Prostatektomie, während in 2021 publizierten Analysen eine VUAS bei lediglich 3,6% der Operierten auftrat.3,4 Zudem wurde gezeigt, dass roboterassistierte laparoskopische radikale Prostatektomien mit geringeren Prävalenzen der VUAS assoziiert sind (0,2–1,6%).11,12 Radikale Salvage-Prostatektomien nach Versagen einer vorausgegangenen Radiotherapie sind hingegen mit einer höheren Prävalenz der VUAS assoziiert (22–40%).5,13,14
Risikofaktoren
Zu den patientenbezogenen Risikofaktoren für VUAS nach radikaler Prostatektomie gehören u.a. Übergewicht, Rauchen, Diabetes mellitus sowie arterieller Hypertonus.15 Ebenso stellen eine vorausgehende transurethrale Desobstruktion (Resektion/Enukleation) der Prostata und ein großes Prostatavolumen Risikofaktoren für die Ausbildung einer VUAS dar.15,16 Ein hoher Blutverlust, eine „auf Spannung“ genähte Anastomose sowie eine Kompression der Anastomose durch ein Hämatom oder eine Lymphozele sind intraoperative Risikofaktoren für eine VUAS.15,17,18 Im Gegensatz dazu ist neben einer roboterassistierten radikalen Prostatektomie auch eine fortlaufende Anastomosennaht mit einer geringeren Prävalenz assoziiert.3,19
Diagnostisches Vorgehen
Das diagnostische Vorgehen ist in Tabelle 1 als Checkliste zusammengefasst. Die Anamnese sollte insbesondere Informationen zur Art, aber auch zur Anzahl der bisherigen Therapien und Voroperationen umfassen.20 Zur Klinik der VUAS zählen obstruktive Symptome wie ein abgeschwächter Harnstrahl, eine verlängerte Miktion sowie Restharn. Nach adjuvanter oder Salvage-Radiatio nach radikaler Prostatektomie treten zudem häufig eine Urge-Symptomatik und Pollakisurie mit oder ohne ungewolltem Urinverlust auf.
Zum Ausschluss eines Prostatakarzinomrezidivs sollte eine laborchemische Bestimmung des PSA-Wertes erfolgen. Zur Objektivierung der obstruktiven Symptomatik bzw. eines Urinverlusts sollten im nächsten Schritt eine Uroflowmetrie und Restharnbestimmung sowie ein Pad-Test durchgeführt werden. Mit einer kombinierten retrograden Urethrografie (RUG) und Miktionsurethrografie (MCU), wie Tabelle 1 zeigt, erfolgen die Verifizierung der VUAS sowie die Evaluation ihrer Länge, der genauen Lokalisation und des Ausmaßes.20,21 Präsphinktäre und bulbäre Harnröhrenstrikturen können hier differenzialdiagnostisch abgegrenzt werden. Neben der radiologischen Untersuchung wird empfohlen eine diagnostische Urethrozystoskopie empfohlen. Diese ermöglicht eine präzise Beurteilung des Sphinkters sowie des Ausmaßes (Durchgängigkeit des Lumens). Sollte dieser nicht passierbar sein, kann zur genaueren Beurteilung der Länge und des Ausmaßes der VUAS auch eine MCU und/oder eine antegrade flexible Urethrozystoskopie (z.B. über den suprapubischen Bauchdeckenkatheter-Kanal) erforderlich sein.
Darüber hinaus sollte mit PROMs („patient-reported outcome measurements“) neben der präoperativen Evaluation des Kontinenzstatus auch die aktuelle Lebensqualität des Patienten als Baseline vor einem operativen Eingriff erfasst werden.
Therapiestrategien
Endoskopische Therapie
Die Therapie einer VUAS beginnt in der Regel endoskopisch (Abb. 2).22 Als mögliche Therapien stehen die Harnröhrenbougierung, die transurethrale Inzision oder Resektion der Anastomosenstriktur zur Auswahl.23 Entscheidend bei der Therapieempfehlung (nach der Société Internationale d’Urologie [SIU] und der International Consultation on Urological Diseases [ICUD]) ist die Kategorisierung der Patienten nach Kontinenzstatus und bei Inkontinenz nach Durchgängigkeit der Harnröhre.24 Bei kontinenten Patienten gilt das endoskopische Vorgehen – insbesondere die Harnröhrenbougierung oder Inzision – als Erstlinientherapie. Bei Beteiligung der membranösen Harnröhre wird die Durchführung einer Harnröhrenbougierung empfohlen.21
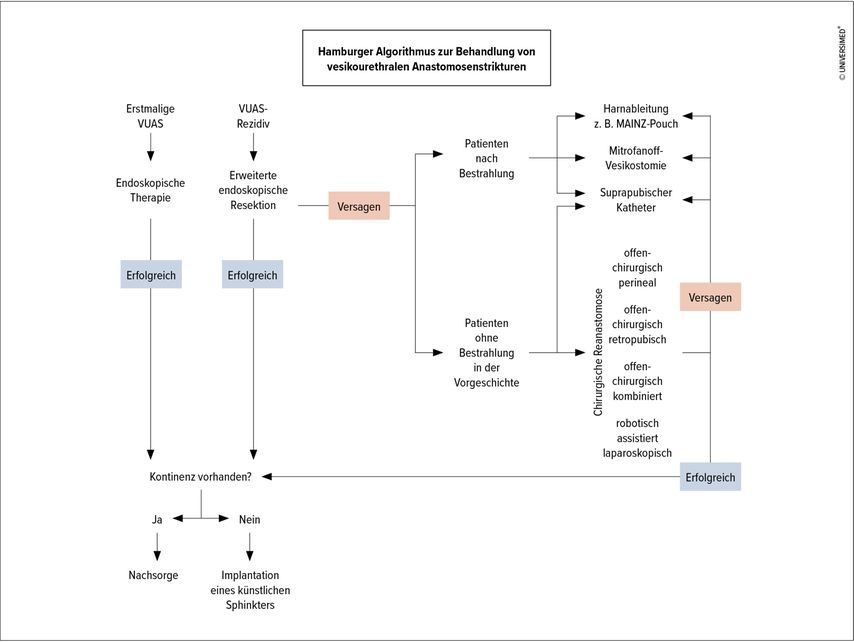
Abb. 2: Hamburger VUAS-Algorithmus zur Behandlung von vesikourethralen Anastomosenstrikturen; modifiziert nach Rosenbaum et al.29
Im Rahmen einer Anastomoseninzision sollte an zwei Stellen inzidiert werden. Da in der Regel nur eine dünne Gewebsschicht zwischen Anastomose und Rektum vorliegt und somit ein erhöhtes Risiko für Rektumverletzungen oder Fistelbildungen besteht, sollte eine Inzision bei „6 Uhr“ vermieden werden.17 Die Erfolgsraten der transurethralen VUAS-Inzision liegen zwischen 37 % und 69%.9,25 Bei einem Rezidiv kann die Erfolgsrate der Inzision durch Injektion von Triamcinolon oder Mitomycin erhöht werden.26,27 Allerdings sollten die Komplikationen und Risiken nicht außer Acht gelassen werden, die von einer möglichen rektourethralen Fistelbildung bis hin zur Blasennekrose mit der Notwendigkeit einer Zystektomie reichen können.28 Dies macht eine wohl überlegte Kosten-Nutzen-Analyse dieser Therapiestrategie nötig.
Bei bereits inkontinenten Patienten wird die endoskopische Therapie nur bei vorhandener Durchgängigkeit der Harnröhre empfohlen.24 Bei vollständiger Harnröhrenobliteration sollten dagegen zunächst die Anlage eines suprapubischen Bauchdeckenkatheters und im Verlauf eine offeneoperative Rekonstruktion erfolgen.24 Die Entscheidung, welche Therapie die passende ist, ist grundsätzlich vom Gesundheitszustand des Patienten abhängig. Ist eine endoskopische oder offen-chirurgische Therapie aufgrund des Alters und/oder Komorbiditäten schwierig umzusetzen, so stellen eine intermittierende Harnröhrenbougierung bzw. eine dauerhafte transurethrale oder suprapubische Katheterableitung ebenfalls valide Therapieoptionen dar. Eine entsprechende Aufklärung des Patienten über die individuellen Ziele und die Lebensqualität sind für den Therapieerfolg entscheidend.
Offen-chirurgische Therapie
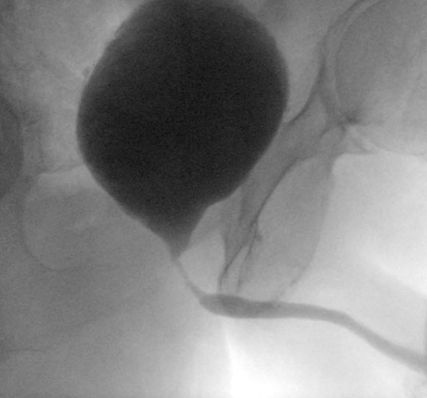
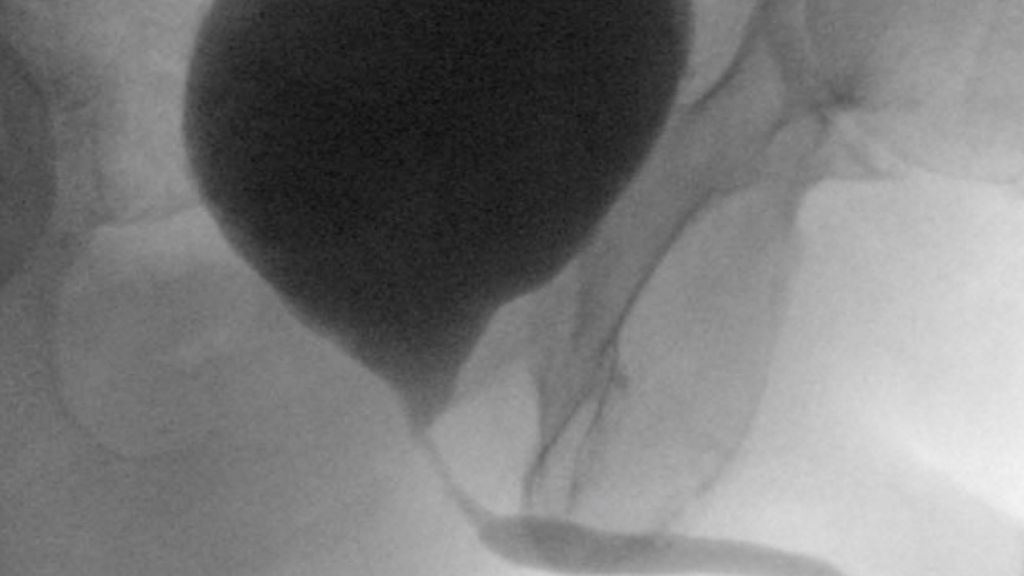
Abb. 3: Röntgenologisch gesicherte (kombinierte retrograde Urethrografie und Miktionszystourethrografie) vesiko-urethrale Anastomosenstrikture
Jede endoskopische Therapie geht mit dem Risiko für ein Rezidiv einher. Nach drei frustranen endoskopischen Versuchen sollte mit dem Patienten eine offen-chirurgische Rekonstruktion diskutiert werden.29 Bei komplexeren Fällen, beispielsweise bei vorbestrahlten Patienten, ist die Überlegung einer Harnableitung ebenfalls möglich.30 Für die offen-chirurgische Rekonstruktion gibt es derzeit drei unterschiedliche Herangehensweisen, die allesamt zufriedenstellende Ergebnisse zeigen: die retropubische, die perineale und die kombiniert retropubisch-perineale Anastomosenrekonstruktion.21,31–35 Mittlerweile werden die o.g. Optionen zudem durch die robotisch assistierte Rekonstruktion ergänzt.36,37
Retropubischer Zugang
Beim retropubischen Zugang (retropubische Reanastomose) wird über eine mediane Bauchlaparotomie die Anastomose freipräpariert und die gesamte Narbe daraufhin reseziert.31 Im Anschluss erfolgt eine Reanastomosierung zwischen Blase und Urethra, ähnlich wie bei einer Prostatektomie. Die Erfolgsraten liegen insgesamt bei 60% und können auf 95% erhöht werden, wenn bei Auftreten eines Rezidivs nach offen-chirurgischer Rekonstruktion eine endoskopische Therapie erfolgt.31
Perinealer Zugang
Beim perinealen Zugang (perineale Reanastomose) erfolgt in extremer Steinschnittlage (nicht alle Patienten sind hierfür geeignet) die Freilegung der Urethra durch einen halbmondförmigen perinealen Schnitt. Zur Protektion des Rektums sollte die Mobilisation unter digitaler rektaler Führung erfolgen. Nach vollständiger Freilegung der Harnröhre und der Anastomose wird die Narbe vom Harnröhrenlumen beginnend bis in das gesunde vitale Gewebe exzidiert. Ein transurethraler Katheter dient zur besseren Orientierung und Identifizierung des distalen Endes der gesunden Urethra. Die anteriore Harnröhre wird nun spatuliert und unter Sicht mit Einzelknopfnähten an die Blase anastomosiert. Wichtig für eine spannungsfreie Anastomose ist daher die vorherige ausreichende Mobilisation der Urethra.
Die Erfolgsraten hierbei liegen bei rund 90%.32,33 Im Vergleich zum retropubischen Zugang ist der perineale Zugang mit weniger abdominellen Komplikationen (z.B. Darmverletzungen) assoziiert, da ein erneuter abdomineller Zugang und damit der Zugang über ein voroperiertes Operationsgebiet vermieden werden.
Nach einer transperinealen Rekonstruktion werden alle Patienten inkontinent, wenn sie dies nicht bereits vorher gewesen sind.33 Bei retropubischen und robotisch assistierten Eingriffen liegt die Kontinenzrate dagegen bei 18–31% der Operierten.31,37 Die perineale Reanastomose ist ein komplexer Eingriff.21 Er gehört in die Hände erfahrener und in entsprechenden Zentren praktizierender Urolog*innen.29
Trotz der Vorteile gegenüber den bisher genannten chirurgischen Therapieoptionen ist die perineale Rekonstruktion bei vorbestrahlten Patienten nicht zu empfehlen.29,38 Vorbestrahltes Gewebe ist brüchiger und vernarbter. Zudem geht eine vorangegangene Bestrahlung mit einer verminderten Wundheilungskapazität einher, was zu Nekrosen des Harnröhrengewebes führen kann. Stattdessen sollte bei ausreichendem Blasenvolumen eine kontinente Vesikostomie nach Mitrofanoff mit oder ohne Blasenaugmentation erwogen werden.29,39 Diese zeigt insgesamt moderate Erfolgsraten. Sind die Patienten zudem inkontinent, sollte neben der Vesikostomie ein perinealer Blasenhalsverschluss durchgeführt werden.39 Bei Vorbestrahlten kann sich dies jedoch als eine Herausforderung darstellen, sodass in diesen komplexeren Fällen eine Harnableitung z.B. mit MAINZ-Pouch diskutiert werden kann.30
Alle Patienten sollten vor einer endoskopischen oder chirurgischen Intervention über das hohe Risiko einer postoperativen Inkontinenz aufgeklärt werden.33 Die Inkontinenz kann – im Sinne eines zweizeitigen Therapiekonzeptes – durch die Implantation eines artifiziellen Sphinkters nach einer Rekonvaleszenz von mindestens 3 bis 6 Monaten und Rezidivfreiheit behandelt werden.35,40
Literatur:
1 Potosky AL et al.: Five-Year Outcomes After Prostatectomy or Radiotherapy for Prostate Cancer: The Prostate Cancer Outcomes Study. JNCI: Journal of the National Cancer Institute. 2004; 96(18): 1358-67 2 Sooriakumaran P al. Erectile Function and Oncologic Outcomes Following Open Retropubic and Robot-assisted Radical Prostatectomy: Results from the LAParoscopic Prostatectomy Robot Open Trial. Eur Urol 2018; 73(4): 618-27 3 Modig KK et al. Vesicourethral Anastomotic Stenosis After Open or Robot-assisted Laparoscopic Retropubic Prostatectomy—Results from the Laparoscopic Prostatectomy Robot Open Trial. European Urology Focus. 2021; 7(2): 317-24 4 Elliott Sean P et al. Incidence of Urethral Stricture After Primary Treatment for Prostate Cancer: Data From CaPSURE. J Urol 2007; 178(2): 529-34 5 Veerman H et al. Surgical and Functional Outcomes of Bladder Neck Incision for Primary Vesico-Urethral Anastomosis Stricture after Robot-assisted Radical Prostatectomy are Influenced by the Presence of Pre- or Postoperative Radiotherapy. Urology. 2022; 166: 216-22 6 Latini JM et al.: SIU/ICUD Consultation on Urethral Strictures: Epidemiology, Etiology, Anatomy, and Nomenclature of Urethral Stenoses, Strictures, and Pelvic Fracture Urethral Disruption Injuries. Urology. 2014; 83(3, Supplement): S1-S7 7 Vetterlein MW et al. Buccal mucosal graft urethroplasty for radiation-induced urethral strictures: an evaluation using the extended Urethral Stricture Surgery Patient-Reported Outcome Measure (USS PROM). World J Urol 2020; 38(11): 2863-72 8 Kranz Z et al.: Differences in Recurrence Rate and De Novo Incontinence after Endoscopic Treatment of Vesicourethral Stenosis and Bladder Neck Stenosis. Front Surg 2017; 4; www.frontiersin.org/articles/10.3389/fsurg.2017.00044 9 Pfalzgraf D et al.: Vesico-urethral anastomotic stenosis following radical prostatectomy: a multi-institutional outcome analysis with a focus on endoscopic approach, surgical sequence, and the impact of radiation therapy. World J Urol 2021; 39(1): 89-95 10 Rosenbaum CM et al. Contemporary Outcomes after Transurethral Procedures for Bladder Neck Contracture Following Endoscopic Treatment of Benign Prostatic Hyperplasia. J Clin Med 2021; 10(13) 11 Carlsson S et al. Surgery-related Complications in 1253 Robot-assisted and 485 Open Retropubic Radical Prostatectomies at the Karolinska University Hospital, Sweden. Urology 2010; 75(5): 1092-7 12 Parihar JS et al.: Bladder neck contracture-incidence and management following contemporary robot assisted radical prostatectomy technique. Prostate Int 2014; 2(1): 12-8 13 Corcoran NM et al.: Salvage prostatectomy post-definitive radiation therapy: The Vancouver experience. Can Urol Assoc J 2013; 7(3-4): 87-92 14 Heidenreich A et al.: Prognostic parameters, complications, and oncologic and functional outcome of salvage radical prostatectomy for locally recurrent prostate cancer after 21st-century radiotherapy. Eur Urol 2010; 57(3): 437-3 15 Borboroglu PG et al. Risk factors for vesicourethral anastomotic stricture after radical prostatectomy. The Chief, Bureau of Medicine and Surgery, Navy Department, Washington, D.C., Clinical Investigation Program, sponsored this report S99-070 as required by NSHSBETHINST 6000.41A. The views expressed in this article are those of the authors and do not reflect the official policy or position of the Department of the Navy, Department of Defense, or the United States Government. Urology. 2000; 56(1): 96-100 16 Moul J et al.: Preoperative and operative factors to predict incontinence, impotence and stricture after radical prostatectomy. Prostate Cancer Prostatic Dis 1998; 1(5): 242-9 17 Browne BM, Vanni AJ. Management of Urethral Stricture and Bladder Neck Contracture Following Primary and Salvage Treatment of Prostate Cancer. Curr Urol Rep 2017; 18(10): 76 18 Metcalfe PD et al.: Bladder outlet obstruction: progression from inflammation to fibrosis. BJU Int 2010; 106(11): 1686-94 19 Albisinni S et al.: The Single-Knot Running Vesicourethral Anastomosis after Minimally Invasive Prostatectomy: Review of the Technique and Its Modifications, Tips, and Pitfalls. Shinohara K, ed. Prostate Cancer. 2016; 2016: 1481727 20 Vetterlein MW et al.: Surgical Reconstruction of Posterior Urethral Complications Following Prostate Cancer Treatments. In: Martins FE, Kulkarni SB, Köhler TS, eds. Textbook of Male Genitourethral Reconstruction. Springer International Publishing; 2020: 303-317 21 Mundy AR, Andrich DE: Posterior urethral complications of the treatment of prostate cancer. BJU Int 2012; 110(3): 304-25 22 Summerton DJ et al.: EAU Guidelines on Iatrogenic Trauma. Eur Urology 2012; 62(4): 628-39 23 Wessells Hunter et al.: Male Urethral Stricture: American Urological Association Guideline. J Urol 2017; 197(1): 182-90 24 Herschorn S et al.: SIU/ICUD Consultation on Urethral Strictures: Posterior Urethral Stenosis After Treatment of Prostate Cancer. Urology 2014; 83(3, Supplement): S59-S70 25 LaBossiere Joseph R et al.: Endoscopic Treatment of Vesicourethral Stenosis after Radical Prostatectomy: Outcomes and Predictors of Success. J Urol 2016; 195(5): 1495-500 26 Eltahawy E et al.: Management of recurrent anastomotic stenosis following radical prostatectomy using holmium laser and steroid injection. BJU Int 2008; 102(7): 796-8 27 Vanni Alex J et al.: Radial Urethrotomy and Intralesional Mitomycin C for the Management of Recurrent Bladder Neck Contractures. J Urol 2011; 186(1): 156-60 28 Redshaw Jeffrey D et al.: Intralesional Injection of Mitomycin C at Transurethral Incision of Bladder Neck Contracture May Offer Limited Benefit: TURNS Study Group. J Urol 2015; 193(2): 587-92 29 Rosenbaum CM et al.: Contemporary Management of Vesico-Urethral Anastomotic Stenosis After Radical Prostatectomy. Frontiers in Surgery. 2020; 7. www.frontiersin.org/articles/10.3389/fsurg.2020.587271 30 Riedmiller H, Kocot A. The devastated bladder outlet: treatment options. Current Opinion in Urology. 2015; 25(4): 352-6 31 Pfalzgraf Daniel et al.: Open Retropubic Reanastomosis for Highly Recurrent and Complex Bladder Neck Stenosis. J Urol 2011; 186(5): 1944-7 32 Reiss CP et al.: Transperineal reanastomosis for the treatment for highly recurrent anastomotic strictures as a last option before urinary diversion. World J Urol 2014; 32(5): 1185-90 33 Schuettfort VM et al.: Transperineal reanastomosis for treatment of highly recurrent anastomotic strictures after radical retropubic prostatectomy: extended follow-up. World J Urol 2017; 35(12): 1885-90 34 Simonato A et al.: Two-Stage Transperineal Management of Posterior Urethral Strictures or Bladder Neck Contractures Associated with Urinary Incontinence after Prostate Surgery and Endoscopic Treatment Failures. Eur Urol 2007; 52(5): 1499-504 35 Theodoros C et al.: Abdomino-perineal repair of recurrent and complex bladder neck-prostatic urethra contractures. Eur Urol 2000 38(6): 734-40; discusssion 740-1 36 Capibaribe DM et al.: Robotic approach to vesicourethral anastomotic stenosis and resection of remaining prostate after radical prostatectomy. 2023; 49(1) 37 Kirshenbaum EJ et al.: Patency and Incontinence Rates After Robotic Bladder Neck Reconstruction for Vesicourethral Anastomotic Stenosis and Recalcitrant Bladder Neck Contractures: The Trauma and Urologic Reconstructive Network of Surgeons Experience. Urology 2018; 118: 227-33 38 Martins FE et al.: Devastated Bladder Outlet in Pelvic Cancer Survivors: Issues on Surgical Reconstruction and Quality of Life. J Clin Med 2021; 10(21): 4920 39 Spahn M et al.: Last Resort in Devastated Bladder Outlet: Bladder Neck Closure and Continent Vesicostomy—Long-term Results and Comparison of Different Techniques. Urology 2010; 75(5): 1185-92 40 Anger JT et al.: Anastomotic contracture and incontinence after radical prostatectomy: a graded approach to management. J Urol 2005; 173(4): 1143-6
Das könnte Sie auch interessieren:
Andrologie und rekonstruktive Urologie: Innovationen und was Sie für die Praxis wissen müssen
Der Kongress der Europäischen Vereinigung für Urologie (EAU) in Madrid bot ein Palette an andrologischen Themen und Highlights in der rekonstruktiven Urologie. Das Spektrum erstreckte ...
Nierenkarzinom: Spannendes, aber kaum Fortschritte im metastasierten Stadium
Wie schon beim ESMO 2024 erkennbar war, hat sich in der Therapie des metastasierten Nierenzellkarzinoms nicht viel geändert. Das spiegelt sich auch in der aktualisierten EAU-Leitlinie ...
Neue Entwicklungen im Management des benignen Prostatasyndroms
Die Therapie des benignen Prostatasyndroms (BPS) entwickelt sich hin zu individuell angepassten Strategien für jeden Patienten. Auf dem EAU-Kongress 2025 wurden Studien vorgestellt, die ...