Resultate der EV-302/Keynote-A39-Studie
Autor:innen:
Dr. Maximilian Pallauf
Dr. Kathrin Olesch
Universitätsklinik für Urologie und Andrologie
Uniklinikum Salzburg
E-Mail: m.pallauf@salk.at
Die Einführung der Kombinationstherapie Enfortumab Vedotin plus Pembrolizumab in der Erstlinie des lokalfortgeschrittenen inoperablen/metastasierten Urothelkarzinoms kommt einem Paradigmenwechsel gleich. Wir fassen die Key Facts zu dieser neuen Kombinationstherapie zusammen und erläutern, wie sich dadurch der Therapiealgorithmus verändert.
„Oldie but goldie“ – die Cisplatin-haltige Kombinationschemotherapie
Über 30 Jahre stand die Cisplatin-haltige Kombinations-Chemotherapie (Cis-KC) unangefochten in der Erstlinie der Therapie des lokal fortgeschrittenen inoperablen/metastasierten Urothelkarzinoms (mUC). Und das trotz überschaubaren Erfolgs; so liegt die 5-Jahres-Gesamtüberlebensrate bei lediglich 10–15%.1 Dennoch konnten sich alternative Therapeutika, so auch die Immuncheckpoint-Inhibitoren (ICI) Pembrolizumab oder Atezolizumab, in der Monotherapie nicht gegen die Cis-KC durchsetzen. Letztere wurden sogar nach direktem Vergleich im Therapie-Algorithmus hinter die Carboplatin-haltige KC, die erste Alternative für Cisplatin-unfitte Patient:innen, gereiht.2,3Lediglich die Einführung der ICI-Erhaltungstherapie mit Avelumab für Patient:innen mit zumindest stabiler Erkrankung nach platinhaltiger KC stellte die einzige relevante Neuerung der Erstlinientherapie des mUC der letzten Jahre dar.4 Mit der Ergebnispräsentation der EV-302/Keynote-A39-Studie am ESMO 2023 hat sich dies nun schlagartig geändert! Die Kombinationstherapie aus Enfortumab Vedotin (EV), einem Antibody Drug Conjugate (ADC), und dem ICI Pembrolizumab stellt nun die neue Erstlinie für das mUC dar. Dafür gab es vom ESMO-Publikum bereits tosenden Beifall.
„A star is born“ – Enfortumab Vedotin plus Pembrolizumab, neue Erstlinientherapie
EV-302/Keynote-A39 ist eine prospektive randomisierte Phase-III-Studie, welche die Kombinationstherapie EV und Pembrolizumab (EV+P) in der Therapie des mUC mit der platinhaltigenKC verglichen hat. EV+P wurde in einem 21-Tages-Zyklus mit einer EV-Dosis von 1,25mg/kg (Maximaldosis 125mg) an Tag 1 und 8 plus Pembrolizumab 200mg an Tag 1 verabreicht. EV wurde dabei unbegrenzt bis zum Progress oder dem Auftreten relevanter Nebenwirkungen, Pembrolizumab für maximal 35 Zyklen verabreicht. Die platinhaltige KC (Cisplatin oder Carboplatin) wurde für maximal 6 Zyklen mit der Möglichkeit eines Switchs auf eine Avelumab-Erhaltungstherapie bei stabiler Erkrankung verabreicht. Insgesamt wurden 886 Patient:innen in die Studie eingeschlossen. Knapp über die Hälfte der Patient:innen (54%) waren Cisplatin-fit. Der Primärtumor war zu 75% im unteren und zu 25% im oberen Harntrakt lokalisiert, 22% der Patient:innen hatten Lebermetastasen.
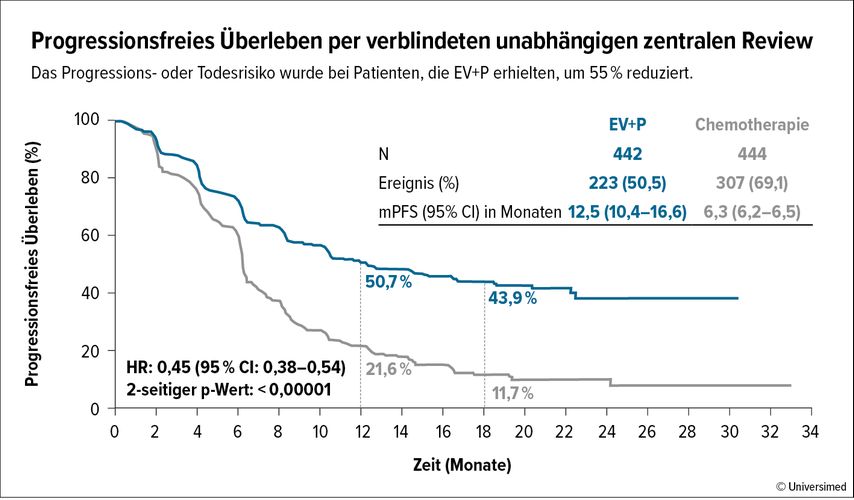
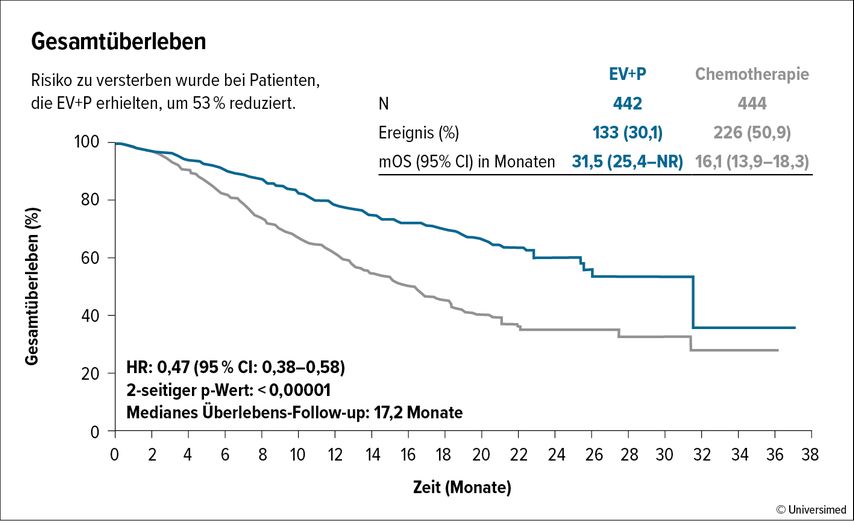
Nach einem medianen Follow-up von 17,2 Monaten wurden die beiden primären Studienendpunkte, progressionsfreies (PFS) und Gesamtüberleben (OS), erreicht. Bis dahin wurden im Median 12 Zyklen (Range 1–46) EV+P und 6 Zyklen der platinhaltigenKC verabreicht. Eine Folgetherapie, dies inkludiert die Avelumab-Erhaltungstherapie, erhielten 31,7% der Patient:innen mit EV+P und 70,5% der Patient:innen mit platinhaltiger KC. Die Raten für das allgemeine Ansprechen (ORR) und die komplette Remission (CR) lagen für EV+P bei 68% und 29,1% und für die platinhaltigeKC bei 44% und 12,5%. Das PFS hat sich unter EV+P signifikant von 6,3 auf 12,5 Monate verlängert (Abb. 1) und das OS war mit einer medianen Überlebenszeit von 31,5 vs. 16,1 Monate unter EV+P fast doppelt so lang wie unter platinhaltigerKC (Abb. 2). Der PFS- und OS-Vorteil für EV+P zeigte sich auch in allen Subgruppenanalysen.
Abb. 1: Kaplan-Meier-Kurven zum progressionsfreien Überleben bei Enfortumab Vedotin + Pembrolizumab (EV+P; blau) sowie zu platinhaltiger Chemotherapie (grau; modifiziert nach Powles T et al. 2023)5
Abb. 2: Kaplan-Meier-Kurve zu Gesamtüberleben für Enfortumab Vedotin + Pembrolizumab (EV+P; blau) und platinhaltige Chemotherapie (grau) (modifiziert nach Powles T et al. 2023)5
Die therapieassoziierten Nebenwirkungen entsprachen den bekannten Sicherheitsprofilen der einzelnen Medikamente. Nebenwirkungen von Grad ≥III traten bei 55,9% der EV+P-Patient:innen und 69,5% der Patient:innen mit platinhaltigerKC auf. Zu den häufigsten Nebenwirkungen von Grad ≥III im EV+P-Arm zählten Hautausschlag (7,7%), Hyperglykämie (5,0%) und Neutropenie (4,8%). 35% im EV+P-Arm und 18,5% der Patient:innen mit platinhaltiger KC brachen die Behandlung aufgrund unerwünschter Nebenwirkungen ab.5
„It’s a kind of magic“ – der Wirkmechanismus von Enfortumab Vedotin plus Pembrolizumab erklärt
Das bemerkenswert gute Ansprechen der Kombinationstherapie von EV+P lässt einen Synergismus im Wirkmechanismus der beiden Medikamente vermuten, dessen Ursache wohl in der multimodalen Wirkung von EV zu finden ist. Denn bedingt durch die Zusammensetzung aus dem Zytotoxin Monomethylauristatin E (MMAE) und einem monoklonalen Antikörper hat EV nicht nur eine zytotoxische, sondern auch eine immunmodulatorische Wirkung. Hierfür bindet der Antikörper von EV an das Oberflächenmolekül Nectin-4, welches auf Tumorzellen des Urothelkarzinoms übermäßig stark exprimiert wird. Dies wiederum führt zu einer Internalisierung des Toxins in die Tumorzelle und zu deren Apoptose. Gleichzeitig unterdrückt die Bindung an Nectin-4 aber auch deren nachfolgende Signalkaskaden, was zu einer gesteigerten Aktivität von T-Zellen und NK-Zellen und einer Unterdrückung von immunsuppressiven Signalwegen und der Behinderung der Immunevasion des Tumors führt. EV ergänzt also durch die Inhibierung von Nectin-4 die immunmodulatorische Wirkung von Pembrolizumab.6
„All that glitter is not gold?“ – die EV-302/Keynote-A39 kritisch hinterfragt
Trotz all des Enthusiasmus für eine neue Erstlinientherapie des mUC, den EV+P sicherlich auch verdient, darf es nicht unterbleiben, die EV-302/Keynote-A39-Studie kritisch zu betrachten. So gilt es, die Ein- und Ausschlusskriterien zu beleuchten. Zwar war ein Einschluss für Patient:innen mit sekundärer Metastasierung nach neo-/adjuvanter Chemotherapie in die Studie möglich, eine vorangegangene ICI-Therapie (auch adjuvant) stellte aber ein Ausschlusskriterium dar. Wenngleich zwischen Chemotherapie und sekundärer Metastasierung ≥12 Monate liegen mussten, so waren es somit Patient:innen, bei denen eine komplette Eradikation der Tumorzellen trotz Chemotherapie nicht erreicht werden konnte.5 Der gleichzeitige Ausschluss einer adjuvanten ICI-Therapie führt in diesem Zusammenhang zu einer gewissen Dysbalance. Wie groß die Gruppe jener Patient:innen mit sekundärer Metastasierung nach perioperativer Chemotherapie war und welchen Einfluss diese auf das unterschiedliche Therapieansprechen hatte, wurde in der vorliegenden Studie nicht untersucht.
Auch muss für EV-302/Keynote-A39 diskutiert werden, ob für den Vergleichsarm zu EV+P der optimale Komparator herangezogen wurde. Oder genauer spezifiziert: Haben genügend Patient:innen im Arm der platinhaltigen KC eine Avelumab-Erhaltungstherapie erhalten? Die Rate für eine Avelumab-Erhaltungstherapie nach platinhaltigenKC lag in dieser Studie bei 30,4%.5 Aus vorangegangenen Studien wissen wir, dass ≥40% der Patient:innen zumindest eine stabile Erkrankung unter einer platinhaltigen KC erreichen und somit für eine Avelumab-Erhaltungstherapie infrage kommen.7,8 Dies ist insbesondere von Bedeutung, da die Avelumab-Erhaltungstherapie nach platinhaltigerKC bereits zu Beginn der EV-302/Keynote-A39-Studie den neuen Therapiestandard darstellte (Start EV-302/Keynote-A39 3/2020, FDA-Zulassung Avelumab-Erhaltungstherapie 6/2020)9 und unter dieser ein beeindruckend langes Gesamtüberleben erreicht werden kann. In der Studie JAVELIN Bladder 100 lag das mediane Gesamtüberleben für Patient:innen mit Avelumab-Erhaltungstherapie nach platinhaltiger KC bei 29,7 Monaten.10 Im Vergleich dazu lag das mediane Gesamtüberleben für Patient:innen mit platinhaltigerKC in der EV-302/Keynote-A39-Studie bei nur 16,1 Monaten.5 Natürlich können die beiden Studien nicht direkt miteinander verglichen werden, beinhaltet JAVELIN Bladder 100 nur jene Patient:innen mit einem Ansprechen auf eine platinhaltige KC. Dennoch unterstreicht dieser Vergleich den Nutzen der Avelumab-Erhaltungstherapie und den kritischen Blick auf den Vergleichsarm der EV-302/Keynote-A39-Studie.
Ein genauer Blick auf die therapieassoziierten Nebenwirkungen lohnt sich auch. Therapieassoziierte Nebenwirkungen vonGrad ≥III traten bei 55,9% der Patient:innen mit EV+P und 69,5% der Patient:innen mit platinhaltigerKC auf. Allerdings führten Nebenwirkungen bei 35% der Patient:innen mit EV+P zu einer Beendigung der Therapie. Unter den Patient:innen mit platinhaltiger KC war dies nur bei 18,5% der Fall. Hier ist anzumerken, dass die platinhaltige KC nur für maximal 6 Zyklen, EV+P allerdings über einen unbestimmt langen Therapiezeitraum verabreicht wurde (s.o.). Die Anzahl an Nebenwirkungen potenziert sich damit auch durch die Therapiedauer. Bereinigt um den Unterschied der Therapiedauer, kam es unter EV+P zu 1,27 Nebenwirkungen von Grad ≥III pro Patientenjahr, unter platinhaltiger KC waren es hingegen 5,36. Die Art der Nebenwirkungen unterschied sich auch deutlich zwischen den beiden Therapien. So muss zukünftig in der Therapie des mUC auf ein anderes Nebenwirkungsprofil achtgegeben werden. Ein besonderes Augenmerk gilt hier der Polyneuropathie (PNP). Wenngleich unter EV+P Hautausschlag die häufigste Nebenwirkung von Grad ≥III darstellte (7,7% der EV+P-Patient:innen), so war die PNP die häufigste Nebenwirkung, die zu einem Therapieende von EV führte (10,7% der EV+P-Patient:innen).5
„Same same, but different“ – wer ist „EV-Pembrolizumab-fit“?
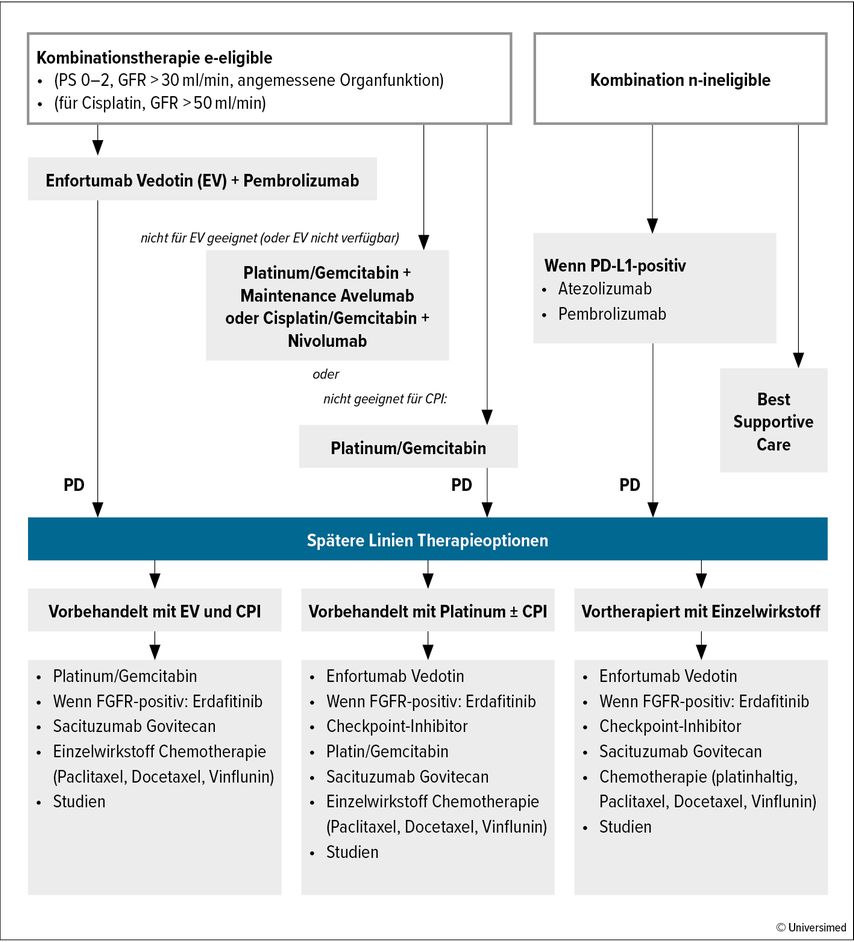
Während die Glasky-Kriterien und die Einteilung in „(Cis-)Platin-fit“ und „-unfit“ den Therapiealgorithmus der letzten 30 Jahre maßgeblich geprägt haben,11 so nötigt EV+P ein neues Vorgehen und neue Kriterien, um die Belastbarkeit für die Systemtherapie abzuschätzen. Die EAU-Leitlinien empfehlen hierfür ein Stufenschema (Abb. 3), gegliedert in „Kombinationstherapie-fit“ und „-unfit“ in Stufe 1, gefolgt von einer Substratifizierung anhand der Kontraindikationen der Medikamente der Kombinationstherapie in Stufe 2.1 So entscheiden ECOG-Status (0–2), Nierenfunktion (eGFR ≥30ml/min) und eine „allgemeine Organ(rest)funktion“ über die Belastbarkeit für eine Kombinationstherapie – die Kriterien entstammen den Einschlusskriterien von EV-302/Keynote-A39 – und die Kontraindikationen für EV (unkontrollierter Diabetes, periphere Neuropathie Grad ≥2, vorbestehende erhebliche Hauterkrankungen) und ICI über eine Kombination von EV+P vs. platinhaltige KC.
Abb. 3: Stufenschema des Therapiealgorithmus für das metastasierte/lokal fortgeschrittene inoperable Urothelkarzinom (modifiziert nach EAU-Leitlinien 2024)1
„Hello,goodbye“ – war es das mit der platinhaltigen Kombinationschemotherapie?
Ganz so schnell müssen wir die platinhaltigeKC aus der Erstlinientherapie des mUC aber nicht verabschieden, bleibt sie dieser doch mit gewissem Vorbehalt noch erhalten. Denn von den überwältigenden Ergebnissen der EV-302/Keynote-A39-Studie überschattet, wurde mit CheckMate901 am ESMO 2023 auch eine zweite positive Phase-III-Studie präsentiert, welche die Kombination aus Nivolumab (ICI) plus Cis-KC mit der Cis-KC in der Erstlinientherapie des mUC verglichen hat. Auch die Kombination aus Nivolumab plus Cis-KC konnte einen statistisch signifikanten Vorteil im PFS (median 7,9 Monate vs. 7,6 Monate; HR: 0,72; 95% CI: 0,59–9,88) und OS (21,7 Monate vs. 18,9 Monate; HR: 0,78; 95% CI: 0,63–0,96) gegenüber der Cis-KC nachweisen und wird daher als erste Alternative zu EV+P empfohlen, sollte eine Kontraindikation für EV bestehen.1,12 Dasselbe gilt auch für die platinhaltigeKC mit Avelumab-Erhaltungstherapie, welche ebenso die erste Alternative zu EV+P darstellt.1 Im Vergleichsarm Cis-KC der CheckMate901 haben nur 14,5% eine ICI-Erhaltungstherapie (Avelumab oder Pembrolizumab) erhalten; ein valider Vergleich zwischen den Cis-KC-ICI-Therapien fehlt daher.12 Zu guter Letzt ist die platinhaltige KC-„Monotherapie“ die Empfehlung zweiter Wahl, sollte (auch) eine Kontraindikation für ICI bestehen.1
Enfortumab Vedotin plus Pembrolizumab – wie geht es jetzt weiter?
Mit jeder beantworteten Frage kommen neue Fragen auf. So ist es auch mit der Therapiesequenzierung. Mit der Einführung von EV+P als neue Erstlinientherapie bleibt die Frage nach der optimalen Therapie in den nachfolgenden Linien vorerst unbeantwortet. Valide Daten bezüglich Therapieansprechen und Verträglichkeit fehlen. Zudem verkomplizieren etwaige vorangegangene perioperative Systemtherapien (neoadjuvant/adjuvant) die Wahl der optimalen Therapiesequenz. In Anbetracht der fehlenden Datenlage empfehlen die EAU-Leitlinien unter anderem die platinhaltigeKC als Zweitlinientherapie nach EV+P.1 Offen bleibt, wieviele der Patient:innen aber dann noch für diese belastbar sind. Denn in EV-302/Keynote-A39 haben knapp 11% der Patient:innen die Therapie mit EV+P aufgrund von PNP abgebrochen;5 eine schwerwiegende PNP ist eine Kontraindikation für Cisplatin.11 Patient:innen mit neoadjuvanter Chemotherapie und sekundärer Metastasierung ≥12 Monate nach Beendigung der Therapie waren in der EV-302/Keynote-A39-Studie eingeschlossen.5 Daher empfehlen die EAU-Leitlinien für diese dieselbe Therapiestrategie wie für therapienaive Patient:innen.1 Anzumerken ist, dass eine vorangegangene ICI-Therapie ein Ausschlusskriterium für die Studie war.5 Ob für Patient:innen mit sekundärer Metastasierung nach adjuvanter ICI-Therapie mit Nivolumab ein selbiges Vorgehen wie für Patient:innen mit perioperativer Chemotherapie zielführend ist, bleibt von den Studiendaten derzeit unbeantwortet.13 Inwiefern die chirurgische Therapie zukünftig auch ein Bestandteil der Therapie des mUC sein könnte, bleibt abzuwarten. Die hohe Rate an Patient:innen mit radiologisch komplettem Ansprechen auf EV+P von 29,1% lässt die Frage offen,5 wie mit Patient:innen mit kompletter Rückbildung der Metastasen umgegangen werden soll. Ob die sekundäre chirurgische Entfernung des Primärtumors einen Benefit wie auch beim Nierenzellkarzinom14 erzielen kann, bleibt abzuwarten.15 Mit der Einführung einer neuen Therapie stellt sich auch immer die Frage nach deren Kosten, Kosten/Nutzen und Finanzierung,insbesondere in Anbetracht der bereits bestehenden hohen Therapiekosten; das Urothelkarzinom ist bereits jetzt eine der teuersten Krebserkrankungen.9 So sind die geschätzten Therapiekosten pro Jahr für EV+P ca. 3x so hoch wie für die platinhaltige KC mit und ca. 5x so hoch wie für die platinhaltige KC ohne Avelumab-Erhaltungstherapie.16 Die höheren Kosten und die (fast) unbegrenzte Therapiedauer werden somit zu einem weiteren raschen Anstieg der Therapiekosten beitragen.
„What’s next?“ – die Therapielandschaft im Wandel
Die ADCs sind in der Urothelkarzinomtherapie auf dem Vormarsch und so werden derzeit zahlreiche ADCs im lokalisierten/nichtmuskelinvasiven, perioperativen und metastasierten Setting getestet; dies auch mit vielversprechenden Ergebnissen.17 Die rezent veröffentlichten negativen Ergebnisse von TROPiCS-04, einer prospektiven Phase-III-Studie, welche das ADC Sacituzumab Govitecan-Hziy (SG) mit der Monochemotherapie in der Therapie des mUC nach platinhaltiger KC und ICI verglichen hat, unterstreichen aber die Notwendigkeit einer intensiven Testung jedes Medikaments in Bezug auf Indikation und Therapiesetting. Denn SG erhielt bereits aufgrund guter Phase-II-Daten eine beschleunigte FDA-Zulassung, die es nun zu hinterfragen gilt.18
Da es sich bei ADCs um zielgerichtete Medikamente handelt, die auf spezifische Oberflächenmoleküle der Tumorzelle gerichtet sind, muss begleitend zur Entwicklung neuer Medikamente an prädiktiven Biomarkern geforscht werden. Auch das Nectin-4-spezifische ADC EV wurde unabhängig von der Nectin-4-Expression der Tumorzellen zugelassen. Neuere Studienergebnisse zeigen aber, dass die Nectin-4-Expression auf Tumorzellen des mUC wohl überschätzt wird und mit Voranschreiten der Erkrankung abnimmt.19 Unterstrichen wird diese Erkenntnis von einer rezenten Studie, welche der Nectin-4-Expression von Metastasen einen höheren prädiktiven Wert als der des Primärtumors nachsagt.20 In Anbetracht der zunehmenden Anzahl an neuen Medikamenten in der Therapie des UC und ihren Einsatzes in den unterschiedlichen Therapiestadien wird zukünftig die Therapiesequenzierung nur mithilfe von Biomarkern erfolgreich sein können.
Literatur:
1 EAU Guidelines on Muscle-invasive and metastatic Bladder Cancer 2024. https://d56bochluxqnz.cloudfront.net/documents/full-guideline/EAU-Guidelines-on-Muscle-Invasive-and-Metastatic-Bladder-Cancer-2024.pdf 2 Powles T et al.: Pembrolizumab alone or combined with chemotherapy versus chemotherapy as first-line therapy for advanced urothelial carcinoma (KEYNOTE-361): a randomised, open-label, phase 3 trial. Lancet Oncol 2021; 22(7): 931-45 3 Galsky MD et al.: Atezolizumab with or without chemotherapy in metastatic urothelial cancer (IMvigor130): a multicentre, randomised, placebo-controlled phase 3 trial. Lancet 2020; 395(10236): 1547-57 4 Grivas P et al.: Patient-reported outcomes from JAVELIN Bladder 100: avelumab first-line maintenance plus best supportive care versus best supportive care alone for advanced urothelial carcinoma. Eur Urol 2023; 83(4): 320-8 5 Powles T et al.: EV-302/KEYNOTE-A39: Open-label, randomized phase III study of enfortumab vedotin in combination with pembrolizumab vs chemotherapy in previously untreated locally advanced or metastatic urothelial carcinoma. Ann Oncol 2023; 34(Suppl 2): S1254-S1335. 10.1016/S0923-7534(23)04149-2 presented at ESMO Congress 2023, Abstr: LBA6 6 Santoni M et al.: Pembrolizumab plus enfortumab vedotin in urothelial cancer. Nat Rev Urol 2024; 21(7): 387-8 7 von der Maase H et al.: Gemcitabine and cisplatin versus methotrexate, vinblastine, doxorubicin, and cisplatin in advanced or metastatic bladder cancer: results of a large, randomized, multinational, multicenter, phase III study. J Clin Oncol 2000; 18(17): 3068-77 8 De Santis M et al.: Randomized phase II/III trial assessing gemcitabine/carboplatin and methotrexate/carboplatin/vinblastine in patients with advanced urothelial cancer „unfit“ for cisplatin-based chemotherapy: phase II--results of EORTC study 30986. J Clin Oncol 2009; 27(33): 5634-9 9 Benjamin DJ et al.: The overall survival benefit in EV-302: Is enfortumab vedotin plus pembrolizumab the new frontline standard of care for metastatic urothelial carcinoma? Eur Urol Oncol 2024; 7(3): 313-5 10 Sridhar SS et al.: Avelumab first-line (1L) maintenance for advanced urothelial carcinoma (UC): long-term follow-up from the JAVELIN Bladder 100 trial in subgroups defined by 1L chemotherapy regimen and analysis of overall survival (OS) from start of 1L chemotherapy. JCO 2023; 41: 508-508 11 Galsky M et al.: Defining “cisplatin ineligible” patients with metastatic bladder cancer. Journal of Clinical Oncology 2011; 29(7_suppl): 238-238 12 Van der Heijden MS et al.; CheckMate 901 Trial Investigators: Nivolumab plus gemcitabine-cisplatin in advanced urothelial carcinoma. N Engl J Med 2023; 389(19): 1778-89 13 Bajorin DF et al.: Adjuvant nivolumab versus placebo in muscle-invasive urothelial carcinoma. N Engl J Med 2021; 384(22): 2102-14, Erratum in: N Engl J Med 2021; 385(9): 864 14 De Bruijn R et al.: Deferred cytoreductive nephrectomy following presurgical vascular endothelial growth factor receptor-targeted therapy in patients with primary metastatic clear cell renal cell carcinoma: apooled analysis of prospective trial data. Eur Urol Oncol 2020; 3(2): 168-73 15 Abufaraj M et al.: The role of surgery in metastatic bladder cancer: asystematic review. Eur Urol 2018; 73(4): 543-57 16 Chiemeka I et al.: Healthcare costs associated with first-line (1L) treatment of patients with locally advanced or metastatic urothelial carcinoma (la/mUC) in the United States (US). JCO Oncol Pract 2023; 19: 11-11 17 Domb C et al.: Systematic review of recent advancements in antibody-drug and bicycle toxin conjugates for the treatment of urothelial cancer. Ther Adv Urol 2024; 16: 17562872241249073 18 https://www.urologytimes.com/view/sacituzumab-govitecan-falls-short-in-phase-3-trial-for-metastatic-urothelial-carcinoma 19 Klümper N, Eckstein M: Biomarkers of response to anti-NECTIN4 antibody-drug conjugate enfortumab vedotin in urothelial cancer. Eur Urol Focus 2024; 10(2): 224-6 20 Büettner T: Membranous NECTIN-4 expression in metastasis versus matched primary tumor more accurately predicts enfortumab vedotin response. EAU Congress 2023. https://www.urotoday.com/conference-highlights/eau-2024/eau-2024-bladder-cancer/151134-eau-2024-membranous-nectin-4-expression-in-metastasis-versus-matched-primary-tumor-more-accurately-predicts-enfortumab-vedotin-response.html
Das könnte Sie auch interessieren:
Der Weg von neoadjuvanter Therapie und radikaler Zystektomie hin zum Blasenerhalt
Beim diesjährigen Post EAU 2025 Meeting in Wien präsentierte Dr. Kilian Gust, FEBU (Medizinische Universität Wien), ein aktuelles Update zur systemischen Therapie des muskelinvasiven ...
Highlights zum Prostatakarzinom vom EAU in Madrid
Zahlreiche im Rahmen des EAU-Kongresses 2025 in Madrid vorgestellte Arbeiten beschäftigten sich mit Diagnostik und Management des Prostatakarzinoms in allen Stadien der Erkrankung. So ...
Neues zur Li-ESWT in der Therapie der ED
Zwei Arbeiten zeigen den praktischen Einsatz der extrakorporalen Stoßwellentherapie mit niedriger Intensität (Li-ESWT; „low-intensity extracorporal shockwave therapy“) in der Therapie ...