Lungenkarzinom: Welche Befunde sind für das Tumorboard notwendig?
Autoren:
Dr. Florian Ponholzer
Assoz.-Prof. Priv.-Doz. Dr. Florian Augustin, MBA
Universitätsklinik für Visceral-, Transplantations- und Thoraxchirurgie
Innsbruck
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In den nächsten Jahren wird es aufgrund einer zunehmenden Implementierung von Lungenkarzinom-Screening-Programmen zu einer steigenden Anzahl an diagnostizierten Frühstadien kommen. Dies wird zu mehr potenziell operablen Patient:innen führen. Um hierbei optimale Therapieentscheidungen treffen zu können und unnötige Verzögerungen zu vermeiden, solltenPatient:innen mit allen notwendigen Befunden im Tumorboard vorgestellt werden.
Keypoints
-
Zur kompletten Abklärung für die Tumorboard-Besprechung werden benötigt: KM-CT Körperstamm (eventuell mit Schädelbildgebung), Histologie (+/– gesicherte mediastinale Lymphknoten), Lungenfunktion, Allgemeinzustand, Anamnese, Labor.
-
Potenziell operable NSCLC-Patient:innen sollten zügig der Operation zugeführt werden.
-
Unnötige Zeitverzögerungen durch fehlende Befunde sollten vermieden werden.
Da mittlerweile nicht „nur noch“ Frühstadien, welche im Steigen begriffen sind, einer kurativen operativen Therapie zugeführt werden, sondern durch neue Immuno-/Chemotherapie-Optionen auch fortgeschrittenere Stadien, bedarf es einer extensiven präoperativen Abklärung der Patient:innen (Tab. 1). Dies ermöglicht eine direkte Diskussion chirurgischer Therapiemodalitäten im Tumorboard.
Notwendige Bildgebung
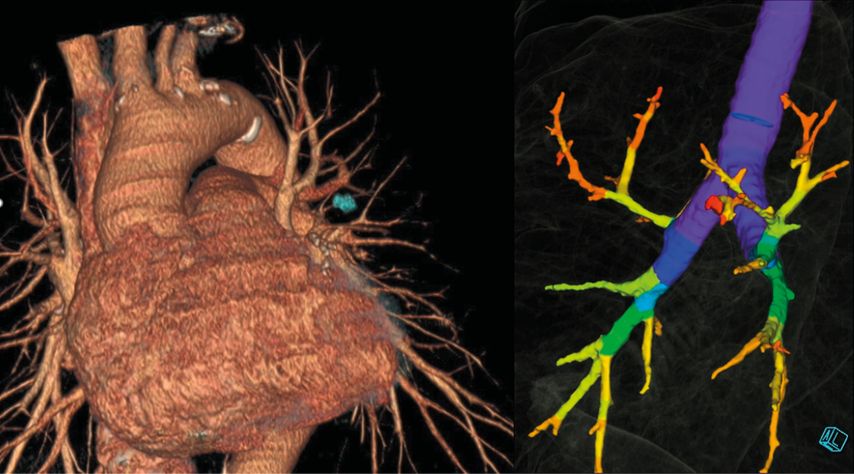
Beginnend mit der Bildgebung sollte zum initialen Staging eine Körperstamm-Computertomografie (CT) in Verbindung mit einer FGD-Positronenemissionstomografie (FGD-PET) durchgeführt werden (LoE I, A; European Society for Medical Oncology/ESMO).1 Dies ermöglicht ein entsprechendes Staging zur Planung weiterer Modalitäten. Die CT sollte, wenn möglich, nicht älter als vier Wochen sein (LoE III, B; ESMO)1, um etwaige intraoperative „Überraschungen“ zu vermeiden. Hierbei sollte auch immer an die Möglichkeit einer Segmentektomie und die damit verbundene OP-Planung gedacht werden. Da von chirurgischer Seite präoperativ die Gefäßanatomie und der Resektionsabstand eingeschätzt werden müssen, erleichtert eine Dünnschicht- bzw. High-Resolution-CT die Planung signifikant. Dies ermöglicht ebenso eine 3D-Rekonstruktion der CT, um die Segmentarterien und -bronchien darzustellen (Abb. 1).2,3
Abb. 1: Präoperative 3D-Rekonstruktion zur Segmentektomie-Planung
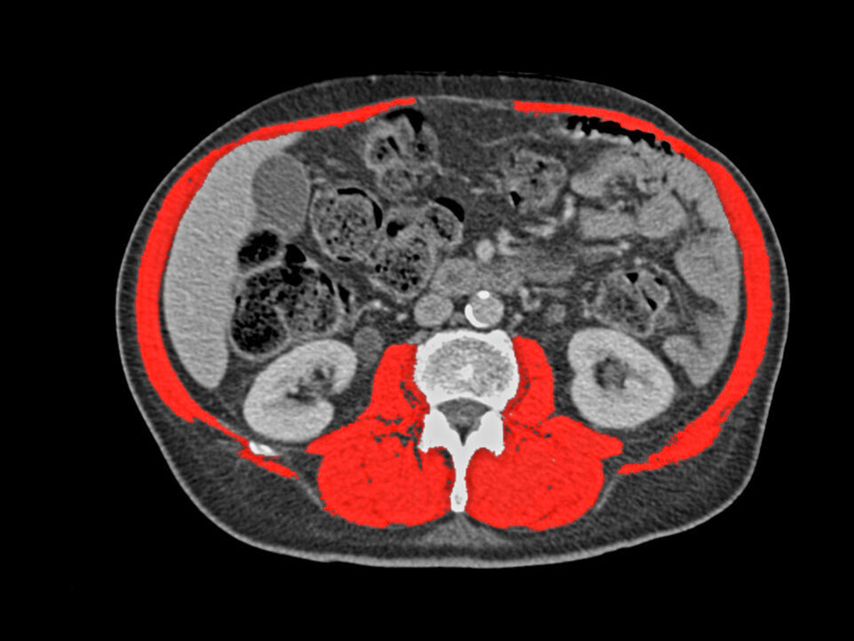
Durch die bei jedem Patient/jeder Patientin durchgeführte CT wird es ermöglicht, den Muskelstatus bzw. eine Sarkopenie zu quantifizieren und zu diagnostizieren (Abb. 2). Eine rezente Analyse aus unserem Zentrum hat gezeigt, dass sarkopene Lungenkarzinompatient:innen eine signifikant geringere postoperative 5-Jahres-Gesamtüberlebensrate aufweisen (64,5 vs. 75,6%).4 Bei Kenntnis dieser Sarkopenie kann eine Prähabilitation gefährdeter Patient:innen eingeleitet werden, um die postoperative Komplikationsrate und damit auch den stationären Aufenthalt zu reduzieren.5 Eine randomisiert-kontrollierte Studie von Liu et al. hat gezeigt, dass bereits zwei Wochen Prähabilitation zu einer signifikanten perioperativen Verbesserung beim 6-Minuten-Gehtest führen.6 Eine Schädelbildgebung ist laut den„Tiroler Arbeitskreis für Onkologie“(TAKO)-Empfehlungen nicht bei allen Lungenkarzinompatient:innen notwendig. Sollte jedoch bei fortgeschrittenen Stadien ein kurativer Ansatz verfolgt werden, so ist eine entsprechende Bildgebung definitiv zu empfehlen. Prinzipiell kann eine CT oder Magnetresonanztomografie (MRT) durchgeführt werden, jedoch sollte laut ESMO bei Verfügbarkeit ein KM-MRT präferiert werden.1 Dies ermöglicht eine sensitivere Diagnostik.
Abb. 2: Sarkopenie-Quantifizierung mithilfe der Staging-CT
Histologischer Befund
Jeder Patient/jede Patientin sollte zur Tumorboardbesprechung ebenso mit einer histologischen Sicherung des Hauptbefundes vorgestellt werden, um eine gezielte Therapie ohne Verzögerungen gewährleisten zu können. Die Sicherung sollte bei Möglichkeit und entsprechender Expertise bevorzugt bronchoskopisch gewonnen werden (LoE I, A; ESMO).1
Dies ermöglicht laut unseren Daten unter anderem eine Reduktion der Dauer von erster suspekter Bildgebung bis zur operativen Sanierung um ca. 11 Tage. Eine zügige Therapieeinleitung ist vor allem bei Patient:innen mit einem ≥cT2 NSCLC von Bedeutung, da eine Zeitdauer von über 60 Tagen ab erster suspekter Bildgebung bei diesem Patient:innenkollektiv zu einer signifikant verringerten 5-Jahres-Gesamtüberlebensrate führt (59,8 vs. 85,4%).7 Alternativ oder bei sehr weit peripher gelegenen Herden stellt die CT-gezielte Punktion des Rundherdes das Mittel der Wahl dar.
Eine histologische Sicherung der mediastinalen Lymphknoten ist in Abhängigkeit vom (PET-)CT- Befund notwendig. Bei bildgebend positiven mediastinalen Lymphknoten sollte eine bronchoskopische Biopsie mittels endobronchialen Ultraschalls (EBUS) erfolgen. Bei negativer Histologie sollte im nächsten Schritt zusätzlich eine videoassistierte Mediastinoskopie (VAM) mit erneuter Gewebeentnahme durchgeführt werden, um falsch negative Befunde auszuschließen. Eine histologische Sicherung von mediastinalen Lymphknoten ist ebenso bei cN1-Situation, zentralen Tumoren oder Tumoren von >3cm Größe indiziert.8
Eine Sicherung der Lymphknotensituation ist auch für die chirurgische Versorgung von immenser Bedeutung, da eine Segmentektomie nur bei nodal-negativen Patient:innen durchgeführt werden sollte. Dies wird an den meisten Abteilungen auch noch intraoperativ mittels Gefrierschnitt-Untersuchung bestätigt.
Wichtige Vorbefunde
Zur Abschätzung des operativen Risikos sollte der/die Vorstellende im Tumorboard gute Kenntnisse über die Komorbiditäten, Voroperationen und den Allgemeinzustand des Patienten/der Patientin haben. Auch wenn grenzwertige Patient:innen kein eingeschränktes 5-Jahres-Überleben aufweisen,9 so ist doch ein gewisses Restrisiko, insbesondere in Hinsicht auf postoperative Komplikationen, gegeben. Eine abteilungsinterne Auswertung unserer thoraxchirurgischen Patient:innen hat gezeigt, dass diejenigen mit niedrigerem„Activity of daily living“(ADL-) bzw. höherem „Clinical frailty scale“(CFS)-Wert signifikant häufiger postoperative Komplikationen erleiden. Beide Werte sind einfach zu erheben und erlauben im Kontext eine weitere Abschätzung des perioperativen Risikos.
NachBesprechung der oben genannten Befunde kann bereits diskutiert werden, ob der Patient/die Patientin von einer chirurgischen Sanierung profitiert. Eine definitive Empfehlung kann jedoch erst abgegeben werden, wenn weitere nicht tumorspezifische Punkte bekannt sind.
Ergebnisse des Lungenfunktionstests
Zum Tumorboard-Meeting sollte bereits eine Lungenfunktionstestung vorliegen, um abschätzen zu können, ob die pulmonale Reserve für eine Resektion des tumortragenden Lungenanteils ausreicht. Patien-t:innen mit einer Einsekundenkapazität (FEV1) von ≥80% und (!) einer Kohlenmonoxid-Diffusionskapazität (DLCO) von ≥80% sowie einer vorhergesagten postoperativen FEV1 (ppoFEV1) von ≥60% und (!) vorhergesagten postoperativen DLCO (ppoDLCO) von ≥60% können bis zur Pneumektomie freigegeben werden. Zeigen sich jedoch eine ppoFEV1 und ppoDLCO von <30% vom Soll, so ist der Patient/die Patientin als inoperabel einzuschätzen.
Spiroergometrie
Bei Patienten:innen, welche sich im Zwischenbereich befinden, muss im nächsten Schritt eine Spiroergometrie durchgeführt werden. Bei einer maximalen Sauerstoffkapazität (VO2max) von >20ml/kg/min ist eine operative Sanierung bis zur Pneumektomie möglich. Bei Werten zwischen 10 und 20ml/kg/min sind Resektionen bis zu einem individuell kalkulierten Ausmaß möglich (z.B. maximal Lobektomie). Zeigt sich die vorhergesagte postoperativeVO2max bei diesen Patient:innen <10ml/kg/min, ist eine Operation aufgrund des erhöhten postoperativen Risikos für Morbidität und Mortalität nicht durchführbar. Bei Durchführung einer Spiroergometrie ist ebenso auf die Komorbiditäten zu achten, da gewisse Erkrankungen/Beschwerden (z.B. schmerzhafte Kniearthrose) zu falsch niedrigen Werten führen können. In diesen Fällen ist eine Spiroergometrie mittels Handkurbel möglich.
Fazit
Zusammenfassend ist festzuhalten, dass der/die im Tumorboard vorstellende Be-handler:in alle oben genannten Befunde parat haben sollte, um unnötige Verzögerungen für den Patient/die Patientin zu vermeiden. Hierzu ist es wichtig zu wissen, welche Abklärungen für die chirurgische Therapieentscheidung notwendig sind, um die Patient:innen einer optimalen und sicheren Versorgung zuführen zu können.
Literatur:
1 Vansteenkiste J et al.: 2nd ESMO Consensus Conference on Lung Cancer: early-stage non-small-cell lung cancer consensus on diagnosis, treatment and follow-up. Ann Oncol 2014; 25(8): 1462-74 2 Brunelli A et al.: European Society of Thoracic Surgeons expert consensus recommendations on technical standards of segmentectomy for primary lung cancer. Eur J Cardiothorac Surg 2023; 63(6): ezad224 3 Liu Y et al.: Three-dimensional reconstruction facilitates thoracoscopic anatomical partial lobectomy by an inexperienced surgeon: a single-institution retrospective review. J Thorac Dis 2021; 13(10): 5986-95 4 Ponholzer F et al.: Sarcopenia and mediastinal adipose tissue as a prognostic marker for short- and long-term outcomes after primary surgical treatment for lung cancer. Cancers 2023; 15(23): 5666 5 Wade-Mcbane K et al.: Prehabilitation in the lung cancer pathway: a scoping review. BMC Cancer 2023; 23(1): 747 6 Liu Z et al.: Two-week multimodal prehabilitation program improves perioperative functional capability in patients undergoing thoracoscopic lobectomy for lung cancer: a randomized controlled trial. Anesth Analg 2020; 131(3): 840-9 7 Ponholzer F et al.: Delay to surgical treatment in lung cancer patients and its impact on survival in a video-assisted thoracoscopic lobectomy cohort. Sci Rep 2021; 11(1): 4914 8 De Leyn P et al.: Preoperative mediastinal lymph node staging for non-small cell lung cancer: 2014 update of the 2007 ESTS guidelines. Transl Lung Cancer Res 2014; 3(4): 225-33 9 Taylor MD et al.: Marginal pulmonary function should not preclude lobectomy in selected patients with non-small cell lung cancer. J Thorac Cardiovasc Surg 2014; 147(2): 738-44; discussion 744-6
Das könnte Sie auch interessieren:
Das Pollenjahr 2025
Die Pollen fliegen wieder – und Allergiker:innen spüren das zurzeit massiv. Wertvolle Informationen zu Pollenflug, Pollenallergien und auch dem Einfluss von Luftschadstoffen auf ...
Gewebeschädigung: Proteasen bahnen der Allergie den Weg
Warum entwickeln manche Menschen Allergien und andere nicht? Viele Aspekte dieser Frage sind nach wie vor ungeklärt. Auf der klinischen Seite zeigt sich zunehmend, dass die Behandlung ...