Individualisierte Therapie nach Krankheitsstadien beim Prostatakarzinom
Bericht:
Reno Barth
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Therapie des Prostatakarzinoms entwickelt sich zunehmend in Richtung Individualisierung. Dies betrifft sowohl die initialen, lokalen Maßnahmen als auch die systemische Therapie der weit fortgeschrittenen Erkrankung. Auf dem Weg zur individuellen Therapie sind freilich noch zahlreiche Forschungsaufgaben zu lösen.
Keypoints
-
Die Strategie der fokalen Therapie ist es, nur den Tumor zu entfernen und die restliche Prostata möglichst unbeschädigt zu hinterlassen.
-
In ausgewählten Fällen kann eine radikale Prostatektomie vermieden oder verzögert werden.
-
Das Risiko für eine erektile Dysfunktion oder Inkontinenz ist geringer.
-
Die fokale Therapie kann wiederholt werden oder es kann eine radikale Operation durchgeführt werden.
-
Die fokale Therapie soll laut EAU-Leitlinien nur im Rahmen von klinischen Studien oder prospektiven Kohorten zum Einsatz kommen.
Das Konzept einer fokalen Therapie des Prostatakarzinoms ist keineswegs neu. Bereits 1937 publizierte eine amerikanische Gruppe eine Fallserie von Patienten, bei denen mit zufriedenstellenden Erfolgen Hemiprostatektomien vorgenommen worden waren. Neue technische Optionen wurden in den 1990er-Jahren mit der Einführung des HIFU („high intensity focused ultrasound“) eröffnet, der die gezielte Ablation von Prostatagewebe ermöglichte und zunächst bei der benignen Prostatahyperplasie zum Einsatz kam. Prof. Dr. Ganesh Palapattu von der University of Michigan weist darauf hin, dass Univ.-Prof. Dr. Michael Marberger und seine Gruppe an der Wiener Universitätsklinik für Urologie maßgeblich an dieser Entwicklung beteiligt waren.
Fokale Therapie derzeit nur in Studien empfohlen
Mittlerweile ist die fokale Therapie auch beim Prostatakarzinoms zumindest in Diskussion. Die Strategie besteht darin, so Palapattu, nur den Tumor zu entfernen und die restliche Prostata möglichst unbeschädigt zu hinterlassen. So kann in ausgewählten Fällen eine radikale Prostatektomie vermieden oder zumindest verzögert werden. Das Risiko von Nebenwirkungen wie erektile Dysfunktion oder Inkontinenz ist geringer. In weiterer Folge kann sowohl die fokale Therapie bei Bedarf wiederholt als auch eine radikale Operation durchgeführt werden. Allerdings soll eine fokale Therapie laut EAU-Leitlinien derzeit nur im Rahmen von klinischen Studien oder prospektiven Kohorten zum Einsatz kommen, wie Palapattu unterstreicht. Auch die NCCN-Empfehlungen raten vom routinemäßigen Einsatz ab und weisen auf fehlende Langzeitdaten hin.
Die offenen Fragen beginnen bei der Patientenselektion, so Palapattu. Der ideale Patient hat eine fokale, aber klinisch signifikante Erkrankung ohne Hochrisikozeichen, die im MR sichtbar und ausreichend weit von vitalen Strukturen entfernt ist. Unklar ist, ob und wie weit genomische Biomarker relevant sind. Kontraindikationen sind unter anderem eine sehr große Prostata, große Kalzifizierungen oder entzündliche Darmerkrankungen. Palapattu betont jedoch, dass eine genaue und evidenzbasierte Definition der für die fokale Therapie geeigneten Patientenpopulation noch aussteht.
Potenziell problematisch ist das präzise Auffinden der Läsionen, die ablatiert werden sollen. In diesem Zusammenhang weist Palapattu auf große Differenzen in der Qualität der Bildgebung in unterschiedlichen Zentren sowie auf unterschiedliche Interpretationen des Materials durch verschiedene befundende Radiologen hin. Doch selbst bei guter Qualität könne MRT „nicht alles sehen“. Detaillierte Informationen liefern schließlich die systematische Biopsie, bei Bedarf auch als Biopsie mithilfe von MRT-Bildgebung und Ultraschalltechnik (Fusionsbiopsie) sowie die Template-Mapping-Biopsie, bei der die Entnahme der Biopsate durch ein Brachytherapiegrid in Abständen von jeweils 5mm erfolgt. Diese werden in einem dreidimensionalen Koordinatensystem ausgewertet, wodurch sich die Lokalisation der Herde genau bestimmen lässt. Die Tatsache, dass es sich in der großen Mehrzahl der Fälle um multifokale Tumoren handelt, erschwert die fokale Therapie ebenso wie histologische und genomische Heterogenität des Tumors. Palapattu: „Wenn wir wüssten, welche Herde die gefährlichen sind, könnten wir die meisten Tumoren fokal behandeln. Aber das wissen wir heute noch nicht. Es ist nicht immer die größte Läsion und es ist auch nicht zwingend die Läsion mit der höchsten histologischen Malignität.“
Fallserien und Kohortenstudien
Die Ablation der Läsionen kann mit einer Vielzahl unterschiedlicher Techniken erfolgen. Palapattu nennt unter anderem den bereits erwähnten HIFU, die Kryo-Ablation, die fokale Laserablation, die fotodynamische Therapie, Gold-Nanopartikel und einige mehr. Palapattu unterstreicht, dass die Technik der Ablation vermutlich wenig Einfluss auf das Outcome hat und es letztlich vor allem darum gehe, den Tumor verlässlich zu treffen. Dabei können unterschiedlich große Areale der Prostata zerstört werden. Dies reicht von rein fokaler Ablation bis hin zur extensiven Ablation (Entfernung der halben Prostata). Wie bei allen onkologischen Eingriffen ist auf die Randzone des Tumors zu achten – auch wenn diese im Rahmen einer Ablation nicht bewertet werden kann, sondern abgeschätzt werden muss.
Nach aktuellem Wissensstand soll die Nachbeobachtung mittels Bildgebung nach sechs und nach 24 Monaten erfolgen, eine Bestimmung des PSA im ersten Jahr nach der Ablation alle drei Monate und in weiterer Folge alle sechs Monate. Eine Biopsie nach sechs Monaten kann zusätzliche Klarheit bringen. Ein funktionelles Assessment wird nach drei und sechs Monaten sowie in weiterer Folge jährlich empfohlen. Hinsichtlich der Komplikationsraten weist Palapattu auf Fallserien hin, die für den fokalen HIFU deutlich weniger Inkontinenz und erektile Dysfunktion zeigen als für radikale Prostatektomie oder Strahlentherapie. Eine prospektive Fallserie von 122 Patienten, deren Intermediate- bis High-Risk-Karzinome mittels Kryoablation behandelt wurden, zeigt nach drei Jahren ein FFS (Failure-Free Survival) jenseits der 90%. In der Subgruppe der Patienten mit Hochrisikotumoren lag das FFS noch bei 84,7%. Inkontinenz wurde bei keinem Patienten beobachtet, 16,1% gaben erektile Dysfunktion an.1
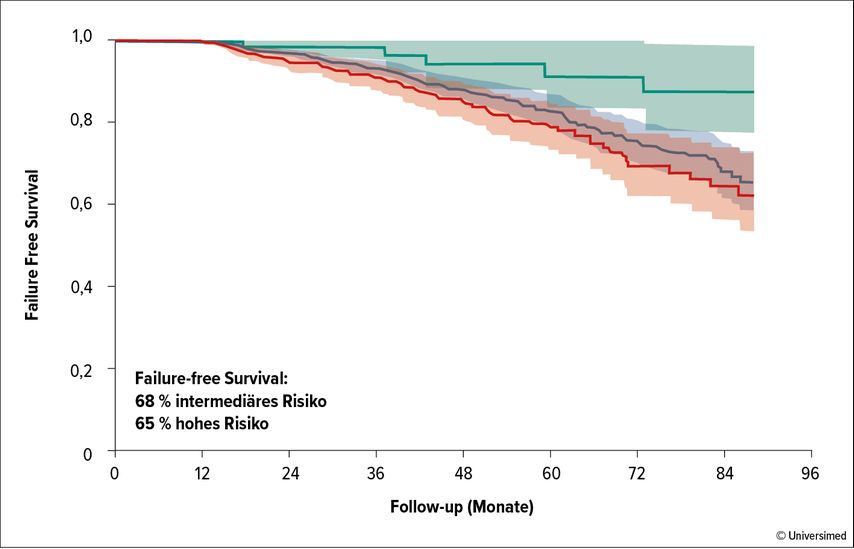
Daten über die bislang längsten Beobachtungszeiten liefert eine Analyse von mehr als 1300 Patienten, die an 13 britischen Zentren mit HIFU behandelt worden waren. In dieser Kohorte lag das FFS nach sieben Jahren bei 69%, wiederholte fokale Therapien waren bei 252 Patienten erforderlich, in 92 Fällen war schließlich eine RPE unvermeidbar. Die Risikoeinstufung des Tumors hatte wenig Einfluss auf das Outcome. Über 84 Monate war die Prognose von Patienten mit Intermediate- oder High-Risk-Tumoren nur minimal schlechter als in der gesamten Kohorte (Abb.1).2 Eine Metastasierung trat bei drei Patienten ein, bei einem Patienten führte sie auch zum Tode. Für die Zukunft erwartet Palapattu Verbesserungen im Bereich Imaging, bessere Möglichkeiten, relevante Läsionen zu identifizieren, sowie evidenzbasierte Empfehlungen betreffend die Nachsorge.
Abb. 1: Failure-free Survival nach Fokaltherapie mit HIFU bei 1379 Männern mit nichtmetastasiertem Prostatakrebs: eine 15-jährige Erfahrung mehrerer Institute
Immer mehr Optionen in der kastrationsresistenten Situation
Nicht nur in der Frühphase der Erkrankung, sondern auch in der metastasierten Situation entwickelt sich das Management des Prostatakarzinoms in Richtung einer personalisierten Therapie. War im Jahr 2004 für Patienten mit metastasiertem, kastrationsresistentem Prostatakarzinom Docetaxel noch die einzige Option, so standen Ende 2022 darüber hinaus noch die ARTA (Androgen Receptor-Targeted Agents), Ra-223 sowie für Patienten mit BRCA-1- oder BRCA-2-Mutation der PARP-1-Inhibitor Olaparib zur Verfügung. In dieser neuen Situation ergibt sich als neue Herausforderung die Wahl der geeigneten Therapie für den individuellen Patienten. Die Situation wird noch dadurch erschwert, dass gegen alle eingesetzten Substanzen auch Resistenzen auftreten, die nicht beherrschbar sind und die Therapieergebnisse massiv verschlechtern können. Diese Resistenzen können bereits zu Therapiebeginn (primär) vorhanden sein oder unter Therapie (sekundär) auftreten. Daher sei es von hoher Wichtigkeit, diese Resistenzen voraussagen und die Verschreibungen entsprechend anpassen zu können, so Prof. Dr. Péter Nyirády von der Budapester Semmelweiss-Universität. Hier bestehen Bedarf an verstärkter Grundlagenforschung und Potenzial für die rasche Translation der Ergebnisse in die Klinik.
Auf der Suche nach Biomarkern zur Prädiktion von Resistenzen
Als Beispiel für ein solches Vorgehen nennt Nyirády das Adhäsionsmolekül CD44, das zunächst in Prostatakarzinom-Zelllinien als Marker für Resistenz gegenüber Docetaxel identifiziert wurde. In weiterer Folge zeigte sich, dass hohe CD44-Spiegel im Serum von Docetaxel-behandelten Patienten mit geringem Gesamtüberleben assoziiert waren. In einem nächsten Schritt gelang es – dies allerdings bislang nur in der Zellkultur – durch Ausschaltung von CD44 auch die Resistenz gegenüber Docetaxel auszuschalten.3 In Zelllinien mit Resistenz gegenüber Enzalutamid wurden 278 überexprimierte Proteine gefunden.4 Nach dem gleichen Verfahren wurden auch Proteine gesucht, die mit Resistenz gegenüber Abirateron assoziiert sind. Eine entsprechende Arbeit der gleichen Gruppe befindet sich aktuell im Publikationsprozess. Insgesamt wurden in vitro bislang mehr als 500 Proteine gefunden, die bei Resistenzen gegen Docetaxel, Abirateron oder Enzalutamid hochreguliert sind, so Nyirády. Diese Ergebnisse gelte es nun in klinische Daten umzusetzen.
Quelle:
„Focal therapy for prostate cancer: What is old is new again“, Vortrag von Dr. Ganesh S. Palapattu im Rahmen des 8. Michael J. Marberger Annual Meeting “Frontiers in Urology” am 16. Dezember in Wien
Literatur:
1 Shah TT et al.: Eur Urol 2019; 76(1): 98-105 2 Reddy D et al.: Eur Urol 2022; 81(4): 407-13 3 Keresztes D et al.: J Cell Mol Med 2022; 26(4): 1332-7 4 Csizmarik A et al.: Int J Cancer 2022; 151(8): 1405-19
Das könnte Sie auch interessieren:
Aktuelle Entwicklungen und Erkenntnisse beim Urothelkarzinom
Auf dem diesjährigen Genitourinary Cancers Symposium der American Society of Clinical Oncology (ASCO-GU-Kongress) wurden bedeutende Fortschritte in der Diagnose und Behandlung des ...
Aktuelles aus der 7. Version der S3-Leitlinie: wesentliche Leitlinienänderungen
Im Mai 2024 wurde die Prostatakarzinom-S3-Leitlinie unter der Federführung der Deutschen Gesellschaft für Urologie e.V. (DGU) im Rahmen des Leitlinienprogramms Onkologie in ihrer 7. ...
Neues vom ASCO GU zum Prostatakarzinom
Im Rahmen des ASCO GU 2025 in San Francisco wurden eine Vielfalt von neuen praxisrelevanten Studien zum Prostatakarzinom präsentiert. Mit Spannung wurde unter andem auch auf die finalen ...