Epidemiologie und Risikofaktoren des Nierenzellkarzinoms
Autor:innen:
Prof. Dr. Sabine D. Brookman-May1
Prof. Dr. Matthias May2
1 Klinik für Urologie, Ludwig-Maximilians-Universität München
Fachärztin für Urologie, medikamentöse Tumortherapie, Sportmedizin
Vice President, R&D Oncology, Johnsons and Johnson, Spring House, PA; USA
2 Klinik für Urologie,
Klinikum St. Elisabeth Straubing
Facharzt für Urologie, medikamentöse Tumortherapie
E-Mail: sabine.brookman-may@email.de
Die Inzidenz des Nierenzellkarzinoms hat sich in den letzten Jahrzehnten nahezu verdoppelt. Einerseits wird es aufgrund besserer Diagnostik häufiger entdeckt, andererseits kam es zu einer tatsächlichen Inzidenzsteigerung aufgrund verschiedener Risikofaktoren. Es konnten modifizierbare Risikofaktoren gefunden werden, zu anderen Risikofaktoren ist die Datenlage jedoch teilweise widersprüchlich. Ebenso gibt es Daten zu Mechanismen mit einem möglichen protektiven Einfluss, die aber weiter evaluiert werden müssen.
Keypoints
-
Die Inzidenz des Nierenzellkarzinoms steigt, die Mortalitätsraten sind jedoch nahezu gleichgeblieben.
-
Genetische und beeinflussbare Faktoren spielen entscheidende Rollen bei der Entwicklung des Nierenzellkarzinoms.
-
Die breiteste Evidenz hinsichtlich beeinflussbarer Risikoaktoren existiert für Hypertonie, Rauchen und Übergewicht.
-
Weniger Evidenz gibt es für Dyslipidämie, Diabetes und metabolischem Syndrom.
-
Insbesondere Reduktion von Übergewicht, Verzicht auf Rauchen und ausreichende körperliche Aktivität sind modfizierbare protektive Risikofaktoren.
Epidemiologie
Nierenkrebs ist eine heterogene Gruppe von Tumorerkrankungen; das Nierenzellkarzinom („renal cell carcinoma“/RCC) macht >90% aller soliden Nierentumoren aus. Verschiedene histologische RCC-Subtypen wurden beschrieben, die unterschiedliche genetische, epigenetische und molekulare Eigenschaften aufweisen und sich durch unterschiedliche klinische Verläufe auszeichnen.1 2016 veröffentlichte die WHO die neueste histologische Klassifikation für das RCC und fügte weitere histologische Subtypen hinzu.2 Die häufigsten Subtypen bleiben das klarzellige RCC (ccRCC; 60%), gefolgt vom papillären (15%) und chromophoben RCC (10%).3
Laut Global Cancer Observatory (GLOBOCAN) wurde in den letzten 20 Jahren ein jährlicher Anstieg der Inzidenz des RCC um 2% beobachtet, mit mehr als 400000 Neudiagnosen pro Jahr und 179368 Todesfällen weltweit im Jahr 2020.4 Im Jahr 2020 wurden in Europa 138611 Fälle von RCC und 54054 Todesfälle gemeldet, was 30% der weltweiten RCC-Todesfälle ausmacht.3 Zwischen 1990 und 2013 zeigte sich eine Verdoppelung der RCC-Inzidenz (23% Anstieg der altersstandardisierten Inzidenzrate pro 100000 Menschen) bei gleichzeitig stabiler altersspezifischer Sterberate für beide Geschlechter.5 Männer sind nahezu doppelt so oft von der Diagnose RCC betroffen wie Frauen, die Diagnosestellung erfolgt am häufigsten zwischen dem 60. und 70. Lebensjahr.6
In Europa wurde während der frühen 2000er-Jahre (bis zum Jahr 2007 und anschließend gleichbleibend) eine Verschiebung der RCC-Diagnosen hin zu früheren Stadien festgestellt, was möglicherweise infolge besserer Therapierbarkeit früherer Stadien und verbesserter Therapieoptionen in einer scheinbaren Reduktion der Mortalitätsraten resultierte.7,8 Zu berücksichtigen ist jedoch, dass die Kombination aus steigender Inzidenz und stabiler Mortalität auch auf eine Überdiagnostik und mögliche Überbehandlung hindeutet.
Risikofaktoren
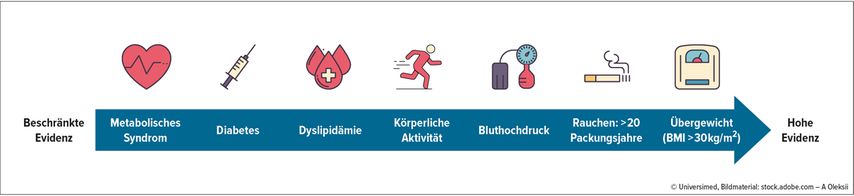
Neben nicht oder nur gering beeinflussbaren Risikofaktoren (u.a. genetische Disposition) konnten auch beeinflussbare Risikofaktoren identifiziert werden,9–11 darunter Diabetes, Rauchen und Adipositas (Abb. 1). Es wird vermutet, dass genetische Disposition und Interaktion mit der Exposition gegenüber Umweltfaktoren das RCC-Risiko zusätzlich beeinflussen können, wobei diesbezüglich keine abschließende Evidenz vorliegt.
Abb. 1: Risikofaktoren beim Nierenzellkarzinom – dargestellt nach dem Evidenzgrad gemäß der aktuellen Datenlage
Rauchen
Rauchen ist ein etablierter Risikofaktor für das Auftreten des RCC, wie Metaanalysen, Fallkontrollstudien und prospektiven Datensammlungen zeigen. Es besteht jedoch eine erhebliche Variabilität in der Risikoeinschätzung basierend auf der Dauer und Intensität des Rauchens sowie des Zeitraums nach Beendigung des Rauchens, was die Notwendigkeit einer standardisierten Erfassung raucherbedingter Risikofaktoren für künftige Studien untermauert. In den meisten Studien haben Raucher ein circa doppelt so hohes Risiko, an einem RCC zu erkranken, wobei die Inzidenz bei mehr als 22 Packyears (PY) exponentiell zuzunehmen scheint.
Tabakrauch enthält eine Mischung von Karzinogenen, die mit der Ätiologie des RCC in Verbindung gebracht werden. Verschiedene Studien haben Daten zum Zusammenhang zwischen Rauchen und RCC generiert. So wurde in einer Studie aus dem UK mit über 200000 Teilnehmern (und über einen Zeitraum von 30 Jahren) ein Zusammenhang zwischen Rauchen und RCC bei Männern und Frauen festgestellt (Hazard-Ratio [HR]: 1,26; 95% CI: 1,00–1,58; p=0,048).12
In einer anderen Studie (Vitamin D and Omega-3 Trial/VITAL), in der die RCC-Inzidenz bei Personen mit >37,5 PY im Vergleich zu Nichtrauchern (176 vs. 88 Patienten) untersucht wurde, zeigte sich eine von anderen Faktoren unabhängige Assoziation zwischen dem Rauchen und dem RCC (HR: 1,58; 95% CI: 1,09–2,29),13 was in anderen Studien jedoch nicht bestätigt wurde.14,15
In der „Prostate, Lung, Colorectal and Ovarian Cancer“(PLCO)-Studie, einer multizentrischen, randomisierten kontrollierten Studie mit über 154000 Teilnehmern, wurde bestätigt, dass die Intensität des Rauchens mit einem erhöhten Risiko für die Entwicklung von höhergradigem RCC assoziiert ist. Konkret zeigte sich eine statistisch signifikante Zunahme (p<0,0001) der Inzidenz bei Personen, die >50PY rauchten. Zudem wurde nach mindestens 10 Jahren seit Beendigung des Rauchens eine signifikante Abnahme (31%ige Verringerung der Inzidenz) im Vergleich zu aktuellen Rauchern beobachtet. Diese Ergebnisse betonen die potenziell langfristigen Vorteile einer Beendigung des Rauchens.16
In einer Analyse des Australian Cancer Council wurde eine 1,4-fache Zunahme der Inzidenz des RCC bei Rauchern im Vergleich zu Nichtrauchern berichtet, zudem wurde eine weitere 50%ige Zunahme des Risikos (1,8-fache Zunahme) bei ≥20PY beobachtet (vs. <20PY).17,18 Ergebnisse aus dieser Studie zeigen, dass Rauchen ein erheblicher Risikofaktor für das RCC ist und eine höhere Inzidenz des RCC bei aktuellen Rauchern im Vergleich zu ehemaligen Rauchern beobachtet wird.
Adipositas
Adipositas ist ein bekannter Risikofaktor für das RCC; eine direkte Korrelation mit einer erhöhten RCC-Inzidenz wurde in mehreren Studien gezeigt mit Steigerungen des RCC-Risikos um den Faktor 1,32 bis 1,76.19–21Das Risiko erhöhte sich dabei um 4–6% pro BMI-Einheit (1kg/m2).20,22 Auch frühe Adipositas im Erwachsenenalter und insbesondere abdominale Fettleibigkeit (bei Männern häufiger als bei Frauen) wurden als Risikofaktoren identifiziert.21,23 Bei Männern wurde eine 1,5-fache Zunahme des RCC-Risikos pro 5kg/m2 beobachtet, während bei Frauen teils kein direkter Zusammenhang mit dem Körpegewicht belegt wurde.24,25 Die Verteilung von Fettgewebe unterscheidet sich bei Männern und Frauen aufgrund hormoneller und genetischer Unterschiede, was letztlich auf unterschiedliche hormonelle Einflüsse von Östrogen und Testosteron auf den Fettzellstoffwechsel zurückgeführt werden kann.26 Das Fettgewebe ist eines der größten endokrinen Organe des Körpers und produziert über 50 verschiedene Hormone, was bei übergewichtigen Menschen zu tiefgreifenden endokrinen Veränderungen und chronischer Inflammation,mit subsequenter Ausschüttung verschiedener Zytokine und Adipokine wie wie TNF-α und IL-6 führt, welche u.a. das Wachstum und Überleben von Tumorzellen fördern können. Darüber hinaus kann die erhöhte Produktion von Insulin und „insulin-like growth factor“ (IGF) ebenfalls das Tumorwachstum stimulieren.26,27
Konträr zum negativen Einfluss von Übergewicht auf die Entwicklung eines RCC wurde in mehreren Studien auch ein günstigerer klinischer Verlauf bei Patienten mit erhöhtem BMI berichtet.28,29 Dieser vermeintlich schützende Effekt von Adipositas wird als „obesity paradox“ bezeichnet. Gemäß diesem Paradoxon geht Adipositas zwar mit einem erhöhten Risiko für die Entwicklung eines RCC einher, nach der Diagnose hätten übergewichtige Patienten aber bessere Überlebensraten. Als ursächlich diskutiert wurden Unterschiede in der Tumorbiologie, Immunreaktionen und differentes Behandlungsansprechen. Realistischer ist allerdings, dass das vermeintlich bessere Outcome adipöser Patienten in Beobachtungsstudien eher auf fehlende Adjustierung relevanter Risikofaktoren (z.B. Gewichtsverlust, Tumorkachexie) und weitere unbekannte Confounder zurückzuführen ist. In einer Studie wurde z.B. gezeigt, dass nach multivariabler Adjustierung an den Faktor Gewichtsverlust (>10% nach Diagnosestellung im Vergleich zum Ausgangsgewicht) Übergewicht keinen signifikant positiven Effekt auf die onkologische Prognose hatte. Der vermeintlich protektive Effekt weißt vielmehr auf den negativen Einfluss einer Tumorkachexie als einen positiven Einfluss von Adipositas hin.30 Unabhängig davon ist das Aufrechterhalten eines gesunden Gewichts zur Gesundheitsförderung und Krankheitsprävention generell empfohlen.31
Hypertonie
Hypertonie betrifft Millionen Menschen weltweit und ist ein wichtiger Risikofaktor verschiedener Erkrankungen. In mehreren Studien wurde eine positive Korrelation zwischen Hypertonien und RCC gezeigt.
Wissenschaftliche Belege basieren auf prospektiven und retrospektiven Kohortenstudien sowie Fallkontrollstudien, die die Beziehung zwischen RCC-Inzidenz und Hypertonus oder die Auswirkung blutdrucksenkender Medikamente auf die Inzidenz untersucht haben. In einer 2017 veröffentlichten Metaanalyse wurde die Assoziation zwischen Hypertonie und RCC-Inzidenz anhand 18 prospektiver Studien mit insgesamt 8097 Patienten mit RCC nachgewiesen. Das kumulative relative Risiko bei Patienten mit Hypertonie betrug 1,67; darüber hinaus war eine Erhöhung des Blutdrucks um 10mmHg mit einer 10–22%igen Erhöhung des RCC-Risikos verbunden.32
Auch in einer weiteren Metaanalyse von 12 Studien33 wurde eine signifikante Assoziation zwischen Hypertonus und RCC (RR: 1,55) festgestellt, mit einer ausgeprägteren Korrelation als bei anderen Tumorarten. Der Einfluss war bei männlichen (RR: 1,29) und weiblichen (RR: 1,63) Patienten statistisch signifikant.
In einer Studie, in der Daten aus der European Prospective Investigation into Cancer and Nutrition (EPIC) mit über 296000 Teilnehmern aus acht europäischen Ländern analysiert wurden, erhöhte sich das Risiko relativ um den Faktor 2,48 bzw. 2,34 für Patienten in den höchsten gegenüber den niedrigsten Kategorien des systolischen und diastolischen Blutdrucks, es zeigte sich jedoch keine Verbindung zwischen blutdrucksenkenden Medikamenten und RCC-Risiko.34,35Dazu gibt es widersprüchliche Evidenz – in den meisten Studien konnte kein Einfluss blutdrucksenkender Medikamente auf die RCC-Inzidenz belegt werden, 36–39 lediglich in zwei Studien39,40 wurde nach multivariabler Adjustierung an Hypertonie eine Wirkung blutdrucksenkender Medikamente auf die Inzidenz berichtet. Dies deutet darauf hin, dass eine effektive medikamentöse Blutdruckkontrolle das RCC-Risiko verringern könnte.39,40
Diabetes, Dyslipidämie und metabolisches Syndrom
Diabetes, Dyslipidämie und metabolisches Syndrom sind eng miteinander verbundene metabolische Zustände, die weltweit zunehmend häufiger auftreten und auch in Verbindung mit der zunehmenden RCC-Inzidenz gebracht werden. Während für Dyslipidämie und RCC-Inzidenz bisher keine klare Assoziation gezeigt wurde, gibt es Hinweise für einen Zusammenhang zwischen Diabetes bzw. metabolischem Syndrom und RCC.
Der Zusammenhang zwischen RCC und Diabetes mellitus wurde in prospektiven Studien,41,42 retrospektiven Analysen43–48 und einer Fallkontrollstudie49 untersucht. Ein erhöhtes Risiko bei Patienten mit Diabetes wurde in den meisten Studien berichtet, während in nur einer Studie49 keine Korrelation gefunden wurde. Die Beziehung zwischen Diabetes mellitus und RCC-Risiko war bei Frauen ausgeprägter als bei Männern,41,43,44,47 was in zwei Metaanalysen bestätigt wurde.50,51 In beiden Analysen wurde ein erhöhtes Risiko bei Diabetes berichtet (OR: 1,42 bzw. 1,40) mit einer stärkeren Assoziation bei Frauen (OR: 1,70 bzw. 1,47). Weitere Studien sind zweifelsohne notwendig, um die zugrunde liegenden Mechanismen zu erforschen und Strategien für die Vorbeugung und Behandlung von RCC bei Patienten mit Diabetes zu entwickeln.
Die Ergebnisse aller Studien zum metabolischen Syndrom (MetS) oder einzelnen Faktoren des MetS (Taillenumfang oder BMI, Hypertonie, Hypertriglyceridämie, Hyperglykämie und niedriges HDL-Cholesterin) legen eine Assoziataion mit dem RCC-Risiko nahe. In einer Fallkontrollstudie hatten 52 von 117 Patienten mit RCC (44,4%) und 37 von 238 der Kontrollteilnehmer (15,5%) ein MetS (OR: 4,35; 95% CI: 2,62–7,21; p<0,001).51 Darüber hinaus wurde bei einer Zunahme der Anzahl der MetS-Komponenten von 3 auf 5 ein 4-facher Anstieg des Risikos festgestellt. Diese Ergebnisse waren mit Ergebnissen aus anderen Studien konsistent; in einer dieser Studien war die Verbindung zwischen dem RCC-Risiko und dem MetS oder jeder MetS-Komponente bei Männern stärker ausgeprägt als bei Frauen.53 In einer weiteren Studie wurde gezeigt, dass Hypertonie den stärksten Effekt hatte (10-fach erhöhtes RCC-Risiko).54 Zu berücksichtigen ist, dass alle Studien nicht frei von Limitierungen sind. Mehrere MetS-Komponenten könnten Teil des gleichen biologischen Mechanismus sein, was den Effekt dieser Komponenten verstärken kann. Um die Datenheterogenität zu reduzieren und Überlappungen zu vermeiden, sollten zudem individuelle MetS-Definitionen berücksichtigt werden.
Ernährung und Alkohol
Ernährung umfasst zahlreiche Einflüsse, die miteinander sowie mit anderen Lebensstilfaktoren wie körperlicher Aktivität, Rauchen und Alkoholkonsum interagieren und das RCC-Risiko beeinflussen könnten. Eine klare Schlussfolgerung über den Zusammenhang zwischen der Ernährung und dem RCC kann derzeit nicht gezogen werden.
In epidemiologischen Studien ergaben sich widersprüchliche Ergebnisse bezüglich Gemüse- und Obstkonsum und RCC-Inzidenz. In einer großen Zahl von Studien wurde keine Verbindung zwischen Gemüse- und Obstkonsum und RCC-Inzidenz gefunden (158, 162, 163, 167–170). Dagegen zeigte eine Datenanalyse von 13 prospektiven Kohortenstudien, dass der Verzehr von Obst und Gemüse mit einem geringeren Risiko assoziiert ist und dass die enthaltenen Karotinoide möglicherweise zu diesem schützenden Effekt beitragen könnten.62 In einer weiteren Metaanalyse wurde gezeigt, dass der Verzehr von Gemüse und Obst eine schützende Wirkung hat.63
Eine Studie mit 1800 RCC-Patienten zeigte, dass ein hoher Verzehr von rotem Fleisch mit einem erhöhten RCC-Risiko assoziiert war (HR: 1,43; 95% CI: 1,12–1,82; p=0,003) sowie mit einem zweifach erhöhten Risiko für ein papilläres RCC (HR: 2,68; 95% CI: 1,34–5,37; p=0,005).64 Ebenso zeigte eine Metaanalyse eine statistisch signifikante Assoziation mit dem Verzehr von rotem Fleisch (OR: 1,28; 95% CI: 1,09–1,49), die sich mit zunehmendem Fleischkonsum steigerte (OR: 1,38; 95% CI: 1,09–1,74). In einer kleineren Zahl prospektiver Studien wurde berichtet, dass der Zusammenhang zwischen dem Verzehr von rotem und verarbeitetem Fleisch und dem RCC-Risiko bei Frauen stärker ausgeprägt war als bei Männern.65–67
Für Geflügel, Kaffee und Meeresfrüchte exisitieren derzeit keine Hinweise für einen Zusammenhang mit dem RCC, während in einer Studie die Aufnahme von Vitamin E invers mit dem Risiko von Nierenkrebs assoziiert war.68
Der Großteil der derzeit verfügbaren Evidenz zu Ernährung und RCC basiert auf Daten von Beobachtungs- und Fragebogenstudien, deren Limitierungen bekannt sind. Generelle Schlussfolgerungen sind daher, auch trotz vorliegender Hinweise zu einzelnen Zusammenhängen, nicht zulässig. Studien zur Evaluierung möglicher zugrunde liegender Mechanismen, durch die die Ernährung das RCC-Risiko beeinflussen könnte, fehlen.
In einigen Studien wurde ein Zusammenhang zwischen Alkoholkonsum und einem verringerten Risiko für RCC festgestellt.68–70 Eine negative Korrelation zwischen mäßigem Alkoholkonsum und RCC-Inzidenz wurde in einigen prospektiven Studien berichtet.71–74 Darüber hinaus zeigte der Bericht des American Institute for Cancer Research (AICR) und des World Cancer Research Fund (WCRF) aus dem Jahr 201875 eine Evidenz für ein verringertes Risiko bei Alkoholkonsum bis zu 30g pro Tag. Schließlich wurde in zwei Metaanalysen eine negative Assoziation zwischen Alkoholkonsum und RCC-Risiko sowohl für mäßige als auch für moderate Trinker berichtet.76,77 Die Mechanismen, die einer möglichen inversen Verbindung zwischen Alkoholkonsum und RCC-Risiko zugrunde liegen, sind jedoch unbekannt. Im Gegensatz dazu fand die VITAL-Studie keine Assoziation.13 Der tatsächliche Effekt von Alkoholkonsum auf das RCC-Risiko bleibt derzeit aufgrund des retrospektiven Designs und fehlender objektiver Bestimmung des Alkoholkonsums der meisten eingeschlossenen Studien unbestimmt.
Bewegung und körperliche Aktivität
Es wurden mehrere prospektive Kohorten- und Fallkontrollstudien durchgeführt, um den Effekt von Bewegung auf die RCC-Inzidenz zu bewerten. In weiteren Studien wurde der Effekt körperlicher Aktivität auf die krebsspezifische Mortalität auch in prospektiven Kohorten von gesunden Personen beurteilt. Diese Studien lieferten teilweise widersprüchliche Ergebnisse, wobei in einigen Studien eine inverse Verbindung zwischen körperlicher Aktivität und RCC-Inzidenz berichtet wurde, in anderen jedoch nicht. Die Ergebnisse resultierten aus heterogenen Kohorten und Studiendesigns, was ihre Interpretation erschwert. Drei systematische Reviews zeigten 78–80 einen inversen Zusammenhang zwischen körperlicher Aktivität und RCC-Risiko, insbesondere wenn zwischen hohem und niedrigem Aktivitätsniveau bei verschiedenen Geschlechtern und Arten von körperlicher Aktivität unterschieden wurde. In einigen Studien wurde ein Effekt körperlicher Aktivität nur bei Frauen gezeigt,71,81,82 während in einer anderen Studie diese Verbindung nur bei Männern berichtet wurde.83
Zahlreiche Limitierungen, die den verschiedenen verwendeten Methoden inhärent sind, erschweren die Interpretation der Ergebnisse der vorliegenden Studien. Körperliche Aktivität wurde in verschiedenen Studien unterschiedlich definiert bzw. eine Selbsteinschätzung anhand von Fragebogen vorgenommen. Darüber hinaus fehlen standardisierte Bewertungen und einheitliche Definitionen von körperlicher Aktivität, was Schlussfolgerungen zum Effekt bestimmter Sportarten, zu Intensitäten, Häufigkeit, Dauer und Zeitpunkt der körperlichen Aktivität auf Inzidenz und Prognose erschwert. Die Korrektur von Störfaktoren ist in den Studien zudem inkonsistent, und während in den meisten Studien die Ergebnisse nach Alter, Geschlecht, Adipositas und Rauchen angepasst wurden, fehlt die Adjustierung an sozioökonomischem Status, Ethnizität, Hypertonie, Diabetes, Alkoholkonsum und Ernährung. Insgesamt scheint jedoch trotz heterogener Evidenz eine zumindest schwache inverse Verbindung zwischen körperlicher Aktivität und RCC-Inzidenz plausibel zu sein, wobei die Möglichkeit erwogen werden muss, dass körperliche Aktivität ein Surrogat für einen insgesamt gesunden Lebensstil ist, der weitere Einflussfaktoren und damit indirekt das RCC-Risiko positiv beeinflusst. Darüber hinaus ist der Wirkmechanismus, durch den Bewegung und körperliche Aktivität die Inzidenz und Prognose von RCC beeinflussen könnten, weitgehend unbekannt. Letztendlich legen jedoch mehrere Studien auch zu anderen Tumorentitäten nahe, dass Sport und körperliche Aktivität u.a. positive tumorimmunologische Effekte generieren und zu einer Reduktion chronischer Inflammation führen, was sowohl Tumorgenese als auch Prognose positiv beeinflussen kann. Angesichts der verfügbaren Evidenz scheint die Empfehlung zu körperlicher Aktivität zulässig, da ein positiver Einfluss – sei es direkt oder indirekt durch die positive Beeinflussung anderer Risikofaktoren (Adipositas, Diabetes, Dyslipidämie) – anzunehmen ist.
Die wichtigsten aktuellen Erkenntnisse zur Thematik des Artikels fasst Tabelle 1 zusammen.
Tab. 1: Die wichtigsten Punkte zur Epidemiologie und Prävention des Nierenzellkarzinoms und offene, noch nicht abschließend beantwortbare Fragen
Literatur:
1 Cairns P: Cancer Biomark 2010; 9(1-6): 461-73 2 Cimadamore A et al.: Transl Androl Urol 2021; 10(3): 1506-20 3 Signoretti S et al.: J Clin Oncol 2018; 36(36): 3553-9 4 Ferlay J et al.: Globocan 2020; 419 3-4 5 Ferlay J et al.: Int J Cancer 2019; 144(8): 1941-53 6 Huang J et al.: Eur Urol Focus 2022; 8(1): 200-9 7 Capitanio U et al.: Eur Urol 2019; 75(1): 74-84 8 Patel HD et al.: Eur Urol Oncol 2019; 2(4): 343-8 9 Al-Bayati O et al.: Urol Oncol 2019; 37(6): 359-71 10 Ba Z et al.: Front Cardiovasc Med 2022; 9: 810262 11 Rai BP et al.: Eur Urol 2022; 82(2): 182-92 12 Jacob L et al.: Oncotarget 2018; 9(25): 17420-9 13 MacLeod LC et al.: J Urol 2013; 190(5): 1657-61 14 Mariusdottir E et al.: Scand J Urol 2016; 50(3): 181-5 15 Wang G et al.: Cancer Epidemiol 2012; 36(2): 177-82 16 Lotan Y et al.: Urol Oncol 2016; 34(4): 167.e9–167.e16 17 Laaksonen MA et al.: T Int J Cancer 2020; 146(3): 874-83 18 Cumberbatch MG et al.: Eur Urol 2016; 70(3): 458-66 19 Song X et al.: Eur J Epidemiol 2014; 29(7): 477-87 20 Landberg A et al.: Int J Cancer 2019; 145(5): 1232-7 21 Nam GE et al.: Br J Cancer 2019; 121(3): 271-7 22 Lowrance WT et al.: BJU Int 2010; 105(1): 16-20 23 Beebe-Dimmer JL et al.: Epidemiology 2012; 23(6): 821-8 24 Brennan P et al.: Br J Cancer 2008; 99(11): 1912-5 25 Shen T et al.: Cancer Causes Control 2015; 26(8): 1173-80 26 Tchernof A, Després JP: Physiol Rev 2013; 93(1): 359-404 27 Calle EE, Kaaks R: Nat Rev Cancer 2004; 4(8): 579-91 28 Kim LH et al.: J Urol 2021; 205(2): 346-55 29 Wang F, Xu Y: Int J Cancer 2014; 135(7): 1673-86 30 Brookman-May S et al.: Scand J Urol Nephrol 2011; 45(1): 5-14 31 Choi Y et al.: Int J Cancer 2013; 132(3): 625-34 32 Hidayat K et al.: J Hypertens 2017; 35(7): 1333-44 33 Seretis A et al.: Sci Rep 2019; 9(1): 8565 34 Kocher NJ et al.: World J Urol 2017; 35(1): 67-72 35 Shapiro JA et al.: Am J Epidemiol 1999; 149(6): 521-30 36 Heaf JG et al.: J Clin Hypertens 2019; 21(6): 786-91 37 Yuan JM et al.: Br J Cancer 1998; 77(9): 1508-13 38 Colt JS et al.: Epidemiology 2011; 22(6): 797-804 39 Colt JS et al.: Cancer Causes Control 2017; 28(4): 289-97 40 McLaughlin JK et al.: Int J Cancer 1995; 63(2): 216-21 41 Graff RE et al.: Diabetes Care 2018; 41(7): 1432-7 42 Sawada N et al.: Ann Epidemiol 2010; 20(6): 466-72 43 Dankner R et al.: Am J Epidemiol 2016; 183(12): 1098-1106 44 Habib SL et al.: J Cancer 2012; 3: 42-8 45 Tseng CH; National Health Insurance: PLoS One 2015; 10(11): e0142480 46 Lindblad P et al.: Diabetologia 1999; 42(1): 107-12 47 Ballotari P et al.: BMC Cancer 2017; 17(1): 703 48 Tseng CH: Eur J Cancer 2016; 52: 19-25 49 Wei Lai S et al.: Ann Acad Med Singap 2013; 42(3): 120-4 50 Chen L et al.: Medicine (Baltimore) 2015; 94(26): e1055 51 Li Y et al.: Int Urol Nephrol 2017; 49(6): 975-81 52 Bulut S et al.: Asian Pac J Cancer Prev 2014; 15(18): 7925-8 53 Häggström C et al.: PLoS One 2013; 8(2): e57475 54 Kriegmair MC et al.: Horm Cancer 2017; 8(2): 127-34 55 Daniel CR et al.: Am J Clin Nutr 2013; 97(5): 1036-43 56 Weikert S et al.: Int J Cancer 2006; 118(12): 3133-39 57 Handa K, Kreiger N: Public Health Nutr 2002; 5(6): 757-67 58 Daniel C R et al.: Br J Cancer 2011; 105(7): 1096-1104 59 Talamini R et al.: Cancer Causes Control 1990; 1(2): 125-32 60 Wolk A et al.: Int J Cancer 1996; 65(1): 67-73 61 Mellemgaard A et al.: Eur J Cancer 1996; 32A(4): 673-82 62 Jung EL et al.: Cancer Epidemiol Biomark Prev 2009; 18(6): 1730-9 63 Zhang S et al.: Oncotarget 2017; 8(17): 27892-903 64 Huang TB et al.: Med Oncol 2014; 31(8): 125 65 Dolwick Grieb SM et al.: J Am Diet Assoc 2009; 109(4): 656-67 66 Lee JE et al.: J Natl Cancer Inst 2008; 100(23): 1695-1706 67 Rohrmann S et al.: Int J Cancer 2015; 136(5): E423-E431 68 Shen C et al.: Med Sci Monit 2015; 21: 3420-26 69 Fraser GE et al.: H Int J Epidemiol 1190; 19(4): 832-8 70 Faramawi MF et al.: Cancer Causes Control 2007; 18(2): 125-33 71 Setiawan VW et al.: Am J Epidemiol 2007; 166(8): 932-40 72 World Cancer Research Fund; American Institute for Cancer Research: 1Food, nutrition, physical activity, and the prevention of cancer: a global perspective. Washington DC: AICR, 2007: https://discovery.ucl.ac.uk/id/eprint/4841/1/4841.pdf 73 Lee JE et al.: J Natl Cancer Inst 2007; 99(10): 801-10 74 Lew JQ et al.: Br J Cancer 2011; 104(3): 537-41 75 Steven K Clinton et al.: J Nutr 2020; 150(4): 663-671 76 Song DY et al.: Br J Cancer 2012; 106(11): 1881-90 77 Bellocco R et al.: Ann Oncol 2012; 23(9): 2235-44 78 Mctiernan A et al.: Med Sci Sports Exerc 2019; 51(6): 1252-61 79 Behrens G, Leitzmann MF: Br J Cancer 2013; 108(4): 798-811 80 Bertoia M et al.: Int J Cancer 2010; 126(6): 1504-12 81 Nicodemus KK et al.: Int J Cancer 2004; 108(1): 115-21 82 Chiu BCH et al.: Int J Obes (Lond) 2006; 30(6): 940-7 83 IWH 2015: https://www.iwh.on.ca/what-researchers-mean-by/primary-secondary-and-tertiary-prevention
Das könnte Sie auch interessieren:
Aktuelle Entwicklungen und Erkenntnisse beim Urothelkarzinom
Auf dem diesjährigen Genitourinary Cancers Symposium der American Society of Clinical Oncology (ASCO-GU-Kongress) wurden bedeutende Fortschritte in der Diagnose und Behandlung des ...
Aktuelles aus der 7. Version der S3-Leitlinie: wesentliche Leitlinienänderungen
Im Mai 2024 wurde die Prostatakarzinom-S3-Leitlinie unter der Federführung der Deutschen Gesellschaft für Urologie e.V. (DGU) im Rahmen des Leitlinienprogramms Onkologie in ihrer 7. ...
Neues vom ASCO GU zum Prostatakarzinom
Im Rahmen des ASCO GU 2025 in San Francisco wurden eine Vielfalt von neuen praxisrelevanten Studien zum Prostatakarzinom präsentiert. Mit Spannung wurde unter andem auch auf die finalen ...