Die kindliche Lunge: Infektionen verhindern, Komplikationen vorbeugen
Bericht:
Reno Barth
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Infektionen der unteren Atemwege in der Kindheit stellen einen relevanten Risikofaktor für eine frühe Abnahme der Lungenfunktion im späteren Leben sowie für frühen Tod dar. Dieses Risiko kann reduziert werden. Die Antwort liegt einerseits in wirksamer Prävention, unter anderem durch Impfungen, andererseits aber auch in verbesserter Diagnostik und Therapie von Pneumonien.
Die Entwicklung der Lunge setzt sich nach der Geburt bis ins Alter von rund 21 Jahren fort. Jede Störung dieser Entwicklung kann daher lebenslange Konsequenzen haben, so Dr. Stefan Unger, University of Edinburgh, im Rahmen der ERS Satellites. Zu den Faktoren, die die Entwicklung der Lunge ungünstig beeinflussen können, zählen Infektionen der Atemwege. So zeigte eine Longitudinalstudie, dass eine Pneumonie innerhalb der ersten drei Lebensjahre sowohl mit einer signifikant schlechteren Lungenfunktion als auch mit einem erhöhten Asthmarisiko im Alter von elf Jahren assoziiert ist.1
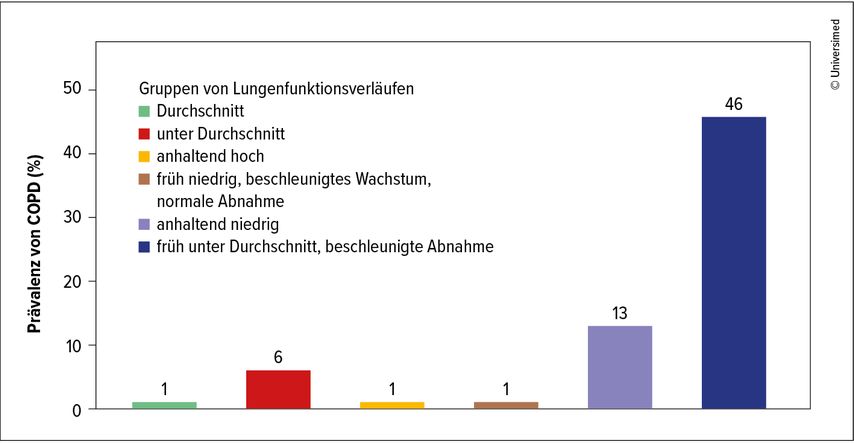
Für die Tasmanian Longitudinal Health Study wurde die Lungenfunktion der Proband:innen zwischen dem siebenten und dem 53. Geburtstag insgesamt sechsmal gemessen. Auf dieser Basis konnten sechs Typen von Entwicklung der Lungenfunktion identifiziert und mit verschiedenen Erkrankungsrisiken korreliert werden. Personen, die in der Kindheit eine niedrige Einsekundenkapazität aufwiesen und im späteren Leben auch früh an Lungenfunktion verloren, hatten ein massiv erhöhtes Risiko, eine COPD zu entwickeln. Die COPD-Prävalenz lag im Alter von 53 Jahren in dieser Gruppe bei 46% (Abb. 1). Wer kontinuierlich eine eingeschränkte Lungenfunktion zeigte, hatte ebenfalls ein erhöhtes COPD-Risiko – dies jedoch nicht im selben Ausmaß. Bronchitis und Pneumonie in der Kindheit waren ebenfalls Prädiktoren dieses Risikos.2 Häufige Infektionen der Atemwege in der Kindheit dürften auch mit einem früheren Tod assoziiert sein.3
Abb. 1: Prävalenz von COPD im Alter von 53 Jahren in Zusammenhang mit unterschiedlichen Verläufen der Lungenfunktion (modifiziert nach Bui DS et al. 2018)2
Impfungen reduzieren Pneumonien um bis zu 85%
Ein weiteres langfristiges Problem, das durch wiederholte akute Infektionen der Lunge und in weiterer Folge chronische bakterielle Bronchitis verursacht werden kann,sind Bronchiektasen. Diesen Prozess müsse man erkennen und aufhalten, so Unger. Zu achten ist einerseits auf schwere akute virale oder bakterielle Infektionen der Atemwege, insbesondere auf (komplizierte) Pneumonien, und andererseits auf rezidivierende virale oder bakterielle Infektionen der unteren Atemwege und eine resultierende geringgradige chronische bakterielle oder virale Infektion mit wiederkehrenden Episoden von produktivem Husten. Mittel zur Verbesserung der langfristigen Prognose sind Primärprävention, verbesserte Diagnostik, schnelle und effektive Behandlung, Follow-up und Prävention weiterer Infektionen sowie schließlich eine erfolgreiche Transition zur Erwachsenen-Pulmologie.
Neben nichtmodifizierbaren Risikofaktoren für Infektionen der Atemwege wie Genetik, Epigenetik, niedriges Geburtsgewicht oder Tabakexposition in utero besteht eine Reihe möglicher Interventionen zur Infektionsprophylaxe. Zusätzlich zu verbesserter Hygiene, sozialen Interventionen und optimierter Ernährung kommt die wichtigste Rolle dabei den Impfungen zu. Unger wies in diesem Zusammenhang auf Daten zur Pneumokokkenimpfung hin, die eine Reduktion der bestätigten Pneumokokkenpneumonien um bis zu 85% sowie der Hospitalisierungen um bis zu 60% zeigen, wobei bei der Wirksamkeit gewisse regionale Unterschiede bestehen, so Unger.4 Einen weiteren Risikofaktor stellen Infektionen mit dem respiratorischen Synzytial-Virus (RSV) dar. Hier steht zur Prophylaxe der monoklonale Antikörper Nirsevimab zur Verfügung – eine populationsbasierte Longitudinalstudie aus Spanien zeigt einen Rückgang der Zahl der Hospitalisierungen infolge von RSV-Infektionen.5
Bestmöglich vermeiden: Tabak, Luftverschmutzung und Schimmel
Von hoher Relevanz ist auch die Prophylaxe von Tabakexposition im Kindesalter. So zeigen britische Studien, dass mit der Implementation von gesetzlichen Rauchverboten die Zahl der wegen Atemwegsinfektionen hospitalisierten Kinder signifikant zurückging. Im Rahmen einer Metaanalyse ergab sich eine Risikoreduktion in der Größenordnung von 20%.6
Ebenso hat Luftverschmutzung einen ungünstigen Einfluss auf das Infektionsrisiko in der Kindheit. Unger: „Mehr als 40% der Weltbevölkerung, davon mehr als eine Milliarde Kinder und Jugendliche, atmen stark verschmutzte Luft – inklusive ,household air pollution‘ (HAP) als Resultat ungünstiger Koch- und Heizmethoden.“ HAP ist mit einem um 50% erhöhten Risiko von Infektionen der unteren Atemwege assoziiert. Insbesondere Exposition gegenüber Feinstaub (PM2,5) erhöhe das Risiko. Dieser schwäche die Immunantwort der Atemwege und mache sie folglich anfälliger für Infektionen. Feinstaub erhöhe auch die Exposition gegenüber Krankheitserregern, da er zu vermehrtem Husten führe und damit die Übertragung von Keimen fördere. Infolge eingeschränkter Immunantwort und protrahierter Infektionen werden Menschen unter Feinstaubbelastung auch selbst infektiöser, da sie mehr Keime aushusten. Darüber hinaus verstärkt Feinstaub die Inflammation und erzeugt oxidativen Stress, was zu schwereren Erkrankungen führt.7, 8
Neben HAP können auch Feuchtigkeit und Schimmel das Risiko von Atemwegsinfektionen erhöhen. Wird die Belastung mit einem Feuchtigkeits-Schimmel-Index gemessen, so zeigt sich mit zunehmender Exposition und unter Dosis-Wirkungs-Beziehung eine Zunahme des Infektionsrisikos.9
Da die meisten Atemwegsinfektionen durch Pathogene in der Luft verursacht werden, stellen Luftreiniger beispielsweise in Kindergärten eine geeignete Präventionsmaßnahme dar. Eine Studie in vier Kindergärten zeigte, dass die Verwendung tragbarer Luftreiniger zu einer Reduktion der Zahl der Atemwegsinfektionen um 18% führt. Doch auch eine Reihe weiterer Maßnahmen, wie zum Beispiel bessere Belüftung und regelmäßiger Aufenthalt im Freien, reduziert das Infektionsrisiko.
Die Rolle der Ernährung ist weniger klar. Sowohl Unterernährung als auch Übergewicht dürften das Infektionsrisiko erhöhen. Ein Teufelskreis von Unterernährung und Infektionen, die die Ernährungssituation verschlechtern, ist gut beschrieben. Wenigerklar ist, wie sich Atemwegsinfektionen durch Ernährungsinterventionen beeinflussen lassen. Ein Review fand keine signifikanten Effekte beispielsweise für die Supplementation diverser Mikronährstoffe. Unger wies in diesem Zusammenhang auf in Westafrika durchgeführte Studien hin, die genau das Gleiche zeigen. Adipositas erhöht das Risiko, eine Infektion der unteren Atemwege zu entwickeln – und zwar bei Kindern um den Faktor 2, wie Unger am Beispiel polnischer Daten ausführte.10
Momentan ist eine ERS-Taskforce damit beschäftigt, die Rolle des Ultraschalls bei der Diagnostik von komplizierten Pneumonien im Kindesalter genauer zu definieren
Verbesserte Diagnostik mit Sensoren und künstlicher Intelligenz?
Neben der Prävention kommt auch der Diagnostik große Bedeutung zu. Auch hier gibt es aktuell noch Raum nach oben, so Unger. Für das digitale Stethoskop in der Diagnostik von Pneumonien bei Kindern fand eine Metaanalyse lediglich bescheidene Evidenz. Allerdings fand dieselbe Gruppe bei den Anwendern dieser Geräte hohe Akzeptanz für die Technologie, erläuterte Unger. Ein weiterer Schritt in Richtung gerätebasierter Diagnostik könnte mit „soft wireless electronics“ getan werden. Dabei handelt es sich um Sensoren, die auf der Haut aufgeklebt werden und beispielsweise Lungengeräusche aufnehmen und auswerten können. Letzteres basiert auf einem lernfähigen, KI-basierten System, das unterschiedliche Geräusche wie z.B. Knistern, Giemen oder Stridor, identifizieren und interpretieren kann. Die diagnostische Genauigkeit soll bei 95% liegen.11
Eine wichtige Rolle in der Diagnostik von Pneumonien, insbesondere komplizierten Pneumonien im Kindesalter, spielt der Ultraschall. Eine ERS-Taskforce ist aktuell damit beschäftigt, die Möglichkeiten der Sonografie genauer zu definieren. Unter den biochemischen Biomarkern wurden die besten Ergebnisse mit CRP und Procalcitonin erzielt, die Sensitivität ist allerdinge suboptimal, wie Unger betonte.
Wie lange müssen Antibiotika gegeben werden?
Selbstverständlich zählt neben der korrekten Diagnose auch die wirksame Therapie. Neben der Wahl eines geeigneten Antibiotikums, bei der die regionale Resistenzsituation im Auge behalten werden muss, ist auch eine ausreichende Therapiedauer von entscheidender Bedeutung. Zu dieser Frage beruhen die Empfehlungen der Leitlinien auf schwacher Evidenz, sie bewegen sich zwischen drei und zehn Tagen. Für eine kürzere Therapiedauer sprechen die geringeren Nebenwirkungen und Kosten, reduzierte Resistenzbildungen und die meist bessere Adhärenz. Die Gefahr bei kurzer Therapiedauer ist Therapieversagen, das zu erhöhter Morbidität oder sogar zum Tod führen kann. Eine Vergleichsstudie in der Indikation ambulant erworbene Pneumonie mit Hospitalisierung fand zwischen einer Standardtherapie über 5 bis 6 Tage und einer verlängerten Therapie über 12 bis 13 Tage keinen signifikanten Unterschied hinsichtlich der Chronifizierung von Symptomen oder Rehospitalisierungen wegen Pneumonie. Dieses Ergebnis war auch in Kohorten mit ambulanten Patient:innen mit niedrigem Risiko reproduzierbar, so Unger. Wenig überraschend zeigen längere Antiobiotikatherapien bessere Ergebnisse bei prolongierten Atemwegserkrankungen, wie zum Beispiel chronischem produktivem Husten. Eine bereits vor einigen Jahren veröffentlichte Metaanalyse fand hier Vorteile für eine Therapiedauer von zwei Wochen. Manche Patient:innen benötigen allerdings vier Wochen Therapie.12 Eine längere Therapiedauer bewährt sich auch bei Exazerbationen von Bronchiektasen bei Kindern.13 Nicht zuletzt betonte Unger die Rolle des Follow-up nach schweren Lungeninfekten bei Kindern. Insbesondere bei chronischer Keimbesiedelung sowie in Risikogruppen ist Monitoring über lange Zeit indiziert, wobei man immer die Auswirkungen von Exazerbationen auf die Lungenfunktion im Auge behalten sollte.
Quelle:
„Potential for prevention of infections to reduce development of lung disease“, Vortrag von Dr. Stefan Unger, UK, am 4.3.2025 im Rahmen der ERS Satellites
Literatur:
1 Chan JY et al.: Pediatrics 2015; 135(4): 607-16 2 Bui DS et al.: Lancet Respir Med 2018; 6(7): 535-44 3 Allinson JP et al.: Lancet 2023; 401(10383): 1183-93 4 Reyburn R et al.: J Glob Health 2023; 13: 05002 5 Ares-Gómez S et al.: Lancet Infect Dis 2024; 24(8): 817-28 6 Faber T et al.: Lancet Public Health 2017; 2(9): e420-e437 7 Aithal SS et al.: Breathe (Sheff) 2023; 19(2): 230040 8 Horne BD et al.: Am J Respir Crit Care Med 2018; 198(6): 759-66 9 Ingham T et al.: Thorax 2019; 74(9): 849-57 10 Vlieg-Boerstra B et al.: Allergy 2022; 77(5): 1373-88 11 Lee SH et al.: Sci Adv 2022; 8(21): eabo5867 12 Chang AB et al.: Chest 2016; 149(1): 120-42 13 Goyal V et al.: Lancet Respir Med 2019; 7(9): 791-801
Das könnte Sie auch interessieren:
Asthma-Update
In der Asthmatherapie ist ein grundlegender Wandel zu beobachten: weg von der Symptombekämpfung hin zur Symptomprävention. Bei schwerem Asthma stehen Biologika mit unterschiedlichen ...
Welche Allergene bringt der Frühling?
Der Frühling ist da und viele Pflanzen blühen bereits. Somit stellt diese Jahreszeit für Pollenallergiker:innen eine besondere Herausforderung dar. Ostern ist zwar schon vorbei, aber es ...