Cretostimogen Grenadenorepvec plus Pembrolizumab bei BCG-unresponsivem HR-NMIBC mit CIS
Autorinnen:
Dr. Katharina Oberneder
Mag. Dr. Melanie R. Hassler-Di Fratta
Universitätsklinik für Urologie
Medizinische Universität Wien
Die Therapie der Wahl bei nicht muskelinvasivem Blasentumor mit hohem Risiko ist eine intravesikale Therapie mit Bacillus Calmette-Guérin (BCG).1 Trotz optimaler Behandlung kommt es oft zu einem Krankheitsrückfall und Fortschreiten zu muskelinvasivem Blasenkrebs.2 Empfohlen ist daher eine radikale Zystektomie (RC).1 Ein Großteil der Patienten ist dafür jedoch nicht gesund genug oder lehnt diese ab. Somit besteht ein hoher Bedarf an konservativen Therapiemöglichkeiten für diese Patientengruppe. Eine Therapie mit CretostimogenGrenadenorepvec plus Pembrolizumab zeigt sich in diesem Setting erfolgreich.
Keypoints
-
Cretostimogen Grenadenorepvec (CG0070) ist ein onkolytisches Adenovirus, das den FDA-Status Fast Track und Breakthrough Therapy Designation für BCG-unempfindlichen, „highrisk“ nichtmuskelinvasiven Blasenkrebs mit Carcinoma in situ (HR-NMIBC mit CIS) erhalten hat, jedoch noch nicht durch die EMA zugelassen ist.
-
In Phase-II-Studien mit CG0070-Monotherapie zeigten Patienten mit CIS ± Ta/T1 Ansprechraten von 58% nach 6 Monaten und 28% nach 12 Monaten.4
-
Die Kombinationstherapie von Cretostimogen Grenadenorepvec mit dem Checkpoint-Inhibitor Pembrolizumab ergab außergewöhnlich hohe Ansprechraten, mit einer CRR von 57,1% nach 12 Monaten und 51,4% nach 24 Monaten.5
-
Cretostimogen Grenadenorepvec hat in Kombination mit Pembrolizumab großes Potenzial als vielversprechende neue blasenerhaltende Therapie für Patienten nach BCG-Versagen.6
Die intravesikale Instillation von BacillusCalmette-Guérin (BCG) ist als adjuvante Standardtherapie bei Patienten mit nichtmuskelinvasivem Blasenkarzinom und hohem Risiko für Rezidiv oder Progression etabliert. Sie senkt in dieser Indikation bei korrekter Applikation sowohl Rezidiv- als auch Progressionsraten, jedoch kommt es bei bis zu 40% der Patienten zu einem Therapieversagen, z.B. durch Wiederauftreten eines „highrisk“ Befundes (Carcinomainsitu [CIS] oder „highgrade“ Ta- oder T1-Blasentumoren) unter oder nach Therapie.7 Für Patienten mit NMIBC, welches nicht auf die BCG-Therapie anspricht, ist die radikale Zystektomie die nächste Standardtherapie. Allerdings sind viele Patienten nicht bereit oder körperlich nicht fit genug für diese Operation, und ein nicht geringer Anteil der Patienten würde dadurch auch eine Übertherapie erhalten.8 Daher besteht im Setting der BCG-Versager ein hoher Bedarf an blasenerhaltenden Alternativen, und mehrere Studien mit experimentellen Therapien haben sich in den letzten Jahren dieser Patientengruppe gewidmet.9–11
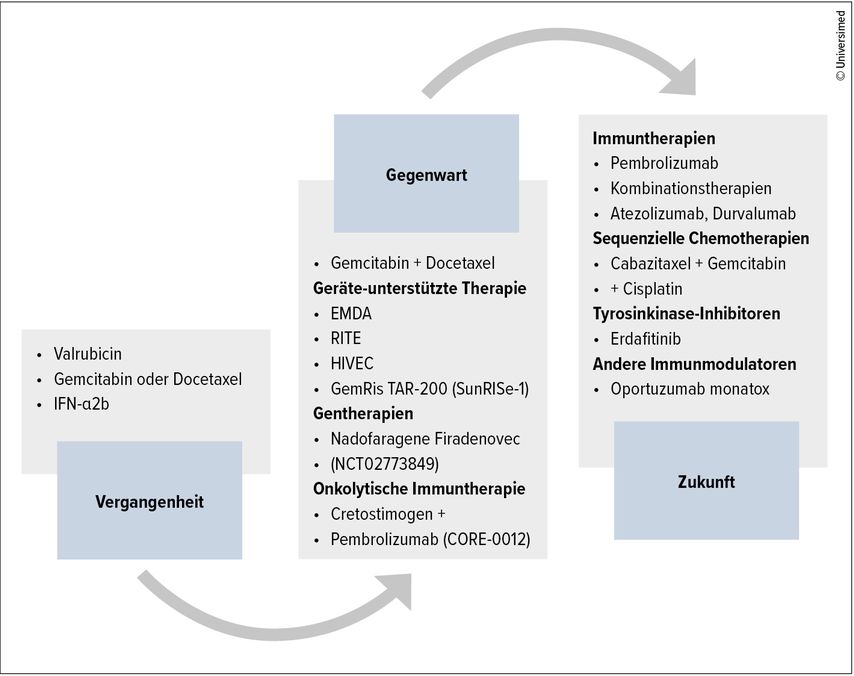
Therapieansätze bei BCG-unresponsivem NMIBC mit CIS
Da sich das Studiendesign durch das Fehlen von effektiven Kontrollarmen schwierig gestaltet, werden z.B. von der amerikanischen Food and Drug Administration (FDG) auch Single-Arm-Studien für Patienten nach BCG-Versagen mit kompletter Ansprechrate (CRR) (für Patienten mit CIS), Rezidiv-freier Rate (RFR) (für Patienten mit papillären Tumoren) und Dauer des Ansprechens (für Patienten mit CIS und mit papillären Tumoren) als primäre Endpunkte akzeptiert.12 Als Therapiealternativen wurden sowohl zytotoxische als auch immunogene Stoffe getestet, darunter (Abb. 1 und Tab. 1) z.B. intravesikales Gemcitabin, Mitomycin oder Docetaxel, Thermochemotherapie mit Mitomycin (Synergo®), elektromotorische Medikamentenverabreichung (EMDA) mit Mitomycin, intravesikale Kombinationen von Zytostatika oder BCG mit Interferon alpha, eine photodynamische Therapie, Nanopartikel-gebundenes oder mit Hyaluronsäure konjugiertes Paclitaxel, onkolytische Adenoviren wie z.B. Nadofaragen Firadenovec (Instiladrin) oder Cretostimogen Grenadenorepvec (CG0070), und die intravenöse Verabreichung des Checkpoint-Inhibitors Pembrolizumab.6,13,14
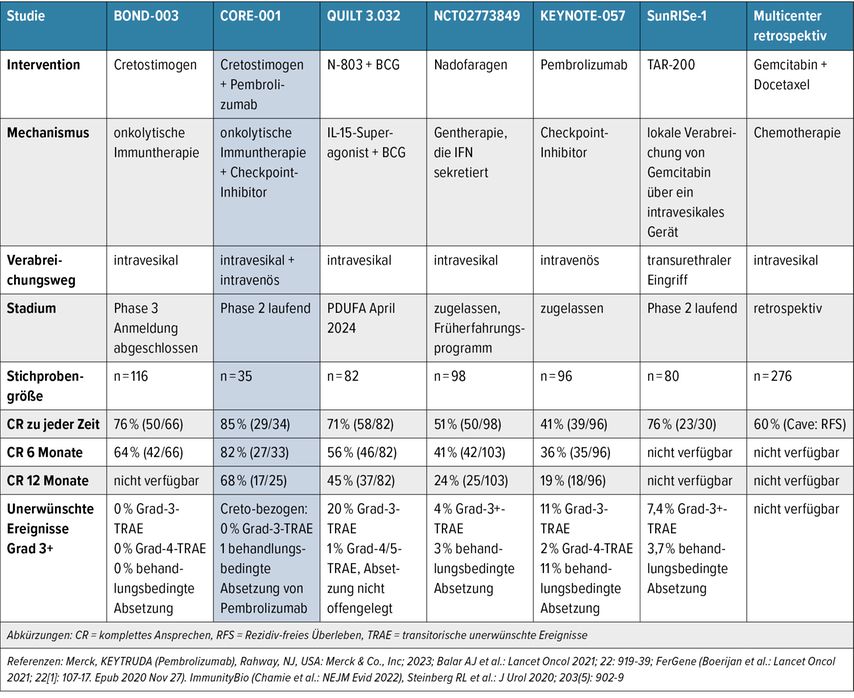
Tab. 1: Übersicht über Studien zum BCG-unresponsiven NMIBC mit CIS. Die Daten beruhen nicht auf direkten oder vergleichenden Studien. Es gibt Unterschiede im Studiendesign und bei den Probandenmerkmalen. Beim Vergleich von Daten aus verschiedenen Studien ist Vorsicht geboten. (Modifiziert nach Tyson M, präsentiert am SUO Annual Meeting 2023)
Eine Übersichtsarbeit aus dem Jahr 2020 von Li et al., welche CRR und RFR von diesen blasenerhaltenden Therapien zusammenfasst, zeigt mediane CRR-Raten in der Behandlung von CISenthaltenden Tumoren von 26% nach 6 Monaten, 17% nach 12 Monaten und 8% nach 24 Monaten nach Behandlung.
In den Studien, welche nur papilläre Tumoren einschlossen, fanden sich in der Regel höhere mediane RFR als bei CISenthaltenden Tumoren –67% nach 6 Monaten, 44% nach 12 Monaten und 10% nach 24 Monaten.9 Das mediane progressionsfreie Überleben war mit 91%hoch.
Gesamt gesehen, erreichten die untersuchten blasenerhaltenden Optionen bis dahin nur eine moderate Effizienz in BCG-Versagern, und von der FDA wurden von diesen neuen Therapieoptionen in den letzten Jahren nur systemische Pembrolizumab-Gabe und das intravesikal zu verabreichende onkolytische Adenovirus Nadofaragen Firadenovec (Instiladrin) zugelassen.15
Der PD-1-Inhibitor Pembrolizumab zeigte in der KEYNOTE-057-Studie in 101 BCG-Versagern mit CIS ± Ta/T1 eine CRR von 41% nach 3 Monaten, bei 46% dieser Patienten hielt die CRR für zumindest 12 Monate an (Tab. 1).12 In der Gruppe der Patienten mit papillären Tumoren ohne CIS zeigte sich eine RFR von 43,5% nach 12 Monaten. Im Vergleich fand sich in einer Phase-3-Studie mit Nadofaragen Firadenovec in 151 Patienten mit CIS ± Ta/T1 eine etwas höhere CRR von 53,4% nach 3 Monaten, 45,5% sprachen nach 12 Monaten weiterhin an.16 Insgesamt lag die Rate des „highgrade“ RFS bei 30%.
Eine heuer durch die FDA zugelassene blasenerhaltende Alternative für Patienten nach BCG-Versagen mit CIS ± Ta/T1ist der Interleukin-15-Superagonist Nogapendekin Alfa Inbakicept (Anktiva), welcher als Booster für das Immunsystem in Kombination mit BCG wirkt.17,18 Die CRR in der für die Studie ausschlaggebenden QUILT-3.032-Studie in 161 Patienten betrug 56% nach 6 und 45% nach 12 Monaten, Grad-3-Nebenwirkungen traten in 20% der Patienten auf.17
Andere neue Entwicklungen umfassen z.B. die Verabreichung von TAR-200, einem Arzneimittelverabreichungssystem, das die kontrollierte Freisetzung von Gemcitabin in die Blase ermöglicht, mit und ohne Kombination mit dem PD-1-Inhibitor Cetrelimab. Die TAR-200-Monotherapie zeigte hier in der Patientenkohorte mit CIS ± Ta/T1 eine Gesamt-CRR von 77%, Daten zu 6- und 12-Monats-CRR fehlen jedoch noch.19
Cretostimogen Grenadenorepvec als neue Therapieoption
Zu Beginn dieses Jahres erhielt außerdem das onkolytische Adenovirus Cretostimogen Grenadenorepvec die FDA-Zulassung (Fast-Track- und Breakthrough-Therapy-Designation-Status), nachdem vielversprechende Ergebnisse aus Phase-II-Studien und besonders in Kombination mit dem Checkpoint-Inhibitor Pembrolizumab vorlagen. Prinzipiell führen onkolytische Virustherapien durch Befall der Krebszelle mit dem Virus zu einer Zelllyse mit Freisetzung von Neoantigenen, welche die Aktivierung des Immunsystems stimulieren, und sie können daher vor allem in Kombination mit Immuntherapie potenziell synergistisch wirken.20 Cretostimogen Grenadenorepvec (CG0070) ist ein onkolytischer Adenovirus, der sich selektiv in Blasenkrebszellen mit defektem Retinoblastoma(Rb)-Signalweg repliziert. Das Adenovirus führt zusätzlich zur Expression von Granulozyten-Makrophagen-Kolonie-stimulierendem Faktor (GM-CSF), einem Zytokin, das eine Immunaktivierung auslöst.3 CG0070 wirkt also sowohl durch direkte Tumorzelllyse in Rb-defizienten Blasentumorzellen als auch durch immunmediierter Zelllyse durch GM-CSF-Produktion.
In einer initialen Phase-1/2-Studie mit 35 Patienten zeigte sich ein adäquates Sicherheitsprofil, wobei Patienten mit Rb-Defekten höhere Ansprechraten als jene ohne hatten (58% vs. 20%).21Die CG0070-Monotherapie wurde anschließend in einer Phase-II-Studie (BOND-002) in 45 Patienten mit BCG-Versagen und CIS ± Ta/T1 oder „highgrade“ Ta/T1 getestet, hier zeigte sich eine CRR bei nur CISenthaltenden Tumoren von 58% nach 6 Monaten, 50% bei CIS ± Ta/T1 enthaltenden Tumoren und 33% bei Ta/T1-Tumoren.4 Nach 12 Monaten betrug die CRR 28%. In der Phase-III-Studie BOND-003 mit 116 Patienten, welche nur Patienten mit CIS ± Ta/T1 einschloss, wurde eine CRR von 63,6% nach 6 Monaten berichtet.22 Ähnlich zu BCG wurde CG0070 in einem Induktionszyklus mit wöchentlichen intravesikalen Gaben für 6 Wochen verabreicht, welcher bei Nichtansprechen wiederholt werden konnte. Die Maintenance-Gaben wurden im ersten Jahr alle 3 Monate wöchentlich 3-mal und im zweiten Jahr alle 6 Monate wöchentlich 3-mal verabreicht (Tab. 1).4
Außergewöhnlich hohe Ansprechraten wurden in einer Phase-II-Kombinationsstudie (CORE-001) von CG0070 mit dem Checkpoint-Inhibitor Pembrolizumab in 35 Patienten mit CIS ± Ta/T1 erreicht. Das CG0070-Verabreichungsschema entsprach dem oben beschriebenen, und Pembrolizumab wurde alle 6 Wochen für insgesamt 2 Jahre verabreicht. Der Großteil der Patienten hatte ausschließlich CIS in der Harnblase (77,1%).5 Die CRR betrug 57,1% nach 12 Monaten und nach 24 Monaten 51,4%. Die mediane Dauer des Ansprechens wurde nicht erreicht, betrug jedoch über 21 Monate. Kein Patient zeigte eine Progression zu muskelinvasivem oder metastasiertem Blasenkrebs.5 In 20% wurde eine radikale Zystektomie durchgeführt, hier zeigten sich pT0 (1 Patient), pTa LG (1 Patient), pTa „highgrade“ (2 Patienten) und pTis (3 Patienten).8
Nebenwirkungen, welche CG0070 zugeschrieben wurden, umfassten typische Blasensymptome wie Blasenkrämpfe, Dysurie, Pollakisurie, Drang, Hämaturie und Nykturie, wovon keine mehr als Grad 2 erreichte.4 Nebenwirkungen durch Pembrolizumab entsprachen dem typischen Checkpoint-Inhibitor-Nebenwirkungsprofil mit z.B. Hypothyreose, Durchfall oder Arthralgien.12 5 Patienten (14,3%) entwickelten Pembrolizumab-zugeschriebene Grad-3-Nebenwirkungen. Kein Patient beendete die Studie aufgrund von Studienmedikation-induzierter Toxizität.
Obwohl derzeit in Europa noch keine Zulassung durch die EMA besteht, ist aufgrund der Ergebnisse und des vorteilhaften Risikoprofils in dieser Studie die Kombinationstherapie aus CG0070 und Pembrolizumab eine der vielversprechendsten neuen blasenerhaltenden Optionen für Patienten mit CISenthaltenden Tumoren nach BCG-Versagen.6
Literatur:
1 Babjuk M et al.: European Association of Urology guidelines on non-muscle-invasive bladder cancer (Ta, T1, and carcinoma in situ). Eur Urol 2022; 81(1): 75-94 2 Tokuyama N et al.: Prediction of non-muscle invasive bladder cancer recurrence using machine learning of quantitative nuclear features. Mod Pathol 2022; 35(4): 533-8 3 Ramesh N et al.: CG0070, a conditionally replicating granulocyte macrophage colony-stimulating factor–armed oncolytic adenovirus for the treatment of bladder cancer. Clin Cancer Res 2006; 12(1): 305-13 4 Packiam VT et al.: An open label, single-arm, phase II multicenter study of the safety and efficacy of CG0070 oncolytic vector regimen in patients with BCG-unresponsive non-muscle-invasive bladder cancer: interim results. Urol Oncol 2018; 36(10): 440-7 5 Li R et al.: Oncolytic adenoviral therapy plus pembrolizumab in BCG-unresponsive non-muscle-invasive bladder cancer: the phase 2 CORE-001 trial. Nat Med 2024; 1-8 6 Grabe-Heyne K et al.: Intermediate and high-risk non-muscle-invasive bladder cancer: an overview of epidemiology, burden, and unmet needs. Front Oncol 2023; 13: 1170124 7 Kates M et al.: Adaptive immune resistance to intravesical BCG in non-muscle invasive bladder cancer: implications for prospective BCG-unresponsive trials. Clin Cancer Res 2020; 26(4): 882-91 8 Catto JWF et al.: Radical cystectomy against intravesical BCG for high-risk high-grade nonmuscle invasive bladder cancer: results from the randomized controlled BRAVO-feasibility study. J Clin Oncol 2021; 39(3): 202-14 9 Li R et al.: Systematic review of the therapeutic efficacy of bladder-preserving treatments for non-muscle-invasive bladder cancer following intravesical Bacillus Calmette-Guérin. Eur Urol 2020; 78(3): 387-99 10 Steinberg RL et al.: Intravesical and alternative bladder-preservation therapies in the management of non-muscle-invasive bladder cancer unresponsive to bacillus Calmette-Guérin. Urol Oncol 2016; 34(6): 279-89 11 Hurle R et al.: Intravesical gemcitabine as bladder-preserving treatment for BCG unresponsive non-muscle-invasive bladder cancer. Results from a single-arm, open-label study. BJUI Compass 2020; 1(4): 126-32 12 Balar AV et al.: Pembrolizumab monotherapy for the treatment of high-risk non-muscle-invasive bladder cancer unresponsive to BCG (KEYNOTE-057): an open-label, single-arm, multicentre, phase 2 study. Lancet Oncol 2021; 22(7): 919-30 13 Melgarejo-Segura MT et al.: A systematic review of the efficacy of intravesical electromotive drug administration therapy for non-muscle invasive bladder cancer. Urol Oncol 2023; 41(4): 166-76 14 Heer R et al.: Photodynamic versus white-light-guided resection of first-diagnosis non-muscle-invasive bladder cancer: PHOTO RCT. Health Technol Assess 2022; 26(40): 1-144 15 Lee A: Nadofaragene firadenovec: first approval. Drugs 2023; 83(4): 353-7 16 Dinney CPN, Narayan VM: Efficacy of intravesical nadofaragene firadenovec for patients with Bacillus Calmette-Guerin-unresponsive nonmuscle-invasive bladder cancer: 5-year follow-up from a phase 3 trial. J Urol 2024; 212: 74-86 17 Chamie K et al.: IL-15 superagonist NAI in BCG-unresponsive non-muscle-invasive bladder cancer. NEJM Evid 2023; 2(1): EVIDoa2200167 18 Keam SJ: Nogapendekin alfa inbakicept: first approval. Drugs 2024; 84(7): 867-74 19 van Valenberg FJP et al.: The safety, tolerability, and preliminary efficacy of a gemcitabine-releasing intravesical system (TAR-200) in American Urological Association-defined intermediate-risk non-muscle-invasive bladder cancer patients: aphase 1b study. Eur Urol Open Sci 2024; 62: 8-15 20 Mondal M et al.: Recent advances of oncolytic virus in cancer therapy. Hum Vaccin Immunother 2020; 16(10): 2389-402 21 Friedlander TW et al.: Updated results of a phase I/II trial of intravesical CG0070 in patients with superficial bladder cancer after BCG failure. J Clin Oncol 2012; 30(5): 271 22 Tyson M et al.: First results from BOND-003: phase 3 study of cretostimogene grenadenorepvec monotherapy for patients with BCG unresponsive high-risk NMIBC with CIS+/-papillary (Ta/T1) tumors. Preprint at (2022)
Das könnte Sie auch interessieren:
Der Weg von neoadjuvanter Therapie und radikaler Zystektomie hin zum Blasenerhalt
Beim diesjährigen Post EAU 2025 Meeting in Wien präsentierte Dr. Kilian Gust, FEBU (Medizinische Universität Wien), ein aktuelles Update zur systemischen Therapie des muskelinvasiven ...
Highlights zum Prostatakarzinom vom EAU in Madrid
Zahlreiche im Rahmen des EAU-Kongresses 2025 in Madrid vorgestellte Arbeiten beschäftigten sich mit Diagnostik und Management des Prostatakarzinoms in allen Stadien der Erkrankung. So ...
Neues zur Li-ESWT in der Therapie der ED
Zwei Arbeiten zeigen den praktischen Einsatz der extrakorporalen Stoßwellentherapie mit niedriger Intensität (Li-ESWT; „low-intensity extracorporal shockwave therapy“) in der Therapie ...