Arzneimittelinteraktionen bei Blasenpatienten
Autor:
Prof. Dr. Martin C. Michel
Institut für Pharmakologie
Johannes-Gutenberg-Universität Mainz
E-Mail: marmiche@uni-mainz.de
Arzneimittelinteraktionen (AI) sind eine häufige Ursache von unerwünschten Wirkungen (UAW), teilweise sogar von Krankenhauseinweisungen. Basierend auf Daten der deutschen Krankenversicherungen müssen wir davon ausgehen, dass die Hälfte aller Patienten mit überaktiver Harnblase (OAB) im Schnitt sieben verschiedene Medikamente einnimmt. Da sind AI vorprogrammiert. Wie können wir entsprechenden Schaden verhindern oder zumindest minimieren?
Keypoints
-
Eine vollständige Medikamentenanamnese ist der Schlüssel zur Vorbeugung, Erkennung und Behandlung von Arzneimittelinteraktionen.
-
Wenn sich die Wirksamkeit oder Verträglichkeit eines Medikaments ändert, sollten Änderungen des Medikationsschemas überprüft werden
-
Es ist wichtig, mit anderen behandelnden Ärzten Rücksprache zu halten, um auf Arzneimittelinteraktionen eingehen zu können.
Das Problem
Daten der deutschen Krankenversicherungen aus 2019 zeigen, dass die Gruppe der mindestens 65 Jahre alten Personen durchschnittlich sieben verschiedene Medikamente einnimmt und 72,6% von ihnen mindestens fünf verschiedene Wirkstoffe.4 Polypharmazie ist also häufig, selbst wenn man rezeptfreie Medikamente nicht mitzählt. Deshalb sollte es niemanden wundern, dass AI ebenfalls häufig sind. Und dies hat Folgen: Verschiedene Studien zeigen, dass AI zu relevanten UAW führen. Eine Metaanalyse von 13 solcher Studien fand, dass AI die primäre Ursache für 1,1% aller Krankenhausaufnahmen sind; bei Patienten, die wegen einer UAW aufgenommen wurden, war eine AI bei 22,2% die primäre Ursache.2 Die Dunkelziffer ist wahrscheinlich deutlich höher, da AI häufig nicht erkannt werden. Und die viel häufigeren UAW, die nicht zu einer Krankenhausaufnahme führten, sind da noch nicht mitgezählt.
Der typische OAB-Patient, der eine medikamentöse Behandlung erhält, ist in den Sechzigern. Damit erhalten mehr als 50% wahrscheinlich 5 oder mehr Arzneimittel. In Beobachtungsstudien werden von den teilnehmenden Ärzten meist aber nur 2–3 Komedikationen angegeben, häufig gar keine. Dabei erhalten nach Versicherungsdaten nur 6,5% der Patienten ab 65 Jahren keine Medikamente.4 Begleitmedikationen werden also im Praxisalltag anscheinend nur teilweise erfasst. Für nicht erfasste Begleitmedikationen kann das Risiko für AI nicht abgeschätzt werden. Falls UAW auftreten, kann nicht geklärt werden, ob und inwieweit AI die Ursache sind; damit ist ein zielgerichtetes Management möglicher UAW nur begrenzt möglich.
Wie entstehen AI?
AI können zwei prinzipielle Ursachen haben, die sich gegenseitig aber nicht ausschließen. Zum einen kann ein Arzneimittel A die Wirkspiegel eines Arzneimittels B beeinflussen; dies wird als pharmakokinetische AI bezeichnet und kann auf allen Ebenen der Pharmakokinetik erfolgen, d.h. Aufnahme, Verteilung, Metabolismus und Ausscheidung von Wirkstoff B. Am häufigsten erfolgen pharmakokinetische AI auf der Ebene des Metabolismus, insbesondere durch Enzyme der Cytochrom-P450(CYP)-Familie wie z.B. CYP 3A4. Beispielsweise induziert das Antiepileptikum Carbamazepin die Expression von CYP 3A4, was zu einem verstärkten Abbau des Immunsuppressivums Cyclosporin und damit zur Transplantatabstoßung führen kann.5
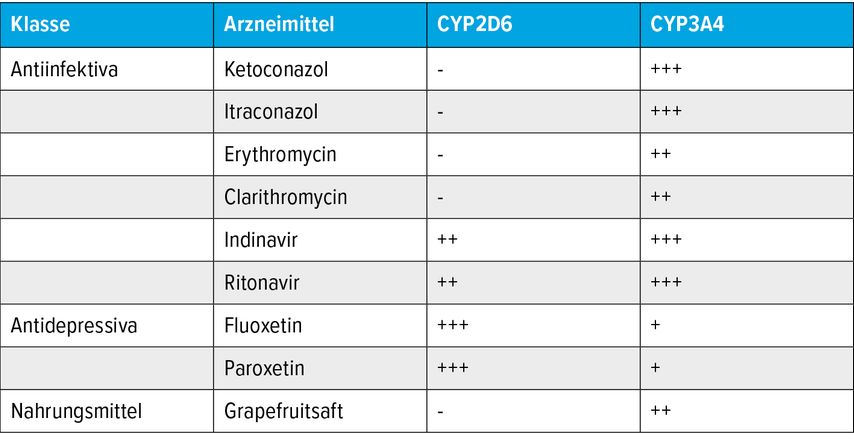
Pharmakokinetische AI sind typischerweise von der chemischen Struktur eines Wirkstoffs abhängig, betreffen also nicht eine gesamte Wirkstoffklasse; z.B. sind einige Antimuskarinika in der OAB-Behandlung Substrate von CYP 3A4, andere aber nicht (Tab. 1).
Darüber hinaus kann Arzneimittel A die Wirkung von Arzneimittel B beeinflussen, ohne dessen Wirkspiegel zu verändern. Meist beruht dies darauf, dass beide Arzneimittel über unterschiedliche Angriffspunkte auf dasselbe Organ bzw. dieselbe Körperfunktion wirken. Dies wird als pharmakodynamische AI bezeichnet. Das betrifft in der Regel alle Mitglieder einer Wirkstoffklasse.
Vom Ergebnis her kann eine AI zu einer vermehrten oder einer verminderten Wirkung von Wirkstoff B führen. Wenn diese Veränderung erwünscht ist, sprechen wir meist von einem Synergismus; dies macht man sich häufig zunutze. Beispiele hierfür sind die Kombination eines β-Lactam-Antibiotikums mit einem Lactamase-Hemmstoff wie Amoxicillin mit Clavulansäure (pharmakokinetische AI) oder Sulfamethoxazol mit Trimethoprim (pharmakodynamische AI) in der Infektbehandlung oder α-Blocker mit 5α-Aromatasehemmer (pharmakodynamische AI) bei der Progressionshemmung des benignen Prostatasyndroms. AI können also unser Freund sein. Häufiger sind aber AI, die zu UAW führen; auf diese konzentriere ich mich im Folgenden, insbesondere in ihrer Bedeutung für typische OAB-Medikamente.
Antimuskarinika
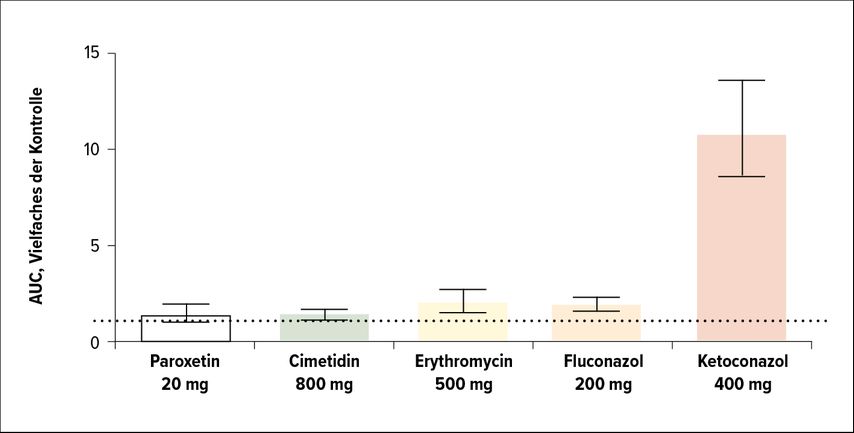
Antimuskarinika sind die weltweit am häufigsten eingesetzte Wirkstoffgruppe zur Behandlung der OAB. In den deutschsprachigen Ländern haben wir die Auswahl zwischen verschiedenen Substanzen wie Darifenacin, Fesoterodin, Oxybutynin, Propiverin, Solifenacin, Tolterodin oder Trospium (Tab. 1). Die häufigste UAW ist die Mundtrockenheit, aber auch Verstopfung ist häufig, und solche UAW sind eine häufige Ursache von Behandlungsabbrüchen. Während für Trospium keine pharmakokinetische AI bekannt ist, werden alle anderen Muskarinantagonisten durch CYP2D6 und/oder CYP3A4 metabolisiert. Die gleichzeitige Einnahme von Medikamenten, die diese Enzyme hemmen, kann die Wirksamkeit von Antimuskarinika erhöhen. Daher gibt es spezifische Empfehlungen dahin gehend, Dosierungsschemata bei Vorliegen einer solchen Komedikation anzupassen (Tab. 1). Häufig verwendete CYP2D6-Inhibitoren sind antivirale Proteaseinhibitoren wie Indinavir und selektive Serotonin-Aufnahme-Inhibitoren wie Fluoxetin oder Paroxetin (Tab. 2). Zu den potenten CYP3A4-Inhibitoren zählen Azolantimykotika (z.B. Ketoconazol), Makrolidantibiotika (z.B. Erythromycin), Protease-Inhibitoren und einige selektive Serotonin-Aufnahme-Inhibitoren, aber auch Grapefruitsaft (Tab. 2). Beispielsweise kann die gleichzeitige Einnahme solcher Medikamente die Wirksamkeit von Darifenacin um das 10-Fache erhöhen (Abb. 1).6
Abb. 1: Erhöhte Wirkspiegel von Darifenacin in Kombination mit einigen Antiinfektiva (nach Witte LPW et al.)6
Weniger oft erkannt, aber potenziell medizinisch relevanter sind Einschränkungen der kognitiven Funktion durch Antimuskarinika.3 Auch wenn es für die OAB-Präparate keine spezifischen Studien gibt, ist allgemein anerkannt, dass das Risiko für anticholinerge UAW mit der Anzahl von verabreichten Substanzen mit hemmender Wirkung auf Muskarinrezeptoren ansteigt, was als Konzept der anticholinergen Gesamtbelastung („total anticholinergic load“) bekannt ist; je mehr solche Substanzen ein Patient einnimmt, desto höher die Gesamtbelastung und das Risiko für kognitive Einschränkungen.1 Die anticholinerge Gesamtbelastung ist eine typische pharmakodynamische AI. Zu den Substanzen mit anticholinergen Wirkungen, die außerhalb der Urologie eingesetzt werden, gehören Vertreter der Analgetika, Antiarrhythmika, Antiemetika, Antihistaminika, Antihypertensiva, Anti-Parkinson Mittel, Antispasmodika, Bronchodilatatoren, Präparate zur Behandlung von Magengeschwüren sowie viele Antidepressiva und Neuroleptika.
Die anticholinerge Gesamtbelastung ist nicht nur eine mögliche Ursache von UAW, insbesondere kognitiven Einschränkungen; man kann sich auch fragen, ob ein Patient mit OAB-Symptomen trotz bereits bestehender relevanter anticholinerger Belastung ein guter Kandidat für die Behandlung mit einem Mittel aus der Gruppe der Antimuskarinika ist.
β-3-Adrenozeptoragonisten
Der einzige derzeit in Europa zugelassene β-3-Adrenozeptoragonist ist Mirabegron. Im Gegensatz zu Muskarinantagonisten hat Mirabegron ein geringes Risiko für klinisch relevante pharmakodynamische AI. Die gleichzeitige Anwendung von starken CYP3A4-Inhibitoren kann jedoch die Wirksamkeit von Mirabegron erhöhen. Diese Wechselwirkung ist aber bei Patienten mit normaler Nierenfunktion von begrenzter klinischer Relevanz. Bei gleichzeitiger leichter bis mittelschwerer Nierenfunktionsstörung (GFR 60–89 bzw. 30–59ml/min/1,73m2) sollte die Mirabegron-Dosis jedoch auf 25mg begrenzt werden, wenn potente CYP3A4-Inhibitoren verwendet werden.
Literatur:
1 Ancelin ML et al.: Non-degenerative mild cognitive impairment in elderly people and use of anticholinergic drugs: longitudinal cohort study. Br Med J 2006; 332: 455-8 2 Dechanont S et al.: Hospital admissions/visits associated with drug–drug interactions: a systematic review and meta-analysis. Pharmacoepidemiol Drug Saf 23: 2014; 489-97 3 Müderrisoglu AE et al.: Cognitive and mood side effects of lower urinary tract medication. Expert Opin Drug Safety 2019; 18: 915-23 4 Selke Krulichová I et al.: Trends and patterns in EU(7)-PIM prescribing to elderly patients in Germany. Eur J Clin Pharmacol 2021; 77(10): 1553-61 5 Soto Alvarez J et al.: Effect of carbamazepine on cyclosporin blood level. Nephron 1991; 58: 235-6 6 Witte LPW et al.: Muscarinic receptor antagonists for overactive bladder treatment: does one fit all? Current Opinion in Urology 2009; 19: 13-9
Das könnte Sie auch interessieren:
Aktuelle Entwicklungen und Erkenntnisse beim Urothelkarzinom
Auf dem diesjährigen Genitourinary Cancers Symposium der American Society of Clinical Oncology (ASCO-GU-Kongress) wurden bedeutende Fortschritte in der Diagnose und Behandlung des ...
Aktuelles aus der 7. Version der S3-Leitlinie: wesentliche Leitlinienänderungen
Im Mai 2024 wurde die Prostatakarzinom-S3-Leitlinie unter der Federführung der Deutschen Gesellschaft für Urologie e.V. (DGU) im Rahmen des Leitlinienprogramms Onkologie in ihrer 7. ...
Neues vom ASCO GU zum Prostatakarzinom
Im Rahmen des ASCO GU 2025 in San Francisco wurden eine Vielfalt von neuen praxisrelevanten Studien zum Prostatakarzinom präsentiert. Mit Spannung wurde unter andem auch auf die finalen ...
%20bei%20Antimuskarinika%20nach%20Witte%20LPW%20et%20al..jpg)