„Entscheidend ist eine Risikostratifikation der Patient:innen“
Unser Gesprächspartner:
Assoz. Prof. Dr. Christian Dejaco
Klinische Abteilung für Rheumatologie und Immunologie, Medizinische Universität Graz
Rheumatologischer Dienst des Südtiroler Sanitätsbetriebes, Bruneck
Das Interview führte Dr. Felicitas Witte
Eine Pilotstudie kam zu dem Schluss, dass eine 12-monatige Behandlung mit Tocilizumab in Kombination mit einer nur 8-wöchigen Prednisongabe bei Patient:innen mit Riesenzellarteriitis Remission einleiten und aufrechterhalten kann.1 Prof. Christian Dejaco erklärt, wie und wann Glukokortikoide reduziert werden sollen.
In der Studie der Harvard Medical School kamen alle 30 Patient:innen innerhalb von 4 Wochen in Remission. 23 von ihnen waren dies noch nach einem Jahr.1
Was halten Sie von der in der Studie angewandten Therapiestrategie?
C. Dejaco: Wir müssen für Patient:innen mit Riesenzellarteriitis nach Strategien suchen, um die Zeit der Glukokortikoidbehandlung zu verkürzen und damit die Gesamtmenge des Cortisons zu begrenzen. Bei der rheumatoiden Arthritis hat diese Strategie seit Langem Eingang in die EULAR-Leitlinien gefunden,2 und auch bei anderen rheumatischen Systemerkrankungen versuchen wir, Glukokortikoide so wenig wie möglich, aber so viel wie notwendig zu verwenden. Ob wir die in der Studie beschriebene Therapiestrategie in den klinischen Alltag übernehmen können, wird sich zeigen. Als Nächstes brauchen wir eine randomisierte Studie, in der eine konventionelle Cortisonbehandlung mit einer verkürzten Therapie direkt verglichen wird, idealerweise placebokontrolliert.
7 Patienten in der Studie hatten einen Rückfall. Wurde das Cortison doch zu früh ausgeschlichen?
C. Dejaco: Auch in der GiACTA-Studie waren weder in der Gruppe mit Tocilizumab plus Glukokortikoide über 6 Monate noch in der Gruppe mit Glukokortikoiden über 52 Wochen plus Tocilizumab-Placebo alle Patient:innen bis zum Ende in Remission.3 Vermutlich würde sich mit keiner der aktuell verfügbaren Strategien ein Rezidiv bei allen Patient:innen verhindern lassen. Immerhin lassen sich die meisten Rezidive gut durch eine kurzfristige Erhöhung der Glukokortikoiddosis beherrschen.
Tipps für Vaskulitis-Interessierte:
Internationaler Kongress zur Großgefäßvaskulitis (RZA und Takayasu-Arteriitis) und Polymyalgia rheumatica am 2. und 3. Oktober 2024 in Innsbruck
Europäischer Bildgebungskurs zur Großgefäßvaskulitis vom 3. bis 5. Oktober in Innsbruck
Nähere Informationen unter: www.eulvic.eu
Würden Sie jetzt auch bei Ihren Patient:innen versuchen, das Prednison früher auszuschleichen?
C. Dejaco: Das Wichtigste ist, bei Patient:innen mit neu diagnostizierter Riesenzellarteriitis eine Risikostratifikation vorzunehmen. Gemäß EULAR-Leitlinien wird empfohlen, bei Patient:innen mit erhöhtem Risiko für glukokortikoidinduzierte Nebenwirkungen von Beginn an eine Therapie mit Tocilizumab einzuleiten und Glukokortikoide innerhalb von 6 Monaten auszuschleichen.2,4 Da wir viele ältere, komorbide Patient:innen mit erhöhtem Risiko für Nebenwirkungen haben, behandeln wir letztendlich viele Patient:innen mit Tocilizumab und versuchen, die Dauer der Cortisonbehandlung zu minimieren. Bei besonders hohem Risiko für glukokortikoidinduzierte Nebenwirkungen – zum Beispiel bei Patient:innen mit schwerer Osteoporose und Diabetes – kann man durchaus versuchen, das Cortison auch schon früher auszuschleichen. Das entspricht zwar nicht den aktuellen Leitlinien, aber ich halte das für gerechtfertigt, wenn man Nutzen gegen Risiken sorgfältig abgewogen hat.
Gibt es keine anderen Strategien, die Cortisondosis zu reduzieren?
C. Dejaco: Tatsächlich wurde in einer anderen Pilotstudie versucht, auf orale Glukokortikoide komplett zu verzichten. In der sogenannten GUSTO-Studie erhielten 18 Patient:innen mit neu diagnostizierter Riesenzellarteriitis initial 3 Pulse mit Prednisolon à 500mg.5 Anschließend wurde eine einzelne Infusion mit Tocilizumab verabreicht, und danach erhielten die Patient:innen Tocilizumab subkutan über einen Zeitraum von 52 Wochen. Der primäre Endpunkt war das Erreichen einer Remission innerhalb von 31 Tagen und das Fehlen eines Rezidivs bis zur Woche 24. Leider war nur einer von 4 Patienten nach einem Monat in Remission. Nach 6 Monaten hatten 14 von 18 Patient:innen die Remission erreicht. Beunruhigend an der Studie war, dass ein Patient eine anteriore ischämische Optikusneuropathie entwickelte. Vielleicht wirkt Tocilizumab bei der Riesenzellarteriitis erst verzögert und es braucht daher Glukokortikoide, um die Erkrankung rasch in Remission zu bringen und auch zu halten.
Welche neuen Medikamente gegen Riesenzellarteriitis halten Sie für vielversprechend und warum?
C. Dejaco: Es werden einige vielversprechende Präparate getestet. Für den Interleukin-17-Hemmer Secukinumab wurde in einer Phase-II-Studie gezeigt, dass durch das Medikament bei fast 60% der Patient:innen eine anhaltende Remission bis zur 52. Woche erreicht werden kann, hingegen nur bei 8% in der Placebogruppe.6 Mit Secukinumab laufen jetzt zwei Phase-III-Studien.7,8 Ich kann mir gut vorstellen, dass das Medikament für die Riesenzellarteriitis zugelassen wird. Eine weitere vielversprechende Substanz ist Upadacitinib, die auch gerade in einer Phase-III-Studie getestet wird.9
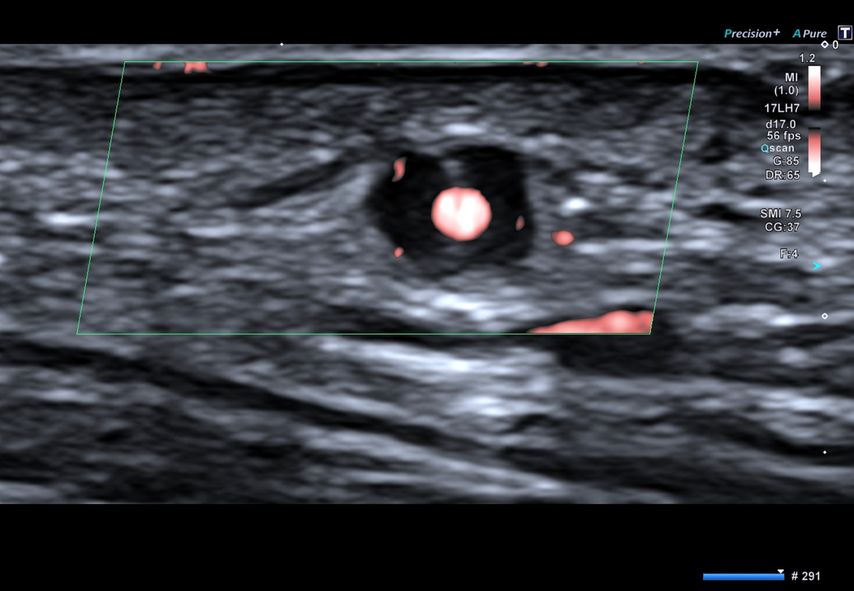
Abb. 1: Ultraschallbild einer Arteria temporalis eines Patienten mit Riesenzellarteriitis im Querschnitt. Dargestellt ist das charakteristische „Halo“-Phänomen, das der entzündlichen Schwellung der Arterienwand entspricht
Wir können also darauf hoffen, Patient:innen mit Riesenzellarteriitis in Zukunft Glukokortikoide zu ersparen?
C. Dejaco: Ja. Während früher eine Glukokortikoidbehandlung über viele Monate und Jahre die einzige Behandlungsmöglichkeit war und dadurch bei sehr vielen Patient:innen glukokortikoidinduzierte Nebenwirkungen in Kauf genommen werden mussten, ist mit Tocilizumab ein glukokortikoidsparendes Medikament bereits verfügbar und noch weitere sind am nicht sehr weit entfernten Horizont. Die Behandlungsdauer mit Glukokortikoiden kann hoffentlich immer weiter reduziert werden. Entscheidend ist eine Stratifizierung der Patient:innen, wobei auch mithilfe der Bildgebung unterschiedliche Subtypen der Erkrankung identifiziert werden können und dadurch für die Patient:innen ein individueller Behandlungs- und Monitoringplan entwickelt werden kann.10
Literatur:
1 Unizony S et al.: Lancet Rheumatol 2023; 5(12): e736-42 2 Smolen JS et al.: Ann Rheum Dis 2023; 82(1): 3-18 3 Stone JH et al.: N Engl J Med 2017; 377: 317-28 4 Hellmich B et al.: Ann Rheum Dis 2020; 79: 19-30 5 Christ L et al.: Lancet Rheumatol 2021; 3(9): e619-26 6 Venhoff N et al.: Lancet Rheumatol 2023; 5(6): e341-50 7 ClinicalTrials.gov, ID NCT05380453 8 ClinicalTrials.gov, ID NCT04930094 9 ClinicalTrials.gov, ID NCT03725202 10 Dejaco C et al.: Treat-to-target recommendations in giant cell arteritis and polymyalgia rheumatica. Ann Rheum Dis 2024; 83(1): 48-57
Das könnte Sie auch interessieren:
Neue Therapieansätze für Arthrose
Dass Zellen altern, könnte eine entscheidende Rolle bei der Entstehung von Arthrose spielen. Welche Mechanismen dahinterstecken und welche Ansätze sich für neue Therapien ergeben, ...
Fertilität und Schwangerschaft bei entzündlicher Arthritis
Auf der 13. International Conference on Reproduction, Pregnancy and Rheumatic Diseases (RheumaPreg 2025) in Wien präsentierte Prof. Dr. Radboud Dolhain (Rotterdam, NL) aktuelle ...
Therapieauswahl nach pulmonalem Inflammations- und Fibrosemuster
Da Fibrose und Entzündung in unterschiedlichem Ausmaß zu Lungenbeteiligungen bei rheumatologischen Erkrankungen beitragen, werden im klinischen Alltag Methoden gebraucht, um beide ...