Therapeutische Antikörper in der Hämostaseologie
Autor:
Univ.-Prof. Dr. Paul Knöbl
Klin. Abt. für Hämatologie und Hämostaseologie
Universitätsklinik für Innere Medizin 1 Medizinische Universität Wien
E-Mail: paul.knoebl@muv.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
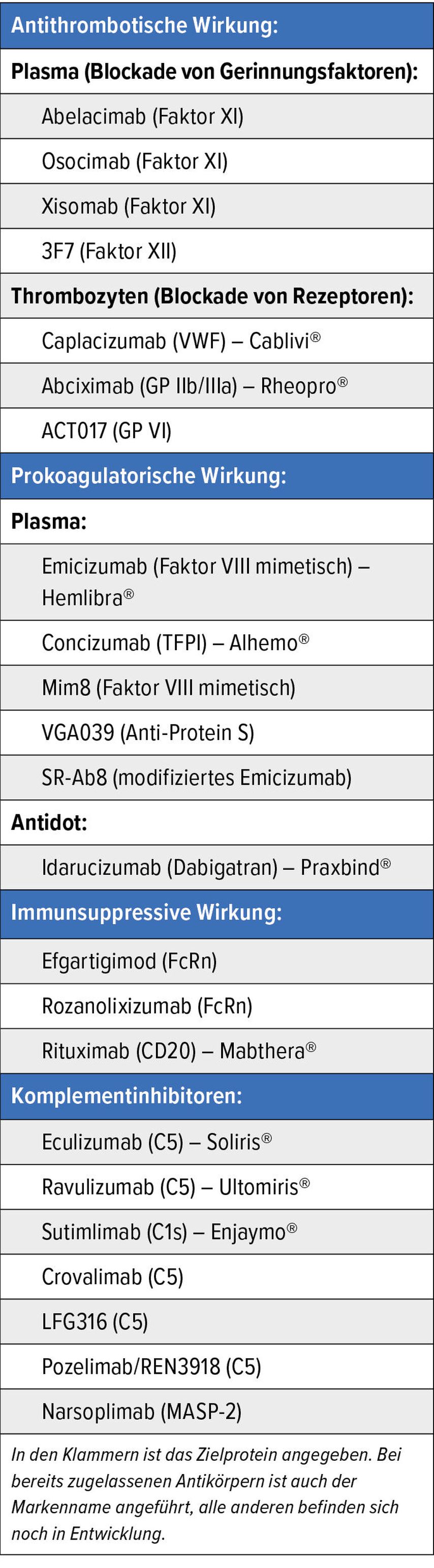
So wie in vielen anderen medizinischen Bereichen stellen therapeutische Antikörper auch in der Hämostaseologie wichtige therapeutische Möglichkeiten dar, sie haben bei manchen Erkrankungen einen Paradigmenwechsel gebracht und stellen herkömmliche Behandlungskonzepte zur Diskussion. Dieser Artikel fasst die wichtigsten neuen therapeutischen Antikörper in der Hämostaseologie und die Ergebnisse rezenter Studien zusammen. Generell können diese Antiköper nach ihrer Funktion und nach ihrem Angriffspunkt im Gerinnungssystem unterschieden werden (Tab. 1).
Emicizumab
Emicizumab (Hemlibra®) ist ein bispezifischer, Faktor-VIII-mimetischer humanisierter therapeutischer Antikörper, der von FDA und EMA zur Behandlung von Patienten mit kongenitaler Hämophilie A mit und ohne Inhibitoren zugelassen ist. Der Antikörper ist hoch effektiv in der Prävention von Spontanblutungen. Er wird zur Blutungsprophylaxe als subkutane Injektion in 1- bis 4-wöchigen Intervallen verabreicht und hat eine lange Plasma-Halbwertszeit (646 Stunden=4 Wochen). Dies stellt für Hämophile eine wesentliche Verbesserung der Lebensqualität dar. Es sind nun keine häufigen i.v. Injektionen von Faktor-VIII-Konzentraten mehr notwendig. Emicizumab ist auch bei Auftreten von inhibitorischen Hemmkörpern gegen Faktor VIII wirksam. Auch kommt es nicht mehr zur Stigmatisierung von hämophilen Kindern aufgrund von Einschränkungen durch Erkrankung und Therapie (Hämophile sollten ja vom Kindesalter an eine Blutungsprophylaxe erhalten). Auch kleinere Operationen sind unter Emicizumab möglich.
Auch für die erworbene Hämophilie A (für die Emicizumab nicht explizit zugelassen ist) wurden positive Wirkungen des Antikörpers berichtet (vor allem von der Forschungsgruppe an der MedUni Wien). Rezent wurden Daten aus Japan publiziert, die dort zu einer Zulassungserweiterung geführt haben. Auch die Ergebnisse der deutschen und österreichischen AHA-EMI-Studie (publiziert in Lancet Haematology) zeigten eine hochsignifikante Reduktion der Blutungsraten und ein verlängertes Gesamtüberleben, vor allem, weil eine weniger radikale immunsuppressive Therapie gewählt werden kann.
Dieses Konzept hat bereits einen Paradigmenwechsel in der Behandlung der erworbenen Hämophilie A bewirkt und ist am hämostaseologischen Zentrum des Wiener AKH bereits Standardtherapie. Die meisten der (oft älteren) Patient:innen können damit sicher ambulant behandelt werden. Allerdings ist große Expertise bei Dosierung und Labormonitoring nötig, da spezielle Labormethoden notwendig sind.
Mim8: neuer FVIII-mimetischer Antikörper
Mim8 ist ein FVIII-Mimetikum der nächsten Generation, das zurzeit in klinischen Studien an Patient:innen mit Hämophilie A mit und ohne Inhibitoren getestet wird (FRONTIER-Programm der Firma Novo Nordisk). Dazu wurden bereits Daten aus frühen Studien (Phase I und II) zur Sicherheitsprüfung einer Einzeldosis bei gesunden Probanden und zur multiplen aszendierenden Dosierung publiziert, die keine Sicherheitsbedenken zeigten. Die Ergebnisse weiterer klinischer Studien werden in Kürze erwartet.
Concizumab
Concizumab (Alhemo®) ist ein therapeutischer Antikörper, der den Tissue-Factor-Pathway-Inhibitor (TFPI) blockiert und damit eine Verstärkung des extrinsischen Gerinnungsweges bewirkt. Er ist also nicht auf eine bestimmte Form der Hämophilie limitiert, sondern könnte auch bei anderen Gerinnungsstörungen wirksam sein. Studiendaten gibt es zur Blutungsprophylaxe bei Hämophilie A und B mit und ohne Inhibitoren. Concizumab wird täglich als subkutane Injektion mit einem Pen appliziert und ist bisher in Kanada und Australien zugelassen, Verfahren bei der FDA und EMA laufen.
Antikoagulatorische Anti-Faktor-XI-Antikörper
Abelacimab, Osocimab und Xisomab sind monoklonale Antikörper gegen den Gerinnungsfaktor XI, sie blockieren die Aktivierung bzw. Wirkung von Faktor XI. Eine i.v. Gabe solcher Antikörper bewirkt eine sofortige dosisabhängige Reduktion der Faktor-XI-Aktivität. Es wird erwartet, dass dadurch eine effiziente Antikoagulation mit deutlich geringerer Blutungsneigung als mit konventionellen Antikoagulanzien erreicht werden kann. Diese Antikörper haben eine sehr lange Halbwertszeit und können daher als monatliche i.v. Injektion verabreicht werden. Eine Studie zur Thromboseprophylaxe nach Kniegelenksersatz mit Abelacimab wurde 2021 im New England Journal of Medicine publiziert. Weitere Studien bei Patienten mit tumorassoziierter Thromboembolie werden gerade durchgeführt. Auch mit Osocimab wurde eine orthopädische Studie durchgeführt, mit Xisomab gab es Studien zur Antikoagulation bei extrakorporaler Zirkulation.
Eine Metaanalyse zu Faktor-XI-Inhibitoren aus 2022 legt eine bessere antithrombotische Wirkung als Enoxaparin nahe. Die Rate an klinisch relevanten schweren Blutungen war tendenziell geringer.
Caplacizumab
Caplacizumab (Cablivi®) ist ein Nanobody gegen die A1-Domänen des Von-Willebrand-Faktors (VWF). Caplacizumab blockiert die Bindung von Thrombozyten an den VWF und hat damit einen unmittelbaren Effekt auf die Bildung der Mikrothromben, die die Organschädigungen bei der thrombotisch-thrombopenischen Purpura (TTP) bewirken. Es führt zu einer raschen Normalisierung der Thrombozytenzahlen, zu deutlich weniger Krankheitsexazerbationen, zu einem geringeren Ressourcenverbrauch und zu einer geringeren Mortalität der TTP. Es ist zur Behandlung der Autoimmun-TTP zugelassen. Caplacizumab wird täglich in einer Dosis von 10mg s.c. verabreicht, solange die ADAMTS13-Aktivität <10% vermindert ist. Parallel dazu wird mit Rituximab die Autoantikörper-Nachbildung verhindert. Als mögliche Nebenwirkung besteht eine geringe Neigung zu Schleimhautblutungen, lebensbedrohliche Blutungen sind selten.
Rezente Daten aus Österreich, Deutschland, Frankreich, Spanien und Großbritannien zeigen Möglichkeiten auf, den Einsatz von Caplacizumab zu optimieren und die Kosten zu senken. Vor allem sollte Caplacizumab frühzeitig eingesetzt werden, um positive Effekte zu erzielen; ein vorzeitiges Absetzen erhöht das Risiko für Rezidive; eine Verlängerung der Dosisintervalle nach Stabilisierung der Erkrankung ist möglich. Vor allem konnte gezeigt werden, dass es möglich ist, die TTP auch ohne Plasmaaustausch (eine früher als unabdingbar angesehene Therapie) zu behandeln. Dies stellt einen absoluten Paradigmenwechsel im TTP-Management dar und ist mittlerweile am hämostaseologischen Zentrum am AKH Wien ebenfalls Standard.
Efgartigimod und Rozanolixizumab zur Therapie der Autoimmunthrombopenie
Efgartigimod und Rozanolixizumab sind Antikörper, die gegen den neonatalen Fc-Rezeptor gerichtet ist. Sie bewirken eine Beschleunigung des IgG-Metabolismus und ein Absenken der IgG-Spiegel. Daher bestehen große Hoffnungen auf positive Effekte bei Autoimmunerkrankungen, das Therapiekonzept stellt jedoch keine kausale Behandlung dar. Bisher wurden Studien bei Autoimmunthrombopenie durchgeführt, diese zeigen aber inkonsistente Resultate, sodass die weitere Entwicklung abgewartet werden muss.
Komplementinhibitoren
Eine therapeutische Blockade des Komplementsystems hat bei manchen komplementmediierten Erkrankungen eindeutig positive Effekte. Die Blockade von C5 durch Eculizumab oder Ravulizumab ist die Therapie der Wahl bei der paroxysmalen nächtlichen Hämoglobinurie (PNH) und bei komplementmediierten thrombotischen Mikroangiopathien. Dadurch können schwere permanente Organschäden wirksam verhindert werden.
Die Blockade von C1s durch den Antikörper Sutimlimab kann die Transfusionsabhängigkeit und Nebenwirkungen von Patienten mit Kälteagglutininerkrankung signifikant reduzieren und ist dafür auch seit Kurzem zugelassen. Weitere Antikörper gegen Komplementbestandteile werden zurzeit in klinischen Studien untersucht.
Fazit: Breites Einsatzgebiet für Antikörpertherapie
Verschiedene therapeutische Antikörper für Erkrankungen des hämostatischen Systems sind schon länger verfügbar. In den letzten Jahren wurden viele neue Antikörper entwickelt, die in großen Studien untersucht wurden. Einige dieser Präparate haben bereits einen Paradigmenwechsel in der Behandlung seltener und komplexer Gerinnungsstörungen bewirkt. Weitere Antikörper mit interessanten Wirkmechanismen sind in Entwicklung.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
Die Thalassämie nimmt hierzulande an Bedeutung zu
Die medizinische Betreuung von Thalassämiepatient:innen hat sich in den letzten Jahrzehnten deutlich gebessert und benötigt insbesondere bei symptomatischen Patient:innen eine ...
Interessante Daten zu neuen Therapieoptionen
Am hämatologischen Jahreskongress der American Society of Hematology (ASH) wurden Updates von Studien wie TRIANGLE und POLARIX präsentiert, ohne dass sich hierbei grundlegende neue ...
Therapie des multiplen Myeloms
Dank vielfältiger neuer Therapieoptionen verbessert sich die Prognose beim multiplen Myelom (MM) stetig. Die bereits verfügbaren Therapien können oft eine langfristige, zum Teil auch ...