
Wovon hängt der Erfolg von Allergenimmuntherapiestudien ab?
Autorin:
Priv.-Doz. Dr. Petra Zieglmayer
Fachärztin für Hals-, Nasen- & OhrenheilkundeDepartement für Allgemeine Gesundheitsberufe
Kompetenzzentrum Allergologie & Immunologie
Karl Landsteiner Privatuniversität für Gesundheitswissenschaften, Krems
E-Mail: petra.zieglmayer@kl.ac.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Studien zur Allergenimmuntherapie sind nicht ganz einfach zu planen und durchzuführen. Die Unwägbarkeiten der natürlichen Allergenexposition, die saisonal schwankend und individuell ganz unterschiedlich sein können, tragen einerseits zu einem variablen Ergebnis bei. Andererseits sind die Immuntherapeutika, die wir bis heute zur Behandlung unserer Allergiepatienten verwenden, ebenfalls Naturprodukte und daher sehr heterogen in ihrer Zusammensetzung und Wirkung. Daher gibt es einiges zu beachten, um verwertbare Studienergebnisse erzielen zu können.
Keypoints
-
Saisonale Expositionsschwankungen beeinflussen Heuschnupfenbeschwerden und folglich auch Studienergebnisse.
-
Provokationsstudien schaffen reproduzierbare Rahmenbedingungen und erlauben Zeit- und Kostenersparnisse.
-
Wichtige statistische Kenngrößen für die Aussagekraft von Studiendaten sind u.a. die Effektstärke, die ausgewertete Population („Intent to treat“ vs. „per protocol“) und verschiedene Variabilitätsindikatoren.
-
Große Therapieffekte kann man mit kleinen Gruppen zeigen, kleine Effekte nur mit großen Gruppen.
Klinische Entwicklung neuer Produkte
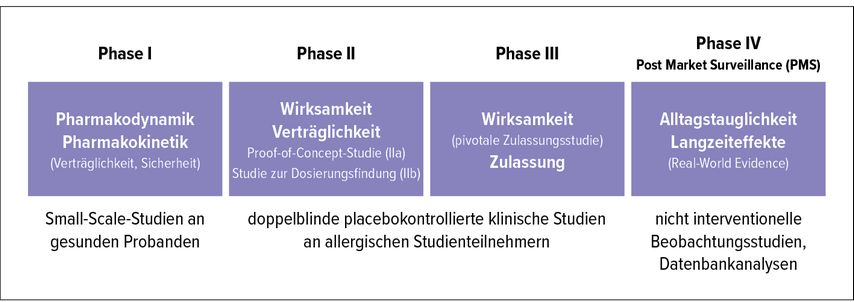
Die klinische Entwicklung eines neuen Präparats zur Allergenhyposensibilisierung unterscheidet sich nicht nennenswert von der Entwicklung neuer Medikamente (Abb. 1). Zunächst wird ein neues Produkt an wenigen gesunden Probanden hinsichtlich seiner Verträglichkeit und Sicherheit untersucht (Phase I). Noch vor der Zulassung eines neuen Präparats wird in PhaseII der klinischen Entwicklung an einer zunehmend größer werdenden Gruppemit allergischen Probanden einerseits geprüft, ob das Produkt beim allergischen Patienten leistet, wofür es entwickelt wurde, welche Dosierung für den Patienten die beste ist, und andererseits, ob die Wirksamkeit des neu zuzulassenden Präparats auch tatsächlich in breiterer Anwendung ausreichend ist – dies wird aktuell im Rahmen von großen multizentrischen, multinationalen Feldstudien untersucht. Nach der Marktzulassung ist die Entwicklung eines Produkts aber noch nicht beendet. In Langzeitstudien werden die Wirksamkeit und die Sicherheit in der Alltagsanwendung anhand von großen retrospektiven Datenbankanalysen bzw. nichtinterventionellen Studien (früher „Anwendungsbeobachtung“ genannt) mit großem Aufwand evaluiert und dokumentiert. So können wichtige Informationen darüber gewonnen werden, wie ein neues Präparat in der Praxisroutine seine Alltagstauglichkeit beweist.
Studiendesigns
Bei der Planung von spezifischen Immuntherapie(SIT)-Studien gibt es Besonderheiten zu beachten.Da die therapeutische Intervention das Immunsystem der behandelten Gruppe im Sinne einer Immuntoleranzentwicklung nachhaltig verändert, können sog.„Crossover-Designs“ nicht zur Anwendung kommen, die bei kurz wirksamen Pharmazeutika durchaus gängige Praxis sind und erlauben, einen Studienteilnehmer konsekutiv mit allen untersuchten Präparaten nacheinander zu behandeln – der Probandist dabei praktischerweise seine eigene Kontrolle. Aus diesem Grund werden SIT-Studien mit einem Parallelgruppen-Design geplant. Das bedeutet, dass jeder Studienteilnehmer einer Behandlungsgruppe zugeordnet wird und in dieser bis zum Ende der Studie auch bleibt. Um sicherzustellen, dass alle Gruppen hinsichtlich ihrer Charakteristika (Schweregrad der Allergie, Sensibilisierungsgrad, Begleiterkrankungen etc.) möglichst identisch sind, besteht die Möglichkeit, mittels Stratifizierung Studienteilnehmer hinsichtlich ihrer einzelnen Charakteristika gleichmäßig auf die Behandlungsgruppen zu verteilen.
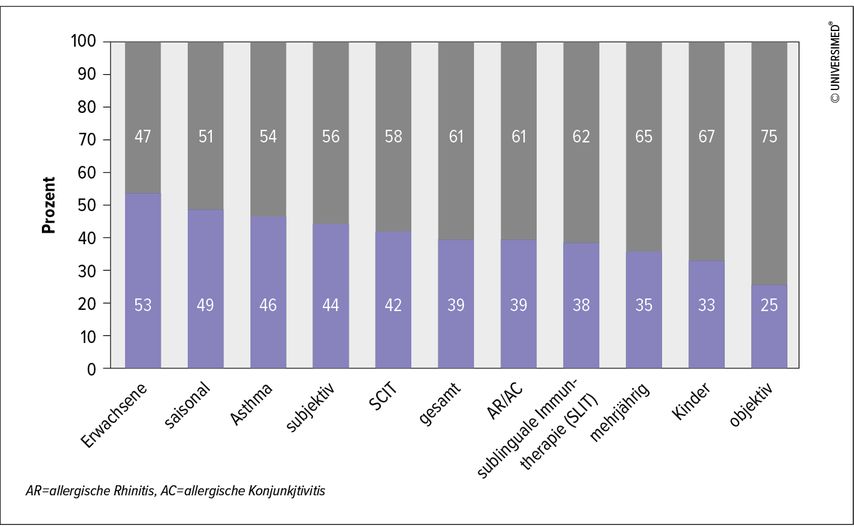
Das Ziel von Phase-IIa-Studien ist es, herauszufinden, welche Dosierung des neuen Präparats für die Patienten die ideale Wirksamkeit besitzt, ohne dabei nennenswerte Sicherheitsrisken zu entwickeln. Hier wird üblicherweise die angestrebte Zieldosierungals die mittlere Dosierung festgelegt und mit einem Referenzprodukt beziehungsweise Placebo verglichen. Wichtig zu wissen ist hier, dass für die Zulassungsbehörden die Verbesserung der klinischen Symptomatik der behandelten Studienteilnehmer immer die wichtigste Zielgröße darstellt. Sog. Surrogatmarker, wie z.B. die Veränderung der allergischen Reaktivität im Hauttest oder in der Serologie, werden ausschließlich als sekundäre Zielparameter akzeptiert. Besonders wichtig ist das Mitführen einer Placebogruppe, da ein Placeboeffekt bei jeder Behandlung ein nennenswertes Ausmaß erreichen kann. Wir wissen heute, dass Placeboeffekte bei der Behandlung erwachsener Patienten größer ausfallen als bei Kindern (Abb. 2). Patienten mit chronischen Beschwerden zeigen eine geringere Placebowirkung als Patienten mit saisonalen Heuschnupfenbeschwerden oder Asthma. Ein Placeboeffekt wird durch sehr viele unterschiedliche Einflussgrößen mitbestimmt: Einerseits sind natürliche Schwankungen der Erkrankungsschwere im Jahresverlauf zu berücksichtigen, andererseits kommen statistische Faktoren wie die sog. „regression to the mean“ bei wachsender Gruppengröße genauso zum Tragen wie systematische Fehlannahmen (Bias). Auch die Interaktion mit dem betreuenden Arzt oder die Erwartungshaltung des Studienteilnehmers können hier eine Rolle spielen.1
Statistische Variablen
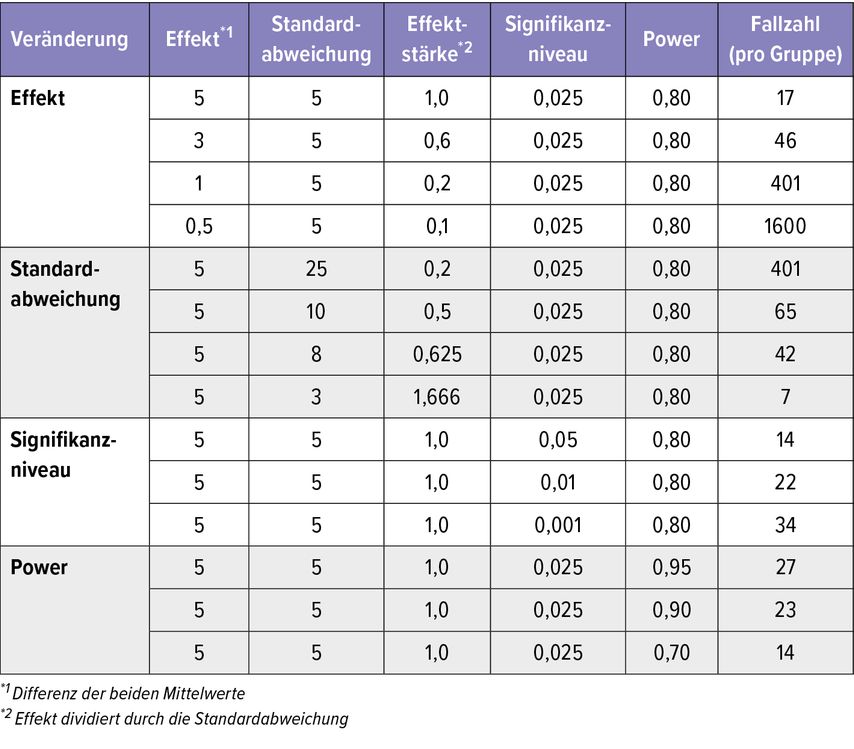
Einzelne statistische Kenngrößen sind in der Planung einer SIT-Studie von besonderer Relevanz. Hier spielt es zum Beispiel eine Rolle, ob Probanden eine Studie protokollkonform von Anfang bis Ende durchlaufen haben („Per protocol“-Population) oder Patienten ausgewertet werden, die dersog. „Intent to treat“-Gruppe angehören, in der alle Teilnehmer ausgewertet werden, dieeiner Behandlungsgruppe zugeordnetwurden, ungeachtet dessen, wie lange sie tatsächlich die zu untersuchende Immuntherapie erhalten haben.2 Es ist vollkommen klar, dass die Studienergebnisse dieser beiden Analysen ganz unterschiedlich ausfallen können, da eine Immuntherapie, die nur einmalig zu Beginn der Studie oder lückenhaft angewendet wird, natürlich nicht dieselbe Wirksamkeit entwickeln kann wie eine lege artis bis zum Ende der Studie durchgeführte Therapie. Wichtig für die Berechnung der Größe der zu untersuchenden Gruppen ist auch der Faktor „Effektstärke“, der ein Maß für die Wirkstärke einer Intervention gegenüber der Vergleichstherapie darstellt.Das bedeutet:Je besser ein Präparat wirkt, desto weniger Personen braucht man, um diese Wirksamkeit zu zeigen (Tab. 1).3 Wenn also in Studien sehr viele Patienten pro Behandlungsgruppe erforderlich sind, dann kann das ein Hinweis darauf sein, dass der Therapieeffekt so klein ist, dass man ihn mit weniger Personen pro Gruppe nicht zeigen könnte. Die Überlegenheit einer Intervention im Vergleich zum Komparator wird im europäischen Raum üblicherweise anhand der statistischen Signifikanz (die Wahrscheinlichkeit, dass das erzielte Ergebnis ein zufälliges ist) und im angloamerikanischen Raum mittels Konfidenzintervall (der möglichst enge Bereich, in dem sich 95% der Ergebnisse befinden) gezeigt.
Tab. 1: Auswirkungen von Veränderungen verschiedener Größen auf die Fallzahl anhand des 1-seitigen unverbundenen t-Tests nach Student unter Annahme gleicher Standardabweichungen (modifiziert nach Röhrig B et al. 2011)3
Parameter in SIT-Studien
Was wird nun in SIT-Studien tatsächlich statistisch ausgewertet? Früher war es üblich, die klinischen Symptome der Patienten mit unterschiedlichen Scoringsystemen nach ihrem Schweregrad zu bewerten, mittlerweile ist global ein 4-Punkte-Score üblich (von 0=keine Beschwerden bis 3=starke Beschwerden), der eine sehr einfache Dokumentation der einzelnen Symptome des Heuschnupfens, der allergischen Konjunktivitis, aber auch des allergischen Asthmas erlaubt. Heute noch immer kontroversiell diskutiert und unterschiedlich statistisch ausgewertet wird eine saisonale Begleitmedikation mit antiallergischen Medikamenten (Antihistaminika, topische oder systemische Kortikoide). Das hat negative Konsequenzen.Durch unterschiedliche Bewertungen können Daten aus verschiedenen Studien leider nicht mehr miteinander verglichen werden. Hier wäre eine globale Verständigung auf ein validiertes, einheitliches Scoringsystem deshalb wünschenswert.
Da die Stärke der Heuschnupfensymptome durch die saisonale Pollenbelastung definiert wird, ist in allen Feldstudien die Pollenkonzentration während der Pollensaison in der äußeren Umgebung zu evaluieren. Hier tendiert man dazu, zumindest die zwei Wochen des stärksten Pollenflugs der Saison („Peak Season“) auszuwerten. In Jahren mit schwachem Pollenflug durch schlechtes Wetter entwickeln Studienteilnehmer weniger Heuschnupfenbeschwerden, somit kann die Wirksamkeit einer zu untersuchenden neuen Allergietherapie naturgemäß auch schlechter beurteilt werden.4 Als alternative Designoptionen können sog. Provokationsstudien herangezogen werden, in denen allergische Symptome unter kontrollierten Rahmenbedingungen entweder mittels eines nasalen, konjunktivalen oder auch eines systemischen Provokationstests in einer Provokationskammer evaluiert werden. Die Ergebnisse von Provokationsuntersuchungen korrelieren sehr gut mit denen saisonaler Feldstudien und können daher gut zur Beurteilung der Wirksamkeit herangezogen werden.Außerdem ist der zeitliche und finanzielle Mehraufwand bei Feldstudien, die die natürliche Exposition während der Saison nutzen müssen, erheblich größer als in kontrollierten Studiensettings, da das wesentlich höhere Ausmaß an Datenvariabilität (Standardabweichung) den Einschluss viel größerer Teilnehmerzahlen erforderlich macht.
Fazit
Allergenimmuntherapiestudien sind weitaufwendiger und komplexer als typische pharmazeutische Studien, da ein effizientes„Crossover-Design“ nicht möglich ist, bedingt durch dieAbhängigkeit der Intervention vonimmunmodulierenden Faktoren und durch die Variabilität der Daten, die saisonale Expositionsschwankungen statistisch mitberücksichtigen müssen. Abhilfe können Provokationsstudien in kontrollierten Settings schaffen.
Die Kenntnis über die Aussagekraft der wichtigsten statistischen Parameter hilftjedoch bei der Interpretation von Studiendaten.
Literatur:
1 Pfaar O et al.: Allergy 2021;76:629-47 2 Brehler R et al.:Allergo J Int 2016;25:38-43 3 Röhrig B et al.: Dtsch ZahnärztlZ 2011; 66:590-5 4 Durham S et al.: Allergy 2014;69:617-23
Das könnte Sie auch interessieren:
Radon – Risiko und Schutz in Österreich
Die WHO weist Radon als ein Karzinogen der Klasse 1 (nachweislich krebserregend) und die zweithäufigste Ursache für Lungenkrebs aus.1 In Österreich werden etwa 10% der ...
Post-Covid-Rehabilitation: die zentrale Rolle der Fatigue
Fünf Jahre nach dem ersten Ausbruch von SARS-CoV-2 sind die Folgen von Long bzw. Post Covid weiterhin allgegenwärtig. Wir sehen eine große Gruppe meist jüngerer Patient:innen, die trotz ...
.jpg)

