
Tuberkulose im 21. Jahrhundert
Autoren:
PD Dr. med. Johannes Nemeth
Dr. med. Dana Weissberg
Klinik für Infektionskrankheiten und Spitalhygiene
Universitätsspital Zürich
E-Mail: johannes.nemeth@usz.ch
Aufgrund einer deutlichen Zunahme der weltweiten Todesfälle ist die Tuberkulose aktuell zur zweithäufigsten infektiösen Todesursache nach Covid-19 aufgestiegen. Der widerstandsfähige Erreger, die lange Therapiedauer und das Aufkommen von multiresistenter Tuberkulose erschweren eine erfolgreiche Behandlung. Neue Therapiekonzepte verheißen indes Erfolge.
Keypoints
-
Die Tuberkulose (TB) zählt weiterhin zu den führenden Todesursachen weltweit. Die Covid-19-Pandemie hat zu einer deutlichen Verschlechterung der medizinischen Versorgungslage und somit zu einem Wiederanstieg der TB-assoziierten Todesfälle geführt.
-
Die tuberkulostatische Therapie dauert mindestens sechs Monate und besteht aus einer Kombinationstherapie zur Verhinderung von Resistenzen. Therapieabbrüche sind keine Seltenheit und kürzere Regimes werden dringend gefordert.
-
Die vier Monate dauernde Rifapentin/Moxifloxacin-basierte Therapie zeigte erstmals die Nichtunterlegenheit eines verkürzten Regimes gegenüber der Standardtherapie.
-
Weltweit steigt die Zahl multiresistenter TB-Fälle, v.a. aufgrund von Ansteckungen mit primär resistenten Erregern.
-
Therapieprotokolle für multiresistente TB sind wegen der längeren Dauer und der nebenwirkungsreichen Polypharmazie häufig nicht erfolgreich. Dies könnte sich mit den neu aufgekommenen Tuberkulostatika ändern.
-
Die vor über 100 Jahren entwickelte BCG-Vakzine ist bis heute die einzige zugelassene Impfung gegen TB und zeigt kaum Wirkung gegen pulmonale TB im Erwachsenenalter. Ein neuer Impfstoffkandidat weist nun eine Effizienz von knapp 50% auf.
Mycobacterium tuberculosis und die langjährige Pandemie
Trotz Fortschritten im Bereich der tuberkulostatischen Therapie zählt die Tuberkulose weiterhin zu den führenden Todesursachen weltweit mit jährlich 1,4–1,8 Millionen Todesfällen bei ca. 10 Millionen Erkrankungen. Gemäß Schätzungen ist ein Viertel der Weltbevölkerung latent mit Tuberkulose infiziert, wobei die Erkrankung bei 5–10% ausbricht.1
Widerstandsfähiger Erreger
Der Auslöser, Mycobacterium tuberculosis, erweist sich durch verschiedene Eigenschaften weiterhin als komplexer Erreger: Das aerobe, säurefeste Stäbchen hat durch den Einbau von Mykolsäuren eine äußerst widerstandsfähige Zellwand, welche dem Bakterium langjähriges intrazelluläres Überleben in Makrophagen (und anderen retikuloendothelialen Zellen) ermöglicht. M. tuberculosis weist ein ausgesprochen langsames Wachstum auf: Die Verdoppelungszeit beträgt ca. 18 Stunden und entspricht somit etwa dem 20-Fachen von gewöhnlichen Bakterien. Aufgrund der intrazellulären Lage sowie der Bildung von nekrotisch verkäsendem Material, Granulomen und Kavernen ist die Medikamentenpenetration reduziert. Erschwerend hinzu kommt eine nicht replizierende Subpopulation von Bakterien mit eingeschränktem Ansprechen auf die antiinfektive Therapie trotz In-vitro-Sensibilität, sogenannte „persisters“. All diese Faktoren führen dazu, dass bei der Tuberkulose im Gegensatz zu gewöhnlichen bakteriellen Erkrankungen eine lange Therapiedauer von mindestens 6 Monaten nötig ist.2
Zudem besteht infolge der zu Erkrankungsbeginn häufig ausgeprägten Erregermenge ein hohes Potenzial zur Selektion resistenter Mykobakterien, sodass eine Kombinationstherapie durchgeführt werden muss. Die Standardtherapie einer pansensiblen Tuberkulose ist eine antibiotische Vierfachkombination aus Rifampicin, Isoniazid, Pyrazinamid und Ethambutol für zweiMonate, wobei Ethambutol gestoppt werden kann, sobald die phänotypische Resistenzprüfung für die anderen drei Substanzen vorliegend und unauffällig ist. Anschließend folgt eine duale Kombination mittels Rifampicin und Isoniazid für weitere vier Monate.3 Aufgrund der Länge und Komplexität ist die Therapie schon bei einer sensiblen Tuberkulose anfällig für Therapieabbrüche, insbesondere nach Abschluss der 2-monatigen Intensivphase und Verbesserung des klinischen Zustandes.4
Zunahme von multiresistenten Mykobakterien
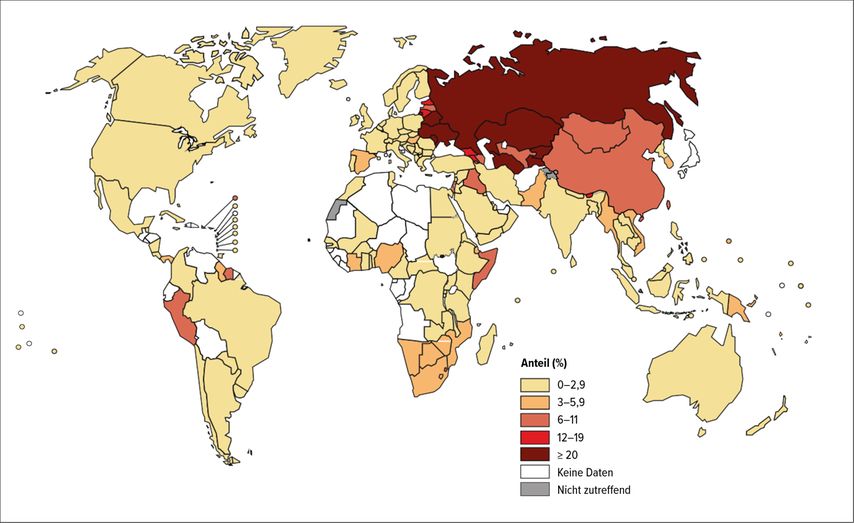
Doch in den letzten Jahren wurden ca. 500000 Patienten jährlich von einem Stamm von M. tuberculosis infiziert, welcher gegenüber Rifampicin und Isoniazid resistent ist (sogenannte „multidrug“-resistente Tuberkulose; MDR-TB) (Abb. 1). Mathematische Modelle prognostizieren eine weitere deutliche Zunahme dieser Fälle in Hochendemie-Ländern wie Indien, Russland oder Südafrika, insbesondere aufgrund von Ansteckungen mit primär resistenten Erregern.5 So wurde für das Jahr 2014 die Zahl der weltweit latent mit multiresistenter Tuberkulose Infizierten auf 19,1 Millionen geschätzt, mit weiter steigender Tendenz.6 Aktuelle Therapieprotokolle für multiresistente Tuberkulose sind von langer Dauer (9–20 Monate) und bestehen aus Polypharmazie mit sehr hohen Toxizitätsrisiken, was wiederum zu Therapieabbrüchen führt.
Abb. 1: Prozentualer Anteil an Rifampicin- oder Multiresistenz bei neuen Tuberkulosefällen im Jahr 2019 (modifiziert nach WHO 2020)23
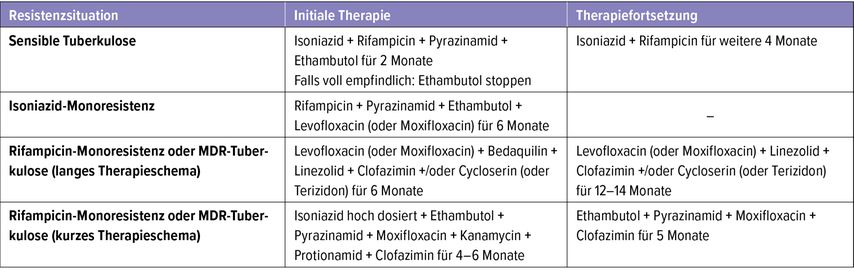
In den von der WHO 2019 publizierten Guidelines zur Behandlung der multiresistenten Tuberkulose wird zwischen einem längeren (mindestens 18 Monate) und einem kürzeren Therapieschema (9–12 Monate) unterschieden (Tab. 1). Bei Letzterem wird die verkürzte Therapiedauer durch eine noch höhere Anzahl an Medikamenten kompensiert (Induktionstherapie mit sieben Substanzen inkl. Aminoglykosid über 4–6 Monate, Erhaltungstherapie mit vier Substanzen für weitere fünf Monate), wodurch das Risiko für Nebenwirkungen weiter steigt.7 Weltweit werden zurzeit nur etwas mehr als die Hälfte der MDR-TB-Fälle (59%) erfolgreich behandelt.1
Tab. 1: Aktuelle Standardtherapien in Abhängigkeit von der Resistenzsituation (modifiziert nach Nahid P et al. 2016, WHO 2019 und Nahid P et al. 2019)3, 7, 24
Fehlen einer wirksamen Impfung
Schließlich fehlt eine wirksame Impfung gegen Tuberkulose, um die weltweite Epidemie zu beenden. Die BCG-Impfung (Vakzine mit einem attenuierten Stamm von Mycobacterium bovis), welche für Säuglinge in Ländern mit hoher Tuberkuloseinzidenz empfohlen wird, vermittelt zwar einen hohen Schutz vor tuberkulöser Meningitis und disseminierter Tuberkulose im Kindesalter, die Schutzwirkung bezüglich der pulmonalen Tuberkulose im Erwachsenenalter ist jedoch eingeschränkt bis fehlend.8 In der Schweiz wird die Impfung demnach nur noch für Säuglinge empfohlen, deren Eltern aus einem Hochendemiegebiet stammen und dorthin zurückkehren.9 In Österreich wird laut Bundesministerium für Soziales, Gesundheit, Pflege und Konsumentenschutz die Impfung nicht mehr empfohlen.10 Auch heute, 100 Jahre nach der Erfindung der BCG-Vakzine, ist diese die einzige zugelassene Impfung gegen Tuberkulose.
Neuigkeiten am Horizont
In den letzten Jahren sind allerdings große Fortschritte im Bereich der Tuberkuloseforschung erzielt worden. Die unserer Ansicht nach bedeutendsten möchten wir hier im Folgenden kurz erläutern.
1. Verkürzte Therapiedauer
Von den vier Standard-Tuberkulostatika besitzt Rifampicin die stärkste Sterilisierungsaktivität und gilt dementsprechend als Grundpfeiler der tuberkulostatischen Therapie. Rifapentin, ein anderer Vertreter der Rifamycine und Cyclopentyl-Derivat von Rifampicin, weist eine deutlich längere Halbwertszeit (14–18 Stunden) im Vergleich zu Rifampicin (2–5 Stunden) auf.11 Entsprechend erhofft man sich eine längere Rifamycin-Exposition bei gleichbleibender, einmal täglicher Einnahme und somit eine verkürzte Therapiedauer. In einer 2021 publizierten Phase-III-Studie wurden 2234 Patienten in drei Gruppen untersucht: Die Kontrollgruppe erhielt die tuberkulostatische Standardtherapie über sechs Monate, während die beiden experimentellen Arme eine 4-monatige Rifapentin-basierte Therapie erhielten. In der einen Rifapentin-Gruppe wurde im Vergleich zur Standardtherapie lediglich Rifampicin durch Rifapentin ersetzt, in der anderen zusätzlich Moxifloxacin statt Ethambutol verabreicht.12 Dies vor dem Hintergrund, dass Regimes mit Moxifloxacin, einem Fluorchinolon mit Aktivität gegen M. tuberculosis, zu einem schnelleren Abfall der Mykobakterienmenge führen.13 Während die Rifapentin-Gruppe ohne Moxifloxacin der Standardtherapie unterlegen war (85,6% vs. 90,4% erfolgreiche Therapien), konnte für die Rifapentin-Gruppe mit Moxifloxacin Nichtunterlegenheit demonstriert werden (88,4% vs. 90,4% erfolgreiche Therapien).12 Somit ist der Grundstein gelegt für eine 4-monatige Therapie, welche insbesondere auch dadurch überzeugt, dass genetische Resistenzprüfungen von M. tuberculosis bezüglich Fluorchinolonen bereits verfügbar sind, sodass analog zu Rifampicin und Isoniazid eine rasche Resistenzprüfung möglich ist.
Allerdings muss bemerkt werden, dass es Unterschiede gibt zwischen der „Intention to treat“-Population (alle eingeschlossenen Patienten, unabhängig davon, ob sie die Medikamente im Verlauf auch wirklich eingenommen haben) und der Per-Protokoll-Population (nur Patienten, die die Medikamente nach Protokoll eingenommen haben). In der Per-Protokoll-Analyse, in der sich die Patienten zu 95% an das Studienprotokoll gehalten haben, ist das Resultat für die Rifapentin-Moxifloxacin-Gruppe ungünstiger ausgefallen als in der Kontrollgruppe (Rifapentin-Moxifloxacin 37/641; 5,8%, versus Kontrolle: 15/563; 2,7%). Formal ist dieser numerische Unterschied jedoch nicht signifikant, da er noch innerhalb des Nichtunterlegenheitsbereichs liegt.
Ein zusätzlicher Vorteil der aktuellen Standardtherapie der Tuberkulose ist, dass die verwendeten Medikamente für andere bakterielle Infektionen im Alltag selten gebraucht werden. Ein zunehmender Einsatz von Moxifloxacin hingegen könnte sich insofern als unvorteilhaft erweisen, als dadurch in anderen Bakterien Resistenzen gegenüber Fluorchinolonen gefördert werden könnten.14
Zusammenfassend sind diese Ergebnisse ein wichtiger Schritt in die richtige Richtung. Allerdings ist die Standardtherapie bei empfindlichen Mykobakterien weiterhin sehr effektiv, vor allem, wenn sie richtig eingenommen werden kann.
2. Eradikation von „persisters“
Im Gegensatz zu anderen Tuberkulostatika scheint Rifampicin auch gegen die sogenannten „persisters“, also nicht replizierende, schlafende Bakterien, aktiv zu sein.15 Die heute im Bereich der Tuberkulosetherapie verwendete Rifampicin-Dosierung von 10mg/kgKG stammt aus den 1960er-Jahren und ist noch beeinflußt von Toxizitäts- und Kostenüberlegungen.16In-vitro- und Tierstudien konnten jedoch eine klare dosisabhängige Reduktion der Bakterienlast nachweisen, wobei die Standarddosis von 600mg pro Tag am unteren Ende der Dosis-Wirkung-Beziehung zu liegen kommt. Durch Erhöhung der Dosis erhofft man sich nun ein schnelleres „killing“ der Mykobakterien, eine Eradikation von „persisters“ und entsprechend eine Reduktion von Rezidiven sowie gegebenenfalls eine kürzere Therapiedauer.17
In einer 2017 publizierten Studie wurden 63 Patienten mit pansensibler Tuberkulose in der Intensivphase mit Rifampicin 35mg/kg (statt 10mg/kg) behandelt und mit 123 Patienten unter Standardtherapie verglichen. Im experimentellen Arm zeigten sich signifikant kürzere Kulturkonversionszeiten (48 vs. 62 Tage) bei ähnlichem Nebenwirkungsprofil.18 Phase-III-Studien an größeren Patientenkollektiven mit klinischen Endpunkten sind aktuell noch ausstehend.
3. Effektive MDR/XDR-TB-Therapie
Auch im Bereich der multiresistenten Tuberkulose gibt es gute Nachrichten: Mit Bedaquilin, Delamanid und Pretomanid sind nach knapp 50 Jahren erstmals wieder neue Medikamente mit Aktivität gegen Tuberkulose entwickelt worden.19 Während Bedaquilin die mykobakterielle ATPase hemmt, blockieren die beiden anderen Substanzen die Produktion von Mykolsäure und hemmen auf diese Weise die mykobakterielle Zellwandsynthese. Zusätzlich konnte beim neuen Reserveantibiotikum Linezolid, einem Hemmer der bakteriellen Proteinsynthese mit Wirkung gegen grampositive Bakterien, auch Wirkung gegen M. tuberculosis nachgewiesen werden.20
Nun wurde 2020 eine „Single-group“-Studie mit Patienten mit MDR-TB publiziert, bei welchen kein Therapieansprechen vorlag, die Therapie aufgrund von Nebenwirkungen sistiert werden musste oder gar eine XDR(„extensive-resistant“)-Tuberkulose vorlag, also zusätzlich zu Resistenzen gegenüber Rifampicin und Isoniazid auch solche gegenüber Fluorchinolonen und Aminoglykosiden vorlagen. Es wurden 109 Patienten eingeschlossen und mit einer oralen Dreifachkombination bestehend aus Bedaquilin, Pretomanid und Linezolid über 26 Wochen behandelt. Das Therapieansprechen lag bei erstaunlichen 90%, ähnlich wie bei pansensibler Tuberkulose in modernen Studien. Nebenwirkungen waren zwar häufig, insbesondere trat bei 81% der Patienten infolge der Linezolid-Therapie eine periphere Neuropathie auf, was zu Unterbrüchen respektive Dosisreduktion führte. Insgesamt wurden die Nebenwirkungen jedoch in der Mehrheit als milde bezeichnet oder sie waren nach Sistieren der Therapie wieder rückläufig.21 In Anbetracht früherer Erfolgsraten bei MDR- oder XDR-TB kommen die Resultate dieser Studie einer Sensation gleich.
4. Impfung
In einer 2019 publizierten, doppelblind randomisierten, placebokontrollierten Phase-IIb-Studie wurde der Impfstoff M72/AS01E vs. Placebo untersucht. Die 3289 Patienten wurden 1:1 randomisiert. Eingeschlossen wurden Patienten aus Kenia, Südafrika und Sambia, welche bereits latent mit Tuberkulose infiziert, zwischen 18- und 50-jährig sowie HIV-negativ waren. Die Impfung enthielt ein rekombinantes Fusionsprotein aus zwei Antigenen von M. tuberculosis, kombiniert mit einem Adjuvans. Nach zwei Impfdosen im Abstand von einem Monat wurden die Patienten über drei Jahre lang beobachtet. In der Impfgruppe entwickelten 13 (Inzidenz 0,3 Fälle pro 100 Personenjahre), in der Placebogruppe 26 (Inzidenz 0,6 Fälle pro 100 Personenjahre) Patienten eine aktive pulmonale Tuberkulose. Die Effizienz der Vakzine nach 36 Monaten wird entsprechend mit 49,7% angegeben. Relevante Nebenwirkungen sind keine aufgetreten.22 Untersuchungen an größeren Patientenkollektiven aus diversen Altersklassen und Ethnien sowie ohne latente Tuberkuloseinfektion sind nun der nächste Schritt. Aktuell befinden sich zudem 13 weitere Impfkandidaten in klinischen Studien.1
Ausblick
Die Covid-19-Pandemie hat den Fortschritt der letzten Jahre im Bereich der weltweiten Versorgung von Tuberkulosepatienten leider deutlich zurückgeworfen. Die Zahl der global diagnostizierten und gemeldeten Tuberkulosefälle betrug 2020 nur noch 5,8 Millionen im Vergleich zu den geschätzten 10 Millionen Neuerkrankten. Dies wird insbesondere auf die Überlastung des Gesundheitswesens zurückgeführt und ist die Folge von Lockdowns und Stigmatisierung aufgrund von Symptomähnlichkeit zwischen Covid-19 und Tuberkulose. Der verminderte Zugang zu medizinischer Versorgung hat auch die Anzahl der Tuberkulose-assoziierten Todesfälle wieder deutlich ansteigen lassen. Modelle prognostizieren eine weitere Verschlechterung in den nächsten Jahren, und eine zunehmende Armut und Unterernährung als Folgeerscheinungen der Covid-19-Pandemie könnten die Zahlen noch weiter verschlimmern.1 Gerade jetzt ist es also umso wichtiger, die weltweite Versorgung der Tuberkulosepatienten wieder zu gewährleisten und Therapie- sowie Präventionsmaßnahmen zu optimieren.
Literatur:
1 World Health Organisation: Global tuberculosis report 2021. 2021. https://www.who.int/publications-detail-redirect/9789240037021 2 Horsburgh CR et al.: Treatment of tuberculosis. N Engl J Med 2015; 373: 2149-60 3 Nahid P et al.: Official American Thoracic Society/Centers for Disease Control and Prevention/Infectious Diseases Society of America Clinical Practice Guidelines: Treatment of drug-susceptible tuberculosis. Clin Infect Dis 2016; 63: e147-e195 4 Kruk ME et al.: Timing of default from tuberculosis treatment: a systematic review. Trop Med Int Health 2008; 13: 703-12 5 Sharma A et al.: Estimating the future burden of multidrug-resistant and extensively drug-resistant tuberculosis in India, the Philippines, Russia, and South Africa: a mathematical modelling study. Lancet Infect Dis 2017; 17: 707-15 6 Knight GM et al.: Global burden of latent multidrug-resistant tuberculosis: trends and estimates based on mathematical modelling. Lancet Infect Dis 2019; 19: 903-12 7 World Health Organization: WHO Guidelines approved by the Guidelines Review Committee. WHO consolidated guidelines on drug-resistant tuberculosis treatment. Geneva: 2019 8 Trunz BB et al.: Effect of BCG vaccination on childhood tuberculous meningitis and miliary tuberculosis worldwide: a meta-analysis and assessment of cost-effectiveness. Lancet 2006; 367: 1173-80 9 Bundesamt für Gesundheit. Tuberkulose in der Schweiz. Leitfaden für Fachpersonen des Gesundheitswesen. 2019. https://www.bag.admin.ch/bag/de/home/krankheiten/krankheiten-im-ueberblick/tuberkulose.html 10 Bundesministerium für Soziales, Gesundheit, Pflege und Konsumentenschutz, 2022: https://www.sozialministerium.at/Themen/Gesundheit/Uebertragbare-Krankheiten/Infektionskrankheiten-A-Z/Tuberkulose.html 11 Burman WJ et al.: Comparative pharmacokinetics and pharmacodynamics of the rifamycin antibacterials. Clin Pharmacokinet 2001; 40: 327-41 12 Dorman SE et al.: Four-month rifapentine regimens with or without moxifloxacin for tuberculosis. N Engl J Med 2021; 384: 1705-18 13 Gillespie SH et al.: Four-month moxifloxacin-based regimens for drug-sensitive tuberculosis. N Engl J Med 2014; 371: 1577-87 14 Rubin EJ, Mizrahi V: Shortening the short course of tuberculosis treatment. N Engl J Med 2021; 384: 1764-5 15 Gumbo T et al:. Concentration-dependent Mycobacterium tuberculosis killing and prevention of resistance by rifampin. Antimicrob Agents Chemother 2007; 51: 3781-8 16 de Steenwinkel JE et al.: Optimization of the rifampin dosage to improve the therapeutic efficacy in tuberculosis treatment using a murine model. Am J Respir Crit Care Med 2013; 187: 1127-34 17 Hu Y et al.: High-dose rifampicin kills persisters, shortens treatment duration, and reduces relapse rate in vitro and in vivo. Front Microbiol 2015; 6: 641 18 Boeree MJ et al.: High-dose rifampicin, moxifloxacin, and SQ109 for treating tuberculosis: a multi-arm, multi-stage randomised controlled trial. Lancet Infect Dis 2017; 17: 39-49 19 Kälin M et al.: Multiresistente Tuberkulose. Swiss Med Forum 2020; 20: 771-5 20 Lee M et al.: Linezolid for treatment of chronic extensively drug-resistant tuberculosis. N Engl J Med 2012; 367: 1508-18 21 Conradie F et al.: Treatment of highly drug-resistant pulmonary tuberculosis. N Engl J Med 2020; 382: 893-902 22 Tait DR et al.: Final analysis of a trial of M72/AS01(E) vaccine to prevent tuberculosis. N Engl J Med 2019; 381: 2429-39 23 World Health Organisation: Global tuberculosis report 2020. 2020. https://www.who.int/publications-detail-redirect/9789240013131 24 Nahid P et al.: Treatment of drug-resistant tuberculosis. An official ATS/CDC/ERS/IDSA Clinical Practice Guideline. Am J Respir Crit Care Med 2019; 200: e93-e142
Das könnte Sie auch interessieren:
Radon – Risiko und Schutz in Österreich
Die WHO weist Radon als ein Karzinogen der Klasse 1 (nachweislich krebserregend) und die zweithäufigste Ursache für Lungenkrebs aus.1 In Österreich werden etwa 10% der ...
Post-Covid-Rehabilitation: die zentrale Rolle der Fatigue
Fünf Jahre nach dem ersten Ausbruch von SARS-CoV-2 sind die Folgen von Long bzw. Post Covid weiterhin allgegenwärtig. Wir sehen eine große Gruppe meist jüngerer Patient:innen, die trotz ...
.jpg)

