SCLC aus Sicht der Pneumoonkologie: neue Therapiestrategien
Autor:
OA Dr. Maximilian Hochmair
Leiter der pneumo-onkologischen Ambulanz + Tagesklinik
Abteilung für Innere Medizin und Pneumologie
Karl Landsteiner Institut für Lungenforschung und pneumologische Onkologie
Klinik Floridsdorf, Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das weniger häufige kleinzellige Lungenkarzinom (SCLC) war lange Zeit das Sorgenkind der therapeutischen Forschung. Im Gegensatz zu den immuntherapeutischen Entwicklungen beim nichtkleinzelligen Lungenkarzinom konnten auf dem Gebiet des SCLC über Jahrzehnte keine bahnbrechenden Fortschritte verbucht werden. Seit Kurzem stehen mit Atezolizumab und Durvalumab nun zwei Checkpoint-Inhibitoren zur Verfügung, die betroffenen Patienten sowohl einen Überlebensvorteil als auch ein längeres progressionsfreies Überleben ermöglichen.
Keypoints
Mit der Immuntherapie mittels PD-L1-Inhibitoren gibt es nach langer Zeit wieder einen Therapiefortschritt bei der Behandlung des SCLC.
Die Gabe von Durvalumab oder Atezolizumab plus Etoposid und Carboplatin ist der neue Therapiestandard.
Immunmediierte Nebenwirkungen durch eine Therapie mit PD-L1-Inhibitoren scheinen das Gesamtüberleben zu verlängern.
Rova-T und andere Substanzen zeigten leider keinen Benefit.
In der Pneumoonkologie fallen 90% aller Karzinome auf das nichtkleinzellige Lungenkarzinom (NSCLC), 10% sindkleinzellige Lungenkarzinome (SCLC). Während in Asien, Lateinamerika und Afrika die bis 2026 geschätzte Inzidenz des SCLC mit bis zu 4% relativ gering ist, zeigen Nordamerika und Europa mit 10,43% bzw. 9,48% deutlich höhere Indizenzen.1
Noch in den 1970er-Jahren waren vor allem Männer von dieser Karzinomart betroffen, mittlerweile haben die Frauen aufgeholt, was der steigenden Zahl rauchender Frauen geschuldet ist. Bereits im Jahr 2000 gab es gleich viele betroffene Männer wie Frauen.2 Das verdeutlicht die Rolle des Hauptrisikofaktors bei der Entwicklung eines SCLC: des Rauchens.3 Es zeigte sich, dass ein Rauchstopp nach Diagnosestellung zu einer doppelt so langen Überlebenszeit führt wie ohne Rauchstopp. Eine Studie aus den USA unterstreicht dies: Hier wurde beobachtet, dass lediglich 2,5% der an einem SCLC erkrankten Patienten noch nie in ihrem Leben geraucht hatten.4
Eigenschaften des SCLC
Die Tumorzellen des SCLC stammen von den Kulchitsky-Zellen ab, was zu paraneoplastischen Phänomenen führt. Die Tumorverdopplungszeit beträgt hier 50 Tage. Im Gegensatz zum NSCLC ist es beim SCLC daher entscheidend, die Therapie rasch einzuleiten. In der Regel wird nach der Diagnose des SCLC keine Zeit verloren und bereits am folgenden Tag mit der Therapie begonnen. Das SCLC hat eine hohe Sensitivität gegenüber Radio- und Chemotherapie, jedoch auch die Tendenz, sehr schnell resistente Zelllinien zu entwickeln. Außerdem findet sich eine frühe hämatogene Metastasierung, darum ist es beim Staging wichtig, auch das Gehirn sowie die Knochenstrukturen zu screenen – eine diagnostische CT sollte daher vom Hals bis zum Abdomen durchgeführt werden, ebenso wird ein Schädel- und Knochenscan empfohlen.
Bei zwei Dritteln der diagnostizierten Fälle befindet sich die Erkrankung schon in einem extensiven Stadium, das heißt, sie hat sich auf Gewebe außerhalb der Lunge verbreitet („extensive disease“; ES-SCLC), bei lediglich einem Drittel begrenzt sich die Erkrankung auf einen einzigen Ausstrahlungsherd („limited disease“).5,6 Demnach ist die „limited disease“ potenziell kurabel, wobei 70 bis 80% der Patienten ein Rezidiv entwickeln. Eine Verbesserung der Therapie und vor allem auch die Abklärung der Rolle einer Immuntherapie wären hier essenziell. Dazu laufen aktuell Studien, die die Wirksamkeit einer Immuntherapie in der Interaktion mit der Strahlentherapie und der Chemotherapie evaluieren.
Bei der „extensive disease“, die palliativ behandelt wird, steht seit einem Jahr eine Chemo-Immuntherapie zur Verfügung – neben der Chemotherapie wird hier zusätzlich ein Checkpoint-Inhibitor gegeben.
Therapie des SCLC
Bereits seit 1985 steht Etoposid + Cisplatin als Erstlinientherapie des SCLC zur Verfügung. In der Zweitlinie wurde 1995 Topotecan zugelassen, aber im Vergleich zu den Entwicklungen auf dem Gebiet der Therapie des NSCLC gab es lange Zeit keine bahnbrechenden Entdeckungen. Mehr als 60 Substanzen wurden in den letzten Jahrzehnten hinsichtlich ihres Therapieerfolgs beim SCLC getestet – immer ergebnislos. Und das obwohl die Immuntherapie aufgrund der hohen Prävalenz von somatischen Mutationen in den Zellen des SCLC eine gute Behandlungsoption darstellen müsste.
Chemotherapie
Als Chemotherapeutikum wird die Kombination von Etoposid mit Cisplatin oder Carboplatin empfohlen. In einer Sammlung von Patientendaten konnte gezeigt werden, dass beide Substanzdoublets sich nahezu ident auf das mediane Gesamtüberleben (OS) wie auch das mediane progressionsfreie Überleben (PFS) auswirken.7 Da Carboplatin allerdings besser vertragen wird, kommt es bei Patienten mit einem ES-SCLC eher zum Einsatz. Ebenso konnte kein Vorteil von 6 gegenüber 4 Chemotherapiezyklen nachgewiesen werden.8 In der Praxis werden daher meist 4 Zyklen durchgeführt, um die Lebensqualität der Patienten nicht noch mehr zu beeinträchtigen.
Immuntherapie
Die Immuntherapie mittels Checkpoint-Inhibitoren hat in den letzten Jahren die onkologischen Behandlungsstrategien revolutioniert. Eingesetzt bei malignen Melanomen, Blasenkrebs sowie Nierentumoren, haben sich solche Checkpoint-Inhibitoren mittlerweile auch im Kampf gegen das NSCLC etabliert.
Im September 2019 bzw. September 2020 wurden nun endlich auch Checkpoint-Inhibitoren zur mit Chemotherapie kombinierten Behandlung des SCLC von der European Medicine Agency (EMA) zugelassen und sind nun der neue Erstlinienstandard.
IMpower133 – Atezolizumab
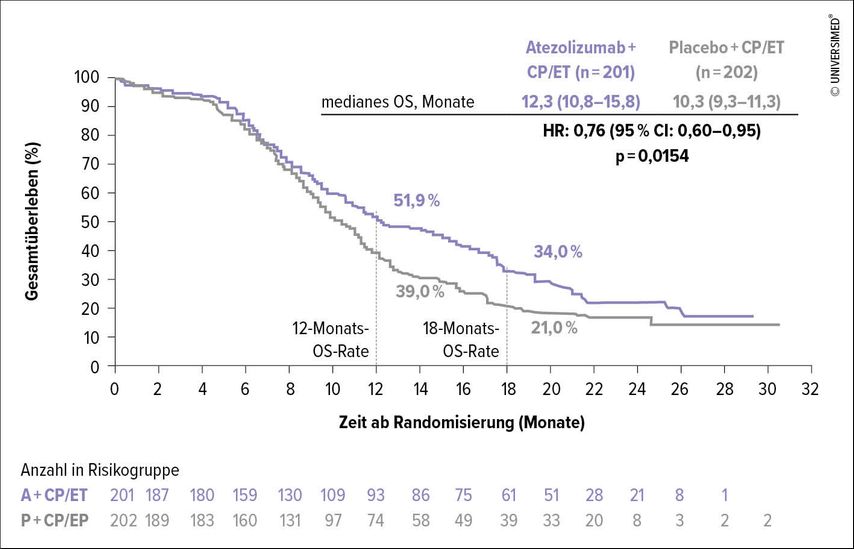
Auf dem ESMO 2018 wurden mit der placebokontrollierten, randomisierten Phase-III-Studie IMpower133 nach langem Warten endlich günstige Daten zur Immuntherapie des SCLC präsentiert und in der Folge auch publiziert.9 In dieser Studie konnte erstmals gezeigt werden, dass die zusätzlichzur Chemotherapie verabreichte Gabe eines PD-L1-Inhibitors im Vergleich zu Placebo zu einem Überlebensvorteil führt.
Eingeschlossen in diese Studie waren 403 therapienaive ES-SCLC-Patienten. Diese wurden in der Induktionsphase (alle 3 Wochen, 4 Zyklen) mit Etoposid plus – aufgrund der besseren Verträglichkeit – Carboplatin (EC) in Kombination mit dem PD-L1-Inhibitor Atezolizumab (A) behandelt, wobei Atezolizumab im Erhaltungsarm nach 4 Zyklen beendet wurde. Der Placeboarm erhielt EC + Placebo ebenso alle 3 Wochen über 4 Zyklen, in der Erhaltungsphase wurde nur das Placebo verabreicht. Außerdem war in dieser Studie die prophylaktische Ganzhirnbestrahlung in beiden Armen möglich.
Zum ersten Mal ergab sich im Median ein Gesamtüberlebensvorteil im experimentellen Arm (12,3 vs. 10,3 Monate; HR: 0,76; 95% CI: 0,6–0,95; p=0,0154) (Abb. 1)10 sowie ein signifikant längeres PFS (5,2 vs. 4,3 Monate; HR: 0,77; 95% CI: 0,62–0,96; p=0,017).11 Subgruppenanalysen zum Gesamtüberleben lieferten zudem Hinweise darauf, dass Patienten über 65 Jahre (HR: 0,53; 95% CI: 0,36–0,77) sowie Patienten ohne Hirnmetastasen (im Vergleich zu Patienten mit Hirnmetastasen) (HR: 0,68; 95% CI: 0,52–0,89) möglicherweise besonders von der Atezolizumab-Gabe profitieren.11
Abb. 1: IMpower133: Gesamtüberleben (OS) unter Therapie mit Atezolizumab plus EP vs. EP (modifiziert nach Reck et al. 2019)10
CASPIAN – Durvalumab
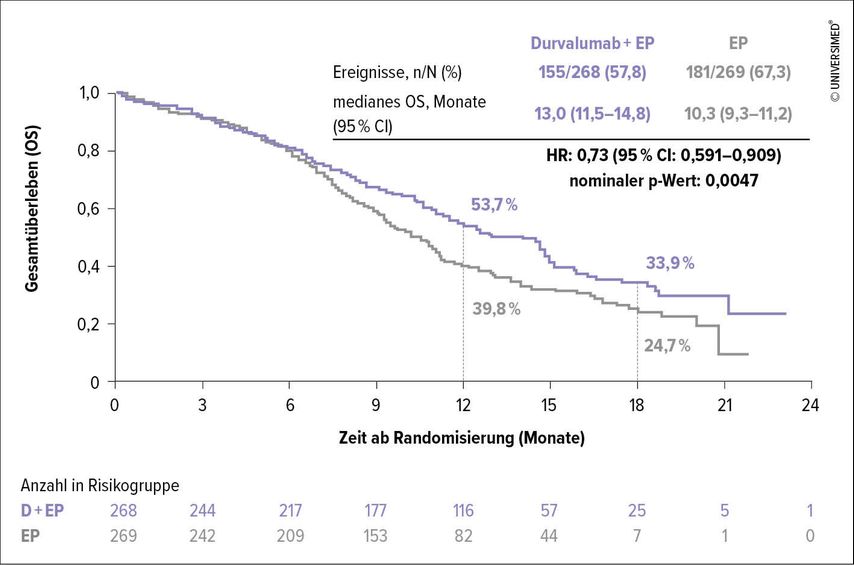
Erstmals 2019 bei der WCLC präsentiert, wurde nun in weiterer Checkpoint-Inhibitor, nämlich Durvalumab, aufgrund der dreiarmigen, randomisierten Open-Label-Phase-III-Studie CASPIAN zugelassen.12
In diese Studie wurden 805 therapienaive Patienten mit einem ES-SCLC und einer Lebenserwartung von mehr als 12 Wochen eingeschlossen. Im ersten Arm wurde in der Induktionsphase Durvalumab plus Tremelimumab plus Etoposid mit Carboplatin oder Cisplatin in bis zu 4 Zyklen verabreicht. Die Erhaltungsphase erfolgte mit Durvalumab alle 4 Wochen. Hier gab es schließlich zwar signifikant positive Ergebnisse, da diese jedoch klinisch weniger relevant waren, wurde der Arm nicht weiterverfolgt. Im zweiten, experimentellen Arm wurde Durvalumab (D) plus Etoposid mit Carboplatin oder Cisplatin (EP) alle 3 Wochen in bis zu 4 Zyklen gegeben (n=268), in der Erhaltung wurde Durvalumab alle 4 Wochen gegeben. Im dritten Arm erhielten die Patienten (n=269) Etoposid mit Carboplatin oder Cisplatin in bis zu 6 Zyklen. In der Erhaltungsphase wurde hier eine prophylaktische Ganzhirnbestrahlung zur Option gestellt, diese wurde im experimentellen D+EP-Arm nicht angeboten.
Ebenso wie in der IMpower-Studie zeigte sich ein klarer Überlebensvorteil unter D+EP (HR: 0,73; 95% CI: 0,591–0,909; p=0,0047). Im Median überlebten Patienten unter D+EP 13 Monate versus 10,3 Monate unter EP (Abb. 2).12 In der Subgruppenanalyse zeigte sich im Gegensatz zur IMpower133-Studie kein Vorteil im OS für eine bestimmte Gruppe, alle profitierten von der D+EP-Gabe. Das PFS war unter D+EP im Vergleich zu EP ebenfalls positiv, die statistische Signifikanz wurde dabei allerdings nicht getestet. Es zeigte sich aber ein Vorteil in der „overall remission rate“ (ORR) der Patienten im D+EP-Arm vs. EP-Arm (Odds-Ratio 1,56; 95% CI: 1,095–2,218).
Abb. 2: CASPIAN: Gesamtüberleben (OS) unter Therapie mit Durvalumab plus EP vs. EP (modifiziert nach Paz-Ares L et al. 2019)12
Die Expressionsstärke und Verteilung von PD-L1 im SCLC scheint die Behandlung mit diesen Inhibitoren übrigens nicht zu beeinflussen, da sich bei Patienten mit unterschiedlichen Expressionsmustern und -dichten keine Unterschiede im Ansprechen oder der Wirksamkeit offenbarten.12
Bezüglich des Nebenwirkungsprofils wurden keine neuen Erfahrungen gemacht. Im Schnitt war die Häufigkeit der Nebenwirkungen (AE) in beiden Armen gleich, ernste AE waren im EP-Arm häufiger, die Patienten im D+EP-Arm litten öfter unter immunmediierten AE als die im EP-Arm (19,6% vs. 2,6%).
Der Vorteil der Nebenwirkung
Eine rezent veröffentlichte Publikation zeigte, dass NSCLC-Patienten, die mit PD-L1-Inhibitoren behandelt wurden und unter immunmediierten AE litten, einen doppelt so großen OS-Vorteil hatten.13 Hier scheint der Faktor „immunmediierte AE“ einem Biomarker zu gleichen. Ähnliches konnten Riciutti et al. vor Kurzem auch für das SCLC beobachten: Auch SCLC-Patienten mit immunmediierten AE zeigten ein mehr als doppelt so langes Gesamtüberleben.14 Dies ist vor allem vor dem Hintergrund des Therapieabbruchs für die Praxis relevant. Patienten, die aufgrund der AE die Therapie abbrechen wollen, können mit diesem positiven „Biomarker“ zur Therapiefortsetzung motiviert werden.
Weitere Checkpoint-Inhibitoren
Mit dem PD-1-Inhibitor Pembrolizumab wurde ein weiterer Checkpoint-Inhibitor im Rahmen einer Phase-III-Studie mit 453 Patienten untersucht.15 Das zweiarmige Design von KEYNOTE-604 umfasste die Gabe von Pembrolizumab (P)+EP vs. Placebo + EP. Im experimentellen Arm konnte zwar ein signifikanter Vorteil für das PFS nachgewiesen werden, der koprimäre Endpunkt, die Verlängerung des OS entsprechend einer vorab festgelegten Grenze, konnte jedoch nicht erreicht werden.
In der Phase-II-Studie ECOG-ACRIN EA5161 wurde Nivolumab, ein weiterer PD-1-Inhibitor, geprüft.16 160 therapienaiven ES-SCLC-Patienten wurde entweder Nivolumab+EP oder nur EP verabreicht. DasPFS zeigte sich mit 5,5 Monaten im experimentellen Arm vs. 4,7 Monate günstig, ebenso das OS (11,3 vs. 9,3 Monate). In beiden Fällen waren allerdings bei Woche 14 bzw. 15 keine Vorteile mehr zu beobachten.
Viele andere Immuntherapiestudien zum SCLC sind aber auch gescheitert. Substanzen wie Rovalpituzumab-Tesirin (Rova-T), ein experimentelles Antikörper-Wirkstoff-Konjugat gegen DLL3, das in mehr als 80% der SCLC-Tumoren exprimiert wird, konnten keine Erfolge erzielen. 2019 erst wurde die placebokontrollierte Phase-III-Studie MERU gestoppt, da sich unter dieser Therapie kein Überlebensvorteil ergab.17
Literatur:
1 Informa Pharma Intelligence: Market spotlight: small-cell lung cancer (SCLC). Datamonitor Healthcare 2020 2 Govindan R et al.: Changing epidemiology of small-cell lung cancer in the United States over the last 30 years: analysis of the surveillance, epidemiologic, and end results database. J Clin Oncol 2006; 24(28): 4539-44 3 American Cancer Society: Small-cell lung cancer risk factors. www.cancer.org/cancer/lung-cancer/causes-risks-prevention/risk-factors.html; zuletzt besucht am 15.1.2020 4 Ou SH et al.: Prognostic factors for survival in extensive stage small cell lung cancer (ED-SCLC): the importance of smoking history, socioeconomic and marital statuses, and ethnicity. J Thorac Oncol 2009; 4(1): 37-43 5 Stahel RA et al.: Staging and prognostic factors in small cell lung cancer: a consensus report. Lung Cancer 1989; 5: 119-26 6 Sabari JK et al.: Unravelling the biology of SCLC: implications for therapy. Nat Rev Clin Oncol 2017; 14(9): 549-61 7 Früh M et al.: Small-cell lung cancer (SCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013; 24 (Suppl 6): vi99-105 8 Veslemes M et al.: Optimal duration of chemotherapy in small cell lung cancer: a randomized study of 4 versus 6 cycles of cisplatin-etoposide. J Chemother 1998; 10(2): 136-40 9 Horn L et al.: First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med 2018; 379: 2220-9 10 Reck M et al.: Impower133: updated overall survival (OS) analysis of first-line (1L) Atezolizumab (Atezo) + Carboplatin + Etoposide in extensve-stage SCLC (ES-SCLC). ESMO 2019 11 Liu S et al.: Impower133: primary PFS, OS and safety in a PH1/3 study of 1L Atezolizumab + Carboplatin + Etoposide in extensive-stage SCLC. WCLC 2018; Abstract No. PL02.07 12 Paz-Ares L et al.: Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomized, controlled, open label, phase 3 trial. Lancet 2019; 394: 1929-39 13 Cortellini A et al. Immune-related adverse events of Pembrolizumab in a large real-world cohort of patients with NSCLC with a PD-L1 expression ≥ 50% and their relationship with clinical outcomes. Clini Lung Cancer 2020; 21(6): 498-508 14 Ricciuti B et al.: Association between immune-related adverse events and clinical outcomes to programmed cell death protein 1/programmed death-ligand 1 blockade in SCLC. JTO Clin Res Rep 2020; 1:1000074 15 Rudin CM et al.: KEYNOTE-604: Pembrolizumab or placebo plus etoposide and platinum as irst-line therapy for extensive-stagesmall-cell lung cancer. ASCO 2020; Abstract No. 9001 16 Leal TA et al.: Randomized phase II clinical trial of cisplatin/carboplatin and etoposide (CE) alone or in combination with nivolumab as frontline therapy for extensive stage small cell lung cancer (ES-SCLC): ECOG-ACRIN EA 5161. ASCO 2020; Abstract No. 9000 17 Abbvie News: AbbVie discontinues Rovalpituzumab Tesirine (Rova-T) research and development program. https://news.abbvie.com/news/press-releases/abbvie-discontinues-rovalpituzumab-tesirine-rova-t-research-and-development-program.htm ; zuletzt aufgerufen am 15.1.2020
Das könnte Sie auch interessieren:
Mukoviszidose – eine Erkrankung mit Prädisposition für Pilzinfektionen
Pilzinfektionen stellen eine zunehmende Herausforderung in der Behandlung von Menschen mit Mukoviszidose (zystische Fibrose) dar. Spezifische diagnostische Schritte und therapeutische ...
Sarkoidose – Update 2025
Die Sarkoidose ist eine komplexe Multiorganerkrankung mit teils unzureichender wissenschaftlicher Evidenz. Der interdisziplinäre Austausch ist angesichts der vielen möglichen ...