
RSV-Prophylaxe – Antikörper und Impfungen
Autoren:
Dr. Andreas Trobisch
Forschungseinheit für neonatale Infektionserkrankungen und Epidemiologie und Klinische Abteilung für Neonatologie
Universitätsklinik f. Kinder- und Jugendheilkunde
Medizinische Universität Graz
E-Mail: andreas.trobisch@medunigraz.at
Univ.-Prof. Dr. Bernhard Resch
Forschungseinheit für neonatale Infektionserkrankungen und Epidemiologie und Klinische Abteilung für Neonatologie
Universitätsklinik f. Kinder- und Jugendheilkunde
Medizinische Universität Graz
E-Mail: bernhard.resch@medunigraz.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Respiratory Syncytial Virus (RSV) verursacht saisonale Epidemien bei Säuglingen, Kleinkindern und Senioren mit weltweit beträchtlicher Morbidität und Mortalität.Wirksame kurative Medikamente fehlen noch, jedoch stehen prophylaktisch monoklonale Antikörper zur Verfügung. Auch wird intensiv an Impfungen zum Schutz der Risikopopulation geforscht.
Keypoints
-
RSV verursacht saisonale Epidemien mit unterschiedlichem Verlauf je nach Wirtsfaktoren. Diese reichen von milder Rhinitis bis zu schwerer Bronchiolitis +/– Pneumonie.
-
Bisher stehen nur symptomatische Therapie und Prophylaxe mit monoklonalem Antikörper für Hochrisikopopulationen zur Verfügung.
-
Ein langwirksamer monoklonaler Antikörper – Nirsevimab – steht kurz vor der Zulassung und könnte ein flächendeckendes Schutzkonzept für sämtliche Säuglinge in ihren erste(n) Wintersaison(en) bieten.
-
Ein mögliches Impfkonzept könnte die maternale Immunisierung zum Schutz des Neugeborenen bieten, gefolgt von einer aktiven Immunisierung des Säuglings mit ca. 6 Monaten.
RSV stellt vor allem für Frühgeborene und Neugeborene mit Grunderkrankung ein hohes Risiko dar, da es bei Infektion der unteren Atemwegeeine schwerwiegende Bronchiolitis verursacht, welche nicht selten zu Oxygenierungsstörungen und Atemnotführt und intensivmedizinische Überwachung mit der entsprechenden Therapie notwendig macht.
Klinischer Verlauf und symptomatische Therapie
Bis zum 2. Lebensjahr sind 90–100% aller Kinder mit dem Virus in Kontakt gekommen. Übertragen wird es vor allem durch Kontakt mit infektiösem Sekret, in welchem esje nach Material mehrere Stunden überleben kann. Zudem können RS-Viren mittels Tröpfchen (Husten, Niesen, …), welche die Nasen-/Rachenschleimhaut, Bindehaut oder direkt den oberen Atemweg erreichen, übertragen werden. Von dort wandert das Virus dann in die unteren Atemwege, wo es eine Entzündung der kleinsten Atemwege mit oder ohne allgemeine Lungenentzündung auslösen kann. Das Erkrankungsspektrum reicht dabei von milder Rhinitis bis Bronchiolitis +/– Pneumonie, wobei die Wirtsfaktoren entscheidend sind.
Schwerere Verläufe sind bekannt bei (ehemaligen) Frühgeborenen, Erkrankung in jungem Alter (<2 Jahren), niedrigem Serum-RSV-Antikörperspiegel und Vorerkrankungen wie chronischen Lungenerkrankungen, angeborenen Herzerkrankungen oder angeborenen wie erworbenen Immunschwächen.
Bei älteren Menschen (>65 Jahre) kann RSV ebenfalls zu beträchtlicher Morbidität und Mortalität beitragen, indem es zugrunde liegende Beschwerden der Atemwege wie COPD oder Asthma verschlimmert bzw. akute Atemwegserkrankungen auslöst (Openshaw PJM et al.2017).
Medikamentöse Ansätze zur Behandlung sind begrenzt und derzeit besteht die Therapie einer RSV-Infektion in Symptombehandlung. Diese umfasst ausreichende Flüssigkeitszufuhr, abschwellende Nasentropfen bzw. Pflege der Nasenschleimhaut mit Kochsalzlösung und bei Hypoxämie Sauerstoffzufuhr.
Prophylaxe mit Antikörpern
Bisher konnte nur den Hochrisikopatienten ein monoklonaler Antikörper – Palivizumab – prophylaktisch angeboten werden. Dies entspricht lediglich einem Anteil von <7% aller Neugeborenen in Österreich. Nachteile dieser Prophylaxe sind die hohen Kosten (welche nur nach chefärztlicher Bewilligung von den Krankenkassen übernommen werden) und die monatlich notwendige Applikation (5–6 Impfungen/Saison), da die Antikörper im Serum rasch wieder abnehmen.
In mehreren Studien wurde jedoch gezeigt, dass 75% aller Kinder, welche wegen RSV stationär aufgenommen werden, Reifgeborene ohne Grunderkrankung sind, für die bisher keine geeigneten Präventionsstrategien bestehen (Esposito S et al.2022).
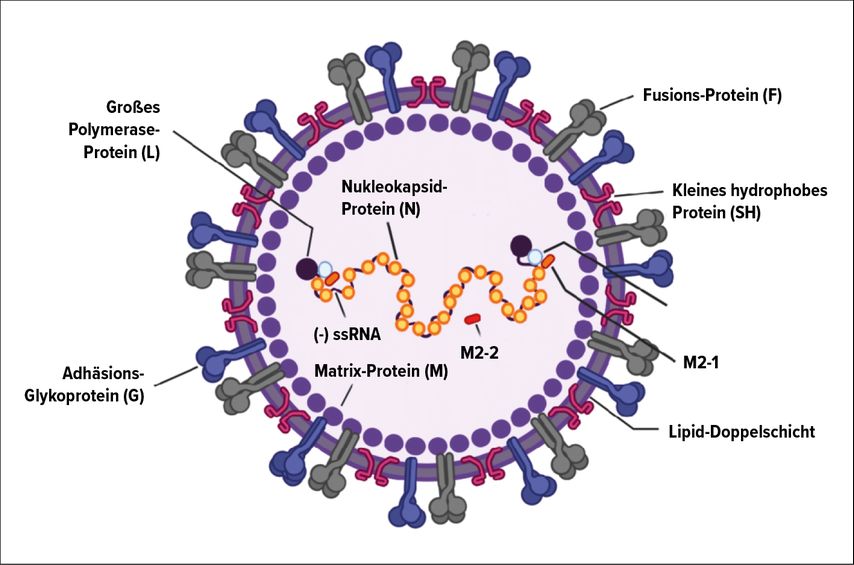
Um mögliche Therapie- und Prophylaxeoptionen zu verstehen, muss die Grundstruktur des RS-Virus beleuchtet werden. Als Einzelstrang-RNA-Virus besteht das Genom aus 15 200 Nukleotiden, welche 11 Proteine kodieren. Von diesen sind vor allem die Oberflächenproteine G und F von Bedeutung, da sie die höchste Antigenwirkung zeigen und für das Anheften und die Fusion des Virus mit einer Wirtszelle verantwortlich sind (Abb. 1).
Palivizumab
Palivizumab wurde 1998 von der FDA zugelassen und wirkt, indem sich der monoklonale Antikörper an das F-Protein bindet und somit eine Fusion mit der Wirtszelle verhindert wird. Zudem wird die Virusaktivität reduziert und eine Zell-zu-Zell-Transmission von RSV unterbunden.
Ab 2024: Nirsevimab
Der neu zugelassene und voraussichtlich ab 2023 in Deutschland und 2024 in Österreich verfügbare verbesserte Antikörper Nirsevimab bindet höherpotenter an selbiges Protein, blockiert demnach auch wirkungsvoller den Eintritt des Virus in die Wirtszelle und muss lediglich 1x pro Saison verabreicht werden. Bei ehemaligen Frühchen – 29+0 Schwangerschaftswochen (SSW) bis 24+6 SSW – zeigte sich im Vergleich zu Placeboeine signifikante 70,1%ige Reduktion des Risikos für eine RSV-Infektion der unteren Atemwege mit medizinischer Behandlungsnotwendigkeit (Griffin MP et al.2020). Die Effektivität,die o.g. Erkrankung bei FG> 34.SSW und Reifgeborenen zu verhindern,betrug74,5% (Hammitt LL et al.2022).
Warum ist die Entwicklung eines RSV-Impfstoffes so problematisch?
In den 1960er-Jahren wurde, angelehnt an vorhandene Impfstoffe, Formalin-inaktiviertes RSV-Vakzin (FI-RSV) an Säuglinge verabreicht. Nebst einer bescheidenen Schutzwirkung zeigte sich zudem beiden geimpften Kleinkindern, dass sie auf eine Folgeexposition mit dem Wildvirus mit einer überschießenden, schwer verlaufenden Erkrankung, einer sogenannten„enhanced RSV disease“ (ERD), reagierten. Protein-basierte Impfstoffe lösten demnach bei RSV-naiven Säuglingen Immunkomplexablagerungen in den kleinsten Atemwegen aus, welche zu vermehrter Inflammation führten. Dieses Phänomen wurde jedoch nicht beobachtet, wenn die Kinder zuvor Kontakt mit RSV hatten.
Eine Impfung mit einem Lebendvirusvakzin würde ERD ausschließen und zu einer raschen Immunantwort führen, jedoch werden diese Impfstoffe meist intranasal verabreicht und können zu vorübergehender Rhinitis und Schleimhautschwellung führen. Beides sind zu vermeidende Nebenwirkungen, da Säuglinge auf die Nasenatmung, vor allem beim Trinken, angewiesen sind. Zudem würde aufgrund eines möglichen Nestschutzes der Mutter ein Lebendvakzin sinnvollerweiseerst mit etwa 3 bis 6 Monaten verabreicht werden können, was zu einer empfindlichen Prophylaxelücke in den ersten Lebensmonaten führen würde.
Impfung in der Schwangerschaft
Eine aussichtsreiche Alternative, um die Kleinsten zu schützen, scheint die Impfung der Mutter in der Schwangerschaft zu sein. Wie wir auch von anderen Impfungen wissen, übertragen werdende Mütter sogar in höherem Ausmaß schützende Antikörper an das ungeborene Kind, als sie für sich selbst behalten. Dieser Nestschutz kann mittels Impfung angehoben werden und idealerweise über die ersten Monate das Neugeborene vor einer Infektion schützen.
Impfstoffe in Entwicklung
Ein Nanopartikel-Impfstoff von Novavax (ResVax), welcher das F-Protein enthält, wurde kürzlich in einer Phase-III-Studie untersucht. Dabei zeigte er ein gutes Sicherheitsprofil und schützte im Zeitraum von 90 Tagen nach der Geburt in 44% vor stationärer Aufnahme aufgrund von RSV-Infektion der unteren Atemwege, jedoch wurden dabei nicht die vordefinierten primären Endpunkte erreicht (Madhi SA et al.2020).
Zwei weitere Impfstoffe befinden sich in Phase-III-Studien und bauen ihre Antigenität über die „pre-fusions conformation“ des F-Proteins auf. Sowohl der RSVPreF3- (GSK) als auch der RSVPreF-Impfstoff (Pfizer)zeigen ein günstiges Sicherheitsprofil wie auch eineguteProduktion von neutralisierenden Antikörpernmit effizientem transplazentarem Transfer (clinicaltrials.gov 2020; Simoes E2021).
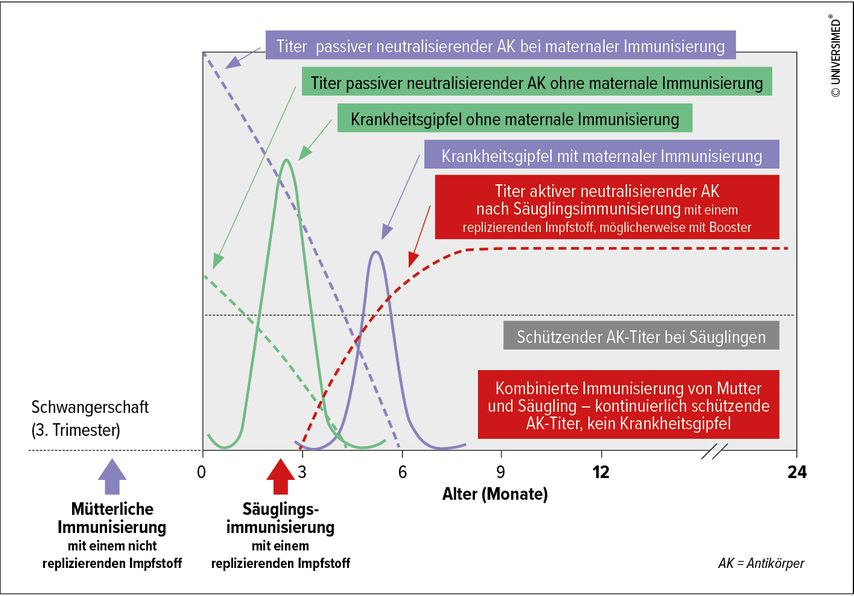
Abbildung 2 zeigt, wie Säuglinge durch Impfungen zu schützen wären. Ein maternaler Impfstoff würde im 3. Trimester verabreicht werden und die passiven neutralisierenden Antikörper würden den Säuglingen einen Schutz bis zu einem Alter von (geschätzt) maximal 6 Monaten gewähren. In der Praxis würde dies eine RSV-Erkrankung im Alter von 2 bis 3 Monaten (ohne Impfung) auf 4 bis 6 Monate mitigieren. In weiterer Folge könnte eine aktive Immunisierung im Alter von 3 bis 6 Monaten diesen mitigierten Erkrankungsgipfel verhindern und den Säugling langfristig vor einer Erkrankung schützen.
Abb. 2: Theoretische Lösung mittels verschiedener Impfungen, um Säuglinge bis 24 Monate vor RSV zu schützen (modifiziert nach Shaw CA et al. 2013)
Fazit
Bis zur Etablierung zuverlässiger Impfstoffe für Schwangerschaft und Säuglingsalter bleibt die Prophylaxe mit monoklonalem Antikörper die beste Option, wobei Nirsevimab, wenn für sämtliche Neugeborenen zugelassen, diese Lücke überbrücken kann.
Literatur:
• clinicaltrials.gov: Retrieved from a trial to evaluate the efficacy and safety of RSVpreF in infants born to women vaccinated during pregnancy. Laufende Studie von Pfizer, Version: 17. Juni 2020 • Esposito S et al.: RSV prevention in all infants: which is the most preferable strategy. Front Immunol 2022; 3: 880368 • Griffin MP et al.: Single-dose Nirsevimab for prevention of RSV in preterm infants. N Engl J Med 2020; 383: 415-25 • Hammitt LL et al.: Nirsevimab for prevention of RSV in healthy late-preterm and term infants. N Engl J Med 2022; 386(9): 837-46 • Jung HE et al.: Contribution of dendritic cells in protective immunity against respiratory syncytial virus Infection. Viruses 2020; 12(1): 102 • Openshaw PJM et al.: Protective and harmful immunity to RSV infection. Annu Rev Immunol 2017; 35: 501-32 • Madhi SA et al.: Respiratory syncytial virus vaccination during pregnancy and effects in infants. N Engl J Med 2020; 383(5): 426-39 • Shaw CA et al.: The path to an RSV vaccine. Curr Opin Virol 2013; 3(3): 332-42 • Simoes E: Prefusion F-based respiratory syncytial virus immunization in pregnancy. Abstract RSVVW’21. www.resvinet.org/uploads/2/2/2/7/22271200/abstract_booklet_rsvvw21.pdf ; zuletzt aufgerufen am 20.1.2023
Das könnte Sie auch interessieren:
Radon – Risiko und Schutz in Österreich
Die WHO weist Radon als ein Karzinogen der Klasse 1 (nachweislich krebserregend) und die zweithäufigste Ursache für Lungenkrebs aus.1 In Österreich werden etwa 10% der ...
Post-Covid-Rehabilitation: die zentrale Rolle der Fatigue
Fünf Jahre nach dem ersten Ausbruch von SARS-CoV-2 sind die Folgen von Long bzw. Post Covid weiterhin allgegenwärtig. Wir sehen eine große Gruppe meist jüngerer Patient:innen, die trotz ...
.jpg)

