Opportunistische Infektionen bei Immunsuppression
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Immunsuppressive Therapie ist ein Risikofaktor für das Auftreten von Infektionen. Dabei spielen auch manchmal Keime eine Rolle, die bei immunkompetenten Patienten nicht zu Erkrankungen führen würden. Im Folgenden soll der unterschiedliche Einfluss verschiedener immunsuppressiver Therapien auf die Entstehung von Infektionen beleuchtet werden. Die wichtigsten opportunistischen Infektionen und der neue Konsensus zur latenten Tuberkulose bei Biologikatherapie werden vorgestellt.
Keypoints
-
Auch bei Immunsupprimierten bleiben seltene Infektionen selten.
-
Bei unzureichendem Ansprechen auf empirische Therapien oder bei einem atypischen klinischen Bild (z.B. deutliche Hypoxie bei kaum Infiltrat) muss an seltene Ursachen gedacht werden.
-
Cortisondosis und -dauer bleiben ein großer Risikofaktor für Infektionen.
-
Der Konsensus zum Vorgehen bei latenter Tuberkulose und Biologikatherapien wird demnächst publiziert.
Unter immunsuppressiver Therapie wird das Immunsystem verschiedenartig beeinflusst, sodass es gegen die Invasion von Krankheitserregern und auch gegen bereits im Körper vorhandene Keime nicht mehr so effizient vorgehen kann. Dies führt dazu, dass einerseits banale Infektionen bei Immunsupprimierten häufiger auftreten und andererseits auch seltene, unter normalen Umständen ungefährliche Mikroorganismen zu Erkrankungen führen können.
Welche Infektionen sind bei Immunsuppression zu erwarten?
Den Hauptteil machen jene Infektionen aus, die auch bei Immunkompetenten am häufigsten vorkommen. Hierzu zählen Harnwegsinfekte, respiratorische Infekte sowie Hautinfektionen mit typischen Krankheitserregern. Bei immunsupprimierten Patienten finden sich jedoch aufgrund vorangegangener antibiotischer Therapien vermehrt Resistenzen gegen verschiedene Antibiotika. Eine weitere Gruppe von Erkrankungen bilden Reaktivierungen von früheren Infektionen, die unter Immunsuppression wieder auftreten (z.B. Herpes zoster, Mykobakterien). Eine bedeutende Infektionsquelle sind auch umgebungsbedingte Einflüsse, etwa durch Reisen, Hobbys oder den Beruf. Damit kommen auch Krankheitserreger wie Parasiten, endemische Pilze und Viren, Legionellen, Histoplasma, Nocardia und Mykobakterien als Auslöser von Erkrankungen infrage. Im Rahmen von Krankenhausaufenthalten muss auch immer an die Gefahr nosokomialer Infektionen gedacht werden. Zusätzlich zu den Krankheitserregern, die für alle Menschen eine Gefahr für Infektionen darstellen, kommen bei Immunsupprimierten einige weitere Erreger für solche Infektionen in Betracht. Hierzu zählen Pneumocystis jirovecii und auch andere Pilze wie Aspergillus, Cryptococcus und Mucormycosis. Unter den Parasiten sind Strongylosides und Toxoplasma zu erwähnen und als wichtige Virusinfektion die Zytomegalie (CMV). Selten kann es auch zu Infektionen mit Stenotrophomonas, Burkholderia und nichttuberkulösen Mykobakterien kommen.
Immunsuppressive Therapie und ihr Einfluss auf die Infektabwehr
Der Einfluss einer immunsuppressiven Therapie auf das Risiko einer Infektion mit bestimmten Krankheitserregern ist meist nicht eindeutig vorhersehbar. Prinzipiell begünstigt eine verminderte humorale Immunantwort (z.B. Hypogammaglobulinämie, Rituximab-Therapie) Infektionen von Bakterien mit Kapsel (Pneumokokken, Meningokokken) und fördert auch das Auftreten einer Hepatitis-B-Reaktivierung. Unter Neutropenie treten vermehrt Infektionen mit endogenen Bakterien, Candida und Nocardia auf, während T-Zell-Defekte insbesondere zu Infektionen mit intrazellulären Organismen führen. Hierzu zählen Mykobakterien, Pneumocystis, Aspergillus und Herpesviren (CMV).
Glukokortikoide spielen eine Hauptrolle in der Entstehung von Infektionen. Unter Glukokortikoidtherapie kommt es in der Immunabwehr zu einer verminderten Einwanderung von Neutrophilen sowie zu einer Reduktion der Makrophagenphagozytose und Antigenpräsentation. All diese Effekte sind abhängig von der Dosis der Glukokortikoide. Als Grenzwert für ein sehr hohes Infektionsrisiko gilt eine Tagesdosis ab 40mg Prednison. Eine Dosis unter 7,5mg Prednison/Tag birgt nur ein geringes Risiko. Die Kombination mit anderen immunsuppressiven Medikamenten, das Patientenalter sowie die Dauer der Behandlung steigern jedoch die Wahrscheinlichkeit für Infektionen. Unter Steroidtherapie treten hauptsächlich gewöhnliche bakterielle und virale Infekte auf, aber auch Herpes-zoster-Infektionen sowie Infektionen mit Staphylococcus aureus und Candida. Zusätzlich besteht ein vermehrtes Risiko für Infektionen mit Mycobacterium tuberculosis und Pneumocystis jirovecii.
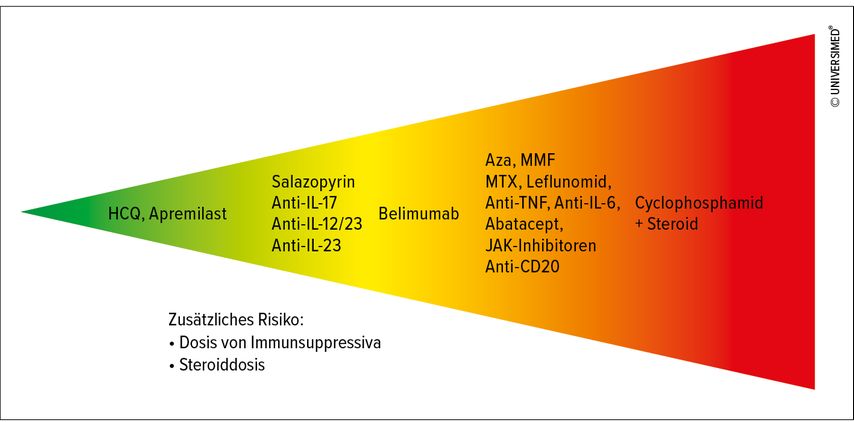
Alle weiteren immunsuppressiven Medikamente können grob in solche mit hohem, mittlerem und geringem Infektionsrisiko unterteilt werden. Das höchste Infektionsrisiko birgt Cyclophosphamid (insbesondere in Kombination mit Glukokortikoiden). Ebenfalls ein beträchtliches Risiko für Infektionen besteht bei Azathioprin, Mycophenolat-Mofetil, Methotrexat, Leflunomid, TNF-Blockern, Anti-IL-6, Abatacept, JAK-Inhibitoren und Rituximab (Abb.1). Die Dosis und eine zusätzliche Therapie mit Glukokortikoiden haben hierbei natürlich auch entscheidenden Einfluss. Unter Rituximab besteht eine deutliche Gefahr für eine Hepatitis-B-Reaktivierung. Hinsichtlich Tuberkulose gibt es hierbei kein erhöhtes Risiko. Im Gegensatz dazu ist unter TNF-Inhibitor-Therapie das Tuberkuloserisiko bis zu 4-fach erhöht. Auch bakterielle, virale, fungale und opportunistische Infektionen treten vermehrt auf. Unter dem Einsatz von JAK-Inhibitoren gibt es zusätzlich ein 3,6-fach erhöhtes Risiko für das Auftreten von Herpes zoster.
Pneumocystis jirovecii
Pneumocystis jirovecii wird den Pilzen zugeordnet und ist der Verursacher der Pneumocystis-Pneumonie. Besonderes Risiko besteht bei prolongierter Neutropenie, einer niedrigen Anzahl an CD4-Zellen (HIV), in den ersten 6 Monaten nach einer Organtransplantation, bei intensiver Immunsuppression, reduzierter zellvermittelter Immunität, hohem Steroidbedarf sowie bei der Kombination von Steroiden mit zytotoxischen Substanzen (Cyclophosphamid). Die Pneumonie führt zu Husten, Atemnot und Hypoxämie. Im Thoraxröntgen finden sich oft nur wenige Pathologien – eventuell sind diffuse bilaterale Infiltrate sichtbar. Im Blutbild ist meist die LDH erhöht sowie Beta-D-Glucan nachzuweisen (Pilznachweis). Milchglasveränderungen und manchmal auch zystische Veränderungen sind das typische Bild in der Computertomografie. Die Diagnose wird über den Keimnachweis aus der bronchoalveolären Lavage gestellt.
Zur Therapie eignet sich in erster Linie Co-Trimoxazol (15–20mg/kg Trimethoprim/Tag). Begleitend wird eine Steroidtherapie von etwa 60mg Prednisolon täglich gegeben. Nach etwa 7 Tagen ist eine klinische Verbesserung zu erwarten, die Therapie sollte für etwa 21 Tage in therapeutischer Dosierung fortgesetzt werden.
Derzeit gibt es keine Richtlinien für die Indikation einer Prophylaxe für eine Pneumocystis-Pneumonie im Rahmen einer immunsuppressiven Therapie bei Rheumaerkrankungen. Allgemein wird jedoch meist bei einer Kombination von Glukokortikoiden und Cyclophosphamid eine Prohylaxe gegeben. Auch bei Prednisondosis >20mg/Tag für länger als einen Monat zusammen mit einem zusätzlichen immunsuppressiven Medikament sind prophylaktische Maßnahmen sinnvoll. Die Co-Trimoxazol-Dosis in der Prophylaxe beträgt hierbei 160/800mg 3x/Woche oder 80/400mg täglich.
Tuberkulose/latente Tuberkuloseinfektion (LTBI)
In Österreich wurden im Jahr 2020 388 Fälle von Tuberkulose gemeldet, was einer Inzidenz von 4,4 auf 100 000 Einwohner und weltweit gesehen einer sehr niedrigen Inzidenz entspricht. Zur Diagnose der Tuberkulose ist der Erregernachweis in (Ziehl-Neelsen-)Färbung, Kultur oder PCR notwendig. Indirekte Nachweise sind ein typisches Muster im Thoraxröntgen und ein positiver IGRA („interferon-gamma release assay“; z.B. Quantiferon) oder Tuberkulinhauttest.
Bei der latenten Tuberkuloseinfektion persistieren nach einer Infektion vitale Tuberkulosebakterien im Organismus. Die infizierte Person ist klinisch gesund und nicht ansteckend für ihre Umgebung. Der IGRA oder Tuberkulinhauttest sind positiv, aber eine Tuberkuloseerkrankung ist ausgeschlossen. Verschiebt sich das Gleichgewicht zwischen immunologischer Kontrolle und bakterieller Aktivität zu Ungunsten der Immunität, kann sich aus der LTBI eine Tuberkulose entwickeln (Reaktivierung). Die Prävalenz der LTBI beträgt weltweit ca. 25%. In Österreich rechnet man damit bei ca. 3–5% der Bevölkerung.
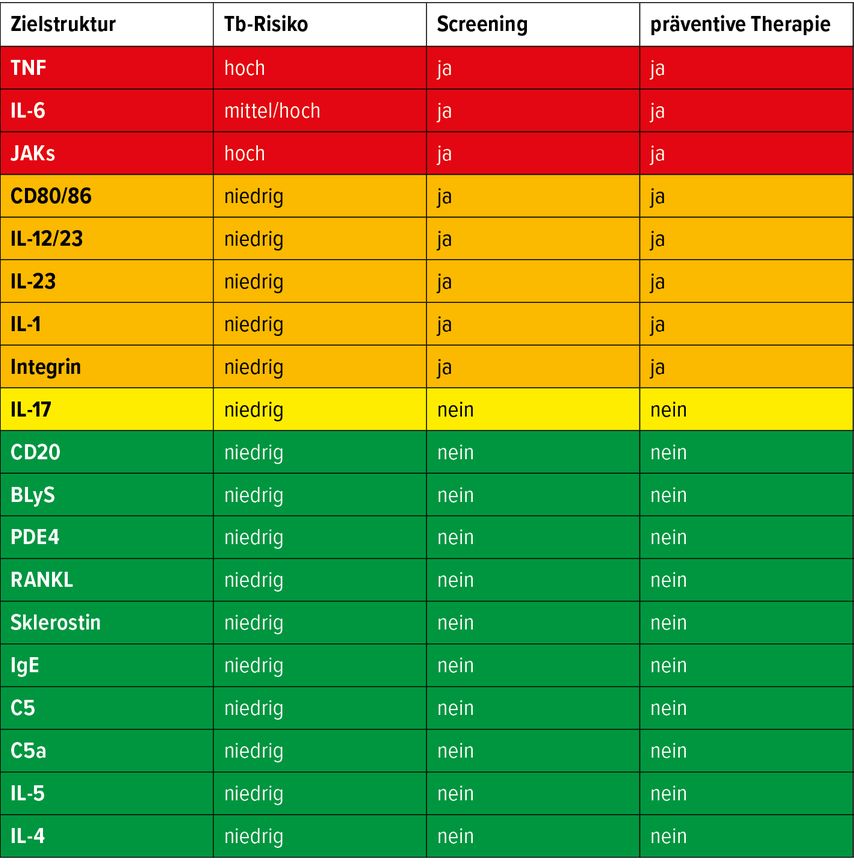
Rezent wurde ein österreichweiter Konsensus zum Vorgehen bei LTBI beim Einsatz von Biologikatherapien erzielt. Dieser ist noch nicht publiziert, wird jedoch die wichtigsten Punkte zu Screening und präventiver Therapie bei LTBI klarstellen. An dieser Stelle darf bereits ein Einblick in die Tabelle zur Risikoeinschätzung der verschiedenen Therapien gezeigt werden (Abb. 2).
Abb. 2: Verschiedene b/tsDMARD („biological/targeted synthetic disease modifying anti-rheumatic drugs“) und ihr Risiko für die Reaktivierung einer LTBI (Quelle: E. Rath)
Literatur:
bei der Verfasserin
Das könnte Sie auch interessieren:
Akuter Thoraxschmerz und Dyspnoe im Nachtdienst – ein pragmatischer Ansatz
Bei akutem Thoraxschmerz oder Dyspnoe im Nachtdienst sollte eine vitale Gefährdung initial anhand der Vitalparameter erkannt werden. Potenziell tödliche Ursachen sollten primär evaluiert ...
Inklusivere Ansätze in der Behandlung von Lungenerkrankungen
Warum Intersektionalität und Barrierefreiheit Merkmale klinischer Qualität sind: Der vorliegende Beitrag fasst zentrale Inhalte des Vortrags „Inklusivere Ansätze in der Behandlung von ...