Bronchoskopische Verfahren und ihre Risiken
Autor:
Dr. Lars Hagmeyer
Klinik für Pneumologie und Allergologie; Zentrum für Schlaf- und Beatmungsmedizin
Krankenhaus Bethanien, Solingen
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Diagnose interstitieller Lungenerkrankungen ist eine große interdisziplinäre Herausforderung. Neben der klinisch-radiologischen Diagnostik gewinnt die minimalinvasive Bronchoskopie zunehmend an Bedeutung. Mehrere bronchoskopische Verfahren der Probengewinnung stehen zur Verfügung, wichtig ist allerdings eine präinterventionelle differenzialdiagnostische Eingrenzung der Verdachtsdiagnosen zur rationalen Planung der Entnahmetechniken. Dem Großteil der Patienten kann dank der bronchoskopisch erhobenen Befunde eine chirurgische Lungenbiopsie erspart werden.
Keypoints
-
Die Bronchoskopie gewinnt in der Differenzialdiagnostik von interstitiellen Lungenerkrankungen zunehmend an Bedeutung.
-
Die Verfahren der Probengewinnung sind vielfältig. Wichtig ist eine präinterventionelle Planung zur Auswahl der am besten geeigneten Technik zur Probengewinnung. Dabei sollte vor allem der ILD-Phänotyp anhand der klinisch-radiologischen Befunde gewürdigt werden.
-
Ist eine invasive Probengewinnung erforderlich, kann dank der bronchoskopischen Methoden eine chirurgische Lungenbiopsie meist vermieden werden.
Zentrales Instrument der Diagnostik bei interstitiellen Lungenerkrankungen (ILD) ist die multidisziplinäre Diskussion mit Würdigung der Befunde aus klinisch-serologischen und radiologischen Untersuchungen. Bleibt die Entität der Lungenfibrose unklar, können invasive Verfahren einen wichtigen Beitrag zur Diagnosefindung leisten. Neben der historisch etablierten chirurgischen Lungenbiopsie gewinnt hier die minimalinvasive Bronchoskopie zunehmend an Bedeutung. An bronchoskopischen Methoden stehen für die ILD-Diagnostik verschiedene Techniken zur Verfügung, dazu zählen im Speziellen die bronchoalveoläre Lavage, die transbronchiale Zangenbiopsie, die transbronchiale Kryobiopsie und bei vermuteter Sarkoidose zusätzlich die endobronchiale Schleimhautbiopsie und die endosonografisch gesteuerte transbronchiale Nadelaspiration. Im Folgenden werden die einzelnen Verfahren und ihre assoziierten Risiken betrachtet.
Bronchoalveoläre Lavage
Die Gewinnung einer bronchoalveolären Lavage (BAL) ist ein minimalinvasives, risikoarmes und einfaches Verfahren. Die BAL-Differenzialzytologie kann wertvolle Zusatzinformationen in der ILD-Differenzialdiagnostik liefern, insbesondere bei vermuteter exogen-allergischer Alveolitis (EAA), Sarkoidose und einigen seltenen Lungenerkrankungen (z.B. Alveolarproteinose). Allerdings ist das Verfahren in der klinischen Praxis wenig standardisiert und die Probenprozessierung ist logistisch anspruchsvoll. Es besteht ein Restrisiko für prozedurassoziierte akute ILD-Exazerbationen (bei idiopathischer Lungenfibrose 2–3%1). Leider gibt es bei der BAL-Diagnostik nur wenige wirklich erkrankungsspezifische Befundkonstellationen und kaum ein Parameter zeichnet sich durch eine gleichermaßen gute Sensitivität und Spezifität aus. Darüber hinaus kann die Differenzialzytologie bei bestimmten Erkrankungen je nach Biologie, radiologischem Phänotyp und Exazerbationsstatus erheblich variieren (z.B. Sarkoidose, EAA). Die Leitlinien würdigen die BAL aber aufgrund des niedrigen Risikos durchaus als valides diagnostisches Instrument.2,3
Transbronchiale Zangenbiopsie
Die transbronchiale Zangenbiopsie (TBB) ist ein bronchoskopisches Verfahren zur Histologiegewinnung aus dem Lungenparenchym. Dabei werden 4–6 Biopsien in der Regel unter Röntgendurchleuchtung asserviert. Vorteil des Verfahrens ist die niedrige Komplikationsrate (Mortalität <0,05%, Blutung 1–4%, Pneumothorax 1–6%). Verfahrensbedingt sind die Biopsate jedoch häufig klein und weisen Quetschungsartefakte auf, was den Pathologen gerade bei ILD-Fällen häufig die Beurteilung erschwert.
Darüber hinaus sind bei korrekter Entnahmetechnik keine Pleuraanteile miterfasst. Dies ist relevant, da sich bei vielen fibrotischen ILD die krankheitsdefinierenden Prozesse pleuranah abspielen. Diese Aspekte verdeutlichen, dass die TBB insbesondere bei ILD mit peribronchovaskulärer und zentrilobulärer Betonung mit entzündlichem Aspekt ihren Stellenwert hat (z.B. Sarkoidose Typ 2 und3, organisierende Pneumonie, EAA, eosinophile Pneumonie etc). So liegt der „diagnostic yield“ bei der nichtfibrotischen EAA und bei der Sarkoidose Typ 2 und 3 bei über 65%, die Sensitivität und Spezifität liegen bei der kryptogen-organisierenden Pneumonie bei 64% bzw. 86%.2
Transbronchiale Kryobiopsie
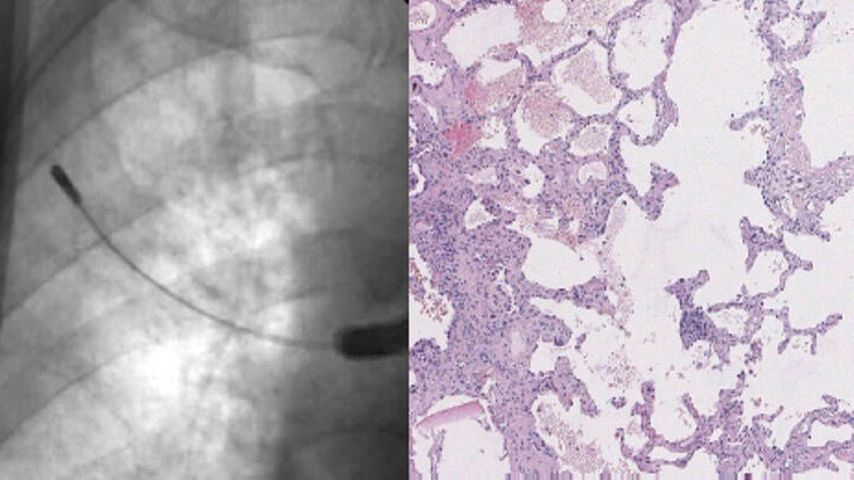
Die transbronchiale Kryobiopsie (CryoTBB) ist ein relativ neues Verfahren in der ILD-Diagnostik. Kryobiopsate zeichnen sich im Vergleich zur TBB dadurch aus, dass sie um ein Vielfaches größer sind und keine Quetschungsartefakte aufweisen. Das Verfahren kommt insbesondere in der Diagnostik primär fibrosierender ILD zum Einsatz. Dabei wird eine dünne, flexible Kryosonde über das Bronchoskop in die Lungenperipherie vorgeführt (Abb. 1), die Sondenspitze wird sodann auf eine Temperatur von etwa –80°C heruntergekühlt. Das durch das Anfrieren an der Sonde festhaftende Biopsat wird dann durch Sondenzug aus der Lunge extrahiert, nach Abtauen von der Sonde entfernt und in Formalinlösung zur histologischen Aufarbeitung versendet.
Abb. 1: Bronchoskopie mit transbronchialer Kryobiopsie unter Durchleuchtung mit histologischem Schnitt
Metaanalysen zeigten, dass die diagnostische Aussagekraft der chirurgischen Lungenbiopsie nicht wesentlich unterlegen ist (80% vs. 86%).4 In einer prospektiven Vergleichsstudie zeigten die histologischen Befunde von CryoTBB und chirurgischen Lungenbiopsaten eine sehr gute Übereinstimmung, Kryobiopsiebefunde mit einem wahrscheinlichen oder definitiven histologischen Befundmuster sind hochverlässlich.5
Eine erste Leitlinie und ein Konsensuspapier streben eine Standardisierung der Prozedur an.6,7 So sollten die Proben aus unterschiedlichen Lungensegmenten entnommen werden, um die diagnostische Aussagekraft zu erhöhen. Das Ende der Kryosonde sollte unter Durchleuchtungskontrolle etwa 1cm proximal der Pleura positioniert werden. Prophylaktisch sollte ein Ballondevice endobronchial in den Ziellappen eingebracht werden. Nach Sondenextraktion kann der geblockte Ballon im Falle einer Blutung eine endoluminale Blutausbreitung und damit das Risiko einer Bronchienverlegung mit respiratorischer Insuffizienz verhindern. Generell werden dünne Kryosonden bevorzugt, allerdings ist die Evidenz in diesem Punkt uneinheitlich.8 In einer prospektiven Studie konnte gezeigt werden, dass durch Reduktion der Biopsiezahl und der Kryosonden-Anfrierzeit sowie durch die Verwendung eines prophylaktischen Bronchusblockers die Komplikationsrate hochsignifikant reduziert werden kann (Reduktion des Risikos für Pneumothorax, moderate oder schwere Blutung, Myokardinfarkt, Sedierungsüberhang, Exazerbation und Verringerung der 30-Tage-Mortalität).9
Gemäß der CHEST-Leitlinie gelten für eine CryoTBB folgende Kontraindikationen: Exazerbation einer ILD, erhöhtes Blutungsrisiko (therapeutische Antikoagulation, Thrombopenie <50000/μl, plasmatische Gerinnungsstörung INR >1,5, Thrombozytenaggregationshemmer (außer Aspirin), pulmonale Hypertonie (sPAP >40mmHg) und schwere lungenfunktionelle Einschränkung (forcierte Vitalkapazität <50% vom Soll, CO-Diffusionskapazität DLCO <35% vom Soll).
Die verfügbaren Daten geben erste Hinweise, dass die 30-Tage-Mortaltät nach CryoTBB an prozedurerfahrenen Einrichtungen wahrscheinlich bei etwa 1–2% liegt und damit niedriger als bei der chirurgischen Lungenbiopsie ist (ca. 3%).2,3 Das Risiko für einen Pneumothorax liegt bei ca. 13%, das für relevante Blutungen bei ca. 5%. Weitere Studien sind erforderlich, um einerseits das Verfahren an sich sicherer zu machen und andererseits Patienten mit einem erhöhten Risiko für einen komplikativen Verlauf präinterventionell besser identifizieren zu können.
Sondersituation Sarkoidose
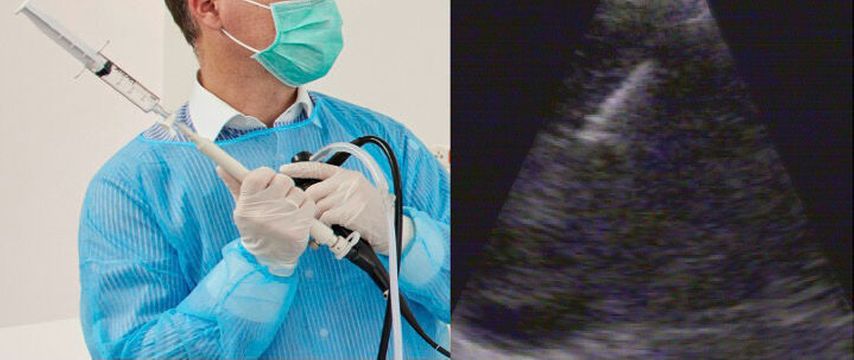
Für die Diagnosestellung der Sarkoidose ergibt sich eine Sondersituation. Zwar manifestiert sich die Erkrankung bei Lungenbeteiligung auch als ILD, allerdings ergeben sich aufgrund der Manifestation als Systemerkrankung besondere Möglichkeiten der Histologiegewinnung. So stehen hier insbesondere noch die risikoarme endobronchiale Schleimhautbiopsie (EB) und die endosonografisch gesteuerte transbronchiale oder transösophageale Nadelaspiration (EBUS-TBNA oder EUS-FNA) aus den mediastinalen und hilären Lymphknoten zur Verfügung (Abb. 2). Neben der BAL kann abhängig vom Röntgentyp der Sarkoidose zusätzlich mit verschiedenen Methoden noch histologisches Material asserviert werden („diagnostic yield“: EB 20–61%; TBB 37–90%; EBUS-TBNA 80–94%; EUS-FNA 77–94%).10 Erste Arbeiten deuten darauf hin, dass nach diesem Konzept auch die EBUS-TBNA und die CryoTBB wertvollekomplementäre Methoden für die Diagnosestellung darstellen könnten.11
Abb. 2: Bronchoskopie mit endosonografisch gesteuerter Nadelbiopsie (EBUS-TBNA) aus mediastinalen Lymphknoten
Schlussfolgerung
Die diagnostischen Möglichkeiten der Bronchoskopie in der ILD-Diagnostik sind vielfältig. Präinterventionell kann anhand der klinischen und radiologischen Befunde eine erste differenzialdiagnostische Eingrenzung erfolgen. Dies bietet sich an, da je nach Phänotyp der Erkrankung (fibrosierende versus nichtfibrosierende ILD, Sarkoidose-Röntgentyp, Exazerbation der ILD etc.) die interventionelle Herangehensweise spezifiziert werden kann. Bei vielen Patienten kann mithilfe der bronchoskopischen Diagnostik eine sichere Diagnose gestellt und die risikoträchtigere chirurgische Lungenbiopsie vermieden werden.
Literatur:
1 Abe M et al.: Risk factors for acute exacerbation following bronchoalveolar lavage in patients with suspected idiopathic pulmonary fibrosis: A retrospective cohort study. Adv Respir Med 2021; 89(2): 101-9 2 Raghu G et al.: Diagnosis of hypersensitivity pneumonitis in adults. An official ATS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med 2020; 202(3): e36-e69 3 Behr J et al.: [German Guideline for Idiopathic Pulmonary Fibrosis]. Pneumologie 2020; 74(5): 263-93 4 Raghu G et al.: Diagnosis of idiopathic pulmonary fibrosis. an official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med 2018; 198(5): e44-e68 5 Troy LK et al.: Diagnostic accuracy of transbronchial lung cryobiopsy for interstitial lung disease diagnosis (COLDICE): a prospective, comparative study. The Lancet Respir Med 2020; 8(2): 171-81 6 Maldonado F et al.: Transbronchial Cryobiopsy for the diagnosis of interstitial lung diseases: CHEST Guideline and Expert Panel Report. Chest 2020; 157(4): 1030-42 7 Hetzel J et al.: Transbronchial cryobiopsies for the diagnosis of diffuse parenchymal lung diseases: Expert statement from the Cryobiopsy Working Group on Safety and Utility and a call for standardization of the procedure. Respiration 2018; 95(3): 188-200 8 Zhou G et al.: The effect of 1.9-mm versus 2.4-mm probes in transbronchial cryobiopsies for interstitial lung diseases: a prospective analysis. Ann Transl Med 2021; 9(1): 20 9 Hagmeyer L et al.: Transbronchial cryobiopsy in fibrosing interstitial lung disease: Modifications of the procedure lead to risk reduction. Thorax 2019; 74(7): 711-4 10 Pedro C et al.: Role of bronchoscopic techniques in the diagnosis of thoracic sarcoidosis. J Clin Med 2019; 8(9): 1327 11 Aragaki-Nakahodo AA et al.: The complimentary role of transbronchial lung cryobiopsy and endobronchial ultrasound fineneedle aspiration in the diagnosis of sarcoidosis. Respir Med 2017; 131: 65-9
Das könnte Sie auch interessieren:
Therapieansprechen beurteilen, aber wie?
Wie werden Asthmasymptome beurteilt? Welcher Fragebogen ist dazu geeignet und spielt es eine Rolle, ob er von den Behandelnden oder den Betroffenen ausgefüllt wird? Unter anderem diesen ...
Komorbiditäten bei COPD
COPD-Patient:innen leiden oft an verschiedenen Begleitkrankheiten, die unabhängig von der Ausprägung der COPD den Krankheitsverlauf negativ beeinflussen können. Dies war Thema des ...