Behandlung des Bronchuskarzinoms
Autorin:
Ass. Dr. Elisabeth Schenk
Universitätsklinikum Krems
Karl Landsteiner Privatuniversität für Gesundheitswissenschaften
Krems an der Donau
E-Mail: elisabeth.schenk@krems.lknoe.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In der Onkologie gewinnt die individuelle Therapie immer mehr an Bedeutung, die spezifischen Nebenwirkungen sowie das daraus resultierende Nebenwirkungsmanagement erlangen höhere Gewichtung. Daher ist es von besonderer Bedeutung, bei Auftreten der ersten Nebenwirkung rasch zu agieren, um die entsprechende Strategie zur bestmöglichen Behandlung der Nebenwirkung mit dem geringsten Therapieverlust zu gewährleisten. Ziel ist es, die Patienten mit Therapieerfolg und größtmöglicher Sicherheit bei erhöhter Lebensqualität zu versorgen und zu behandeln.
Keypoints
-
Ein adäquates Nebenwirkungsmanagement ermöglicht es, die Lebensqualität der Patienten zu verbessern.
-
Im Fokus steht die zielgerichtete Behandlung in Hinblick auf Therapie und Nebenwirkungsprofil.
-
Bedeutend sind die interdisziplinäre Zusammenarbeit zur raschen und erfolgreichen Abklärung und das Management auftretender Nebenwirkungen für eine optimale Versorgung der Patienten im klinischen Setting.
Das Bronchuskarzinom gehört mit einer Inzidenz von über 4500 Neuerkrankungen pro Jahr neben Brust- und Dickdarmkrebs zu den drei häufigsten Karzinomen in Österreich. Die Weiterentwicklung des Therapiespektrums in den letzten Jahrzehnten hat dazu beigetragen, dass Patienten auch im Stadium IV eine deutlich höhere Lebenserwartung haben als in den Jahren davor, als nur die konventionelle Chemotherapie zur Verfügung stand.
Die Vielfalt zielgerichteter therapeutischerMöglichkeiten beim Bronchuskarzinom führtaber auch dazu, dass wir es mit einem deutlich breiteren Spektrum an Nebenwirkungen zu tun haben. Um eine optimale ganzheitliche Betreuung der Patienten zu gewährleisten, ist es notwendig, Nebenwirkungen rasch zu erkennen und adäquat – oft auch mit interdisziplinären Maßnahmen – zu bekämpfen, da die Nebenwirkungsprofile der in der Praxis verwendeten Therapieoptionen, wie die zielgerichteten Therapien selbst, in der Vielzahl der Fälle patienten- und behandlungsspezifisch sind.
Chemotherapie
Nausea und Emesis
Zu den am stärksten belastenden Nebenwirkungen der Chemotherapie zählen Übelkeit und Erbrechen. Durch gezielte prophylaktische Gabe von Antiemetika als Begleitmedikation kann die Chemotherapie deutlich verträglicher und dem emetogenen Potenzial der Therapie schon im Vorfeld entgegengewirkt werden.
Bewährt in der Antiemese haben sich 5-HT3-Rezeptor-Antagonisten (5-HT3-RA) (wie z.B. Ondansetron, Palonosetron), insbesondere in der Prophylaxe von akutem Auftreten von Übelkeit und Erbrechen, NK-1-Rezeptorantagonisten (wie z.B. Aprepitant) in der Prophylaxe von verzögertemAuftreten von Übelkeit und Erbrechen sowie Kortikosteroide (wie z.B Dexamethason, Prednison), welche sowohl in der akuten als auch in der verzögerten Form des Erbrechens Einsatz finden. In der Literatur ist für die Kombination aus einem 5-HT3-RA und einem Kortikosteroid ein erhöhter Effekt von 10–30% im Vergleich zu einer 5-HT3-RA-Monotherapie beschrieben. In der Praxis hat sich eine Kombination aus den 3 Wirkstoffgruppen in der Prophylaxe bei Zystostatika mit hohem emetogenem Potenzial bewährt.
Febrile Neutropenie
Die häufig verwendeten Platin-Chemotherapien weisen ein hohes hämatotoxisches Potenzial auf. Leukopenie, Thrombopenie und Neutropenie sind dosisabhängig und sehr oft auch dosislimitierend.
Im klinischen Alltag werdend regelmäßige Blutbildkontrollen unter Platin-Chemotherapien durchgeführt, insbesondere im Nadir. Bei kritischem Abfall der Leukozytenzahl sollten die Gabe eines Granulozyten-stimulierenden Faktors (G-CSF) und der nächste Chemotherapiezyklus erst nach Normalisierung der Werte erfolgen.
Insbesondere die febrile Neutropenie ist eine häufig auftretende und schwerwiegende Nebenwirkung bei Chemotherapien. Es besteht ein klarer Zusammenhang zwischen der Ausprägung von Neutropenie und dem Chemotherapie-Regime, stratifiziert in hohes Risiko (>20%), mittleres Risiko (10–20%) und geringes Risiko (<10%) fürdas Auftretender febrilen Neutropenie.
Bei platinhaltigen Kombinationstherapien, welche mit einem hohen Risiko (>20%) für eine febrile Neutropenie einhergehen, ist eine prophylaktische Gabe eines lang wirksamen G-CSF empfohlen und gemäß internationalen Empfehlungen indiziert.
Bei Patienten mit mittlerem Risiko (10–20%) ist es wichtig, patientenbezogene Risikofaktoren (wie z.B. Alter, Komorbiditäten) vor der prophylaktischen Gabe eines G-CSF zu berücksichtigen.
Die Gabe von G-CSF kann zu einer erhöhten Sicherheit hämatotoxischer Chemotherapien beitragen und das Risiko für eine febrile Neutropenie reduzieren.
Immuntherapie
Die Einführung der Immuntherapie mit Checkpoint-Inhibitoren bietet vielen Patienten im Stadium IV eine gut verträgliche Alternative zur Chemotherapie. Mit der leitlinienkonformen Gabe in Kombination mit einer platinhaltigen Chemotherapie, jedoch auch als Monotherapie bei PD-L1 >50% werden gute Ansprechraten erzielt. Gerade bei älteren und auch multimorbiden Patienten ist man geneigt, auf die Chemotherapie zur Gänze zu verzichten, um nicht mehr Schaden als Nutzen durch Nebenwirkungen zu erzielen. So harmlos für viele Patienten das Wort Immuntherapie klingt, die Nebenwirkungen können kritisch sein.
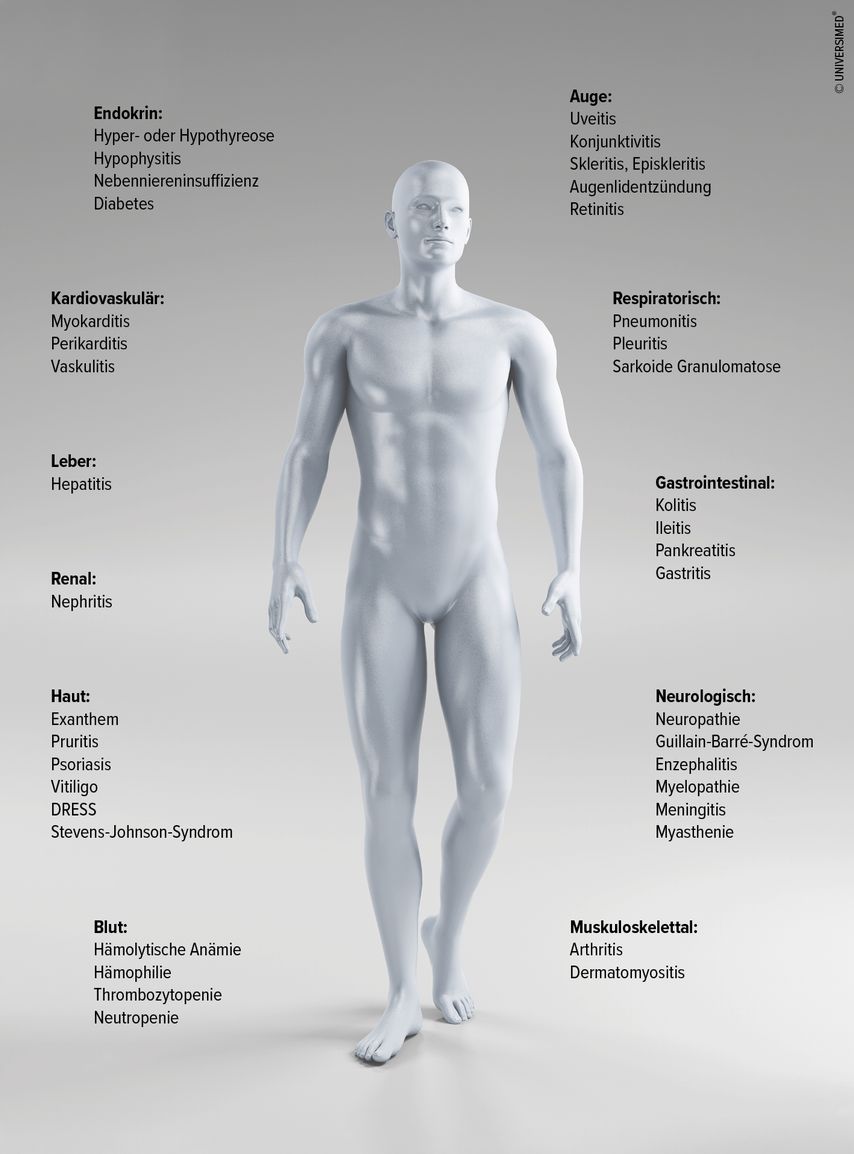
Von den Nebenwirkungen, ausgelöst durch überschießende Reaktionen des Immunsystems, kann prinzipiell jedes Organ betroffen sein. Häufige Nebenwirkungen finden sich an Haut, Kolon, Lunge, Leber und endokrinen Organen (Abb.1). Das zeitliche Auftreten ist zu jedem Zeitpunkt möglich, sowohl wenige Wochen nach Beginn als auch noch viele Monate nach Abschluss der Therapie.
Abb. 1: Mögliche durch das Immunsystem ausgelöste Nebenwirkungen der Immuntherapie
Leichte Nebenwirkungen (Grad 1) erfordern im Normalfall noch keine Unterbrechung der Immuntherapie. Die klinischen Kontrollen sollten jedoch engmaschig erfolgen und die Behandlung sollte die Symptome adressieren. Differenzialdiagnosen sollten durch gezielte Untersuchungen ausgeschlossen werden.
Bei Grad-2-Nebenwirkungen wie Pneumonitis, Nephritis, Kolitis und symptomatischer Hypophysitis, Endokrinopathien in einer Grad-3- oder -4-Bewertung sowie einer Hepatitis (AST oder ALT >3–5x obere Normgrenze und Gesamtbilirubin >1,5 bis 3x obere Normgrenze) sollte die Therapie pausiert und die unverzügliche Gabe von Kortikosteroiden (Prednison, Methylprednisolon) in einer Initialdosis von 0,5–2mg/kg/Tag mit anschließendem Ausschleichen, abhängig vom Schweregrad und vom betroffenen Organ, erfolgen.
Ein Wiederbeginn der Therapie kann nach erfolgreicher Behandlung der Nebenwirkung angedacht werden. Jedoch kann es unter dem Ausschleichen der Steroide zu einem Wiederaufflammen kommen, sodass eine erneute Dosiserhöhung der Kortikosteroide erforderlich ist.
Hautveränderungen
Zu den häufigsten immunvermittelten Nebenwirkungen zählen Hautveränderungen, wie z.B. makulopapulöse Exantheme, Pruritus sowie auch seltener vorkommende bullöse oder lichenoide Veränderungen.
Bei makulopapulösen Exanthemen sowie bei Pruritis mit mildem bis moderatem Verlauf(Grad 1–2) kann die Immuntherapie unter topischer Lokaltherapie und symptomatischer Therapie mit Gabe von oralen Antihistaminika fortgesetzt werden. Bei einer Ausprägung, die Grad 3–4 entspricht, sind eine Pausierung der Immuntherapie sowie eine Verabreichung oraler Kortikosteroide (Prednison 0,5–1mg/kg/Tag) und eine lokale Behandlung mit hochpotenten topischen Kortikosteroiden an den betroffene Arealen empfohlen.
Bei schwerwiegenden Reaktionen wie der bullösen Dermatitis, dem Stevens-Johnson-Syndrom und der toxischen epidermalen Nekrolyse muss die Immuntherapie sofort abgesetzt werden und eine rasche dermatologische Vorstellung erfolgen.
Schilddrüse
Eine Hypothyreose erfordert in der Regel weder eine Unterbrechung der Immuntherapie noch eine Gabe von Kortikosteroiden und wird mittels Hormonsubstitution therapiert. Bei einer asymptomatischen Hyperthyreose kann die Therapie fortgesetzt werden.
Kolitis
Bei Verdacht auf eine immunvermittelte Kolitis sollte zunächst eine infektiöse Ursache ausgeschlossen werden, die Immuntherapie pausiert und eine symptomatische Therapie mit Loperamid oder Diphenoxylat/Atropin über eine Dauer von 2–3 Tagen zur Symptomlinderung angedacht werden. Bei anhaltenden Beschwerden und moderaten bis schweren Verläufen (Grad 3–4) sind nach weiterführender endoskopischer Abklärung eine Beendigung der Therapie mit Checkpoint-Inhibitoren sowie eine systemische intravenöse Kortikosteroidgabe (1–2mg/kg/Tag Methylprednisolon) gemäß den NCCN-Leitlinien zu berücksichtigen.
Erhöhung der Leberwerte
Treten unter Immuntherapie Erhöhungen der Leberwerte auf, sollten primär eine virale Genese und eine Medikamententoxizität – abgesehen von der Immuntherapie – ausgeschlossen werden. Das weitere Vorgehen orientiert sich am Grad der Auslenkung. Bei milder Ausprägung (Grad 1; <3xULN) ist eine Pausierung der Immuntherapie unter Beobachtung der Entwicklung der Laborwerte anzudenken, wobei bei moderaten ALT/AST-Auslenkungen (3–5x ULN) die Therapie pausiert werden sollte, die Laborkontrollen engmaschig durchzuführen sind und die Gabe von Kortison (Prednison 0,5–1mg/kg/Tag) anzudenken ist. Bei Nichtansprechen oder Grad G3 (>5–20xULN)/G4 (>20xULN) sollte hochdosiert die Gabe von Steroiden (Predni-son/Methylprednisolon 1–2mg/kg/Tag) bei gleichzeitiger Beendigung der Immuntherapie erfolgen.
Pneumonitis
Die Pneumonitis kann je nach Schweregrad eine stationäre Aufnahme erfordern. Fulminante Verläufe bei ausgeprägten Infiltraten sind möglich. Wichtig sind das rasche Erkennen (Klinik, Röntgen, CT) und die unverzögerte Therapieeinleitung.
Bei Nichtansprechen auf hochdosierte Steroidgabe (Methylprednisolon 1–2mg/kg/Tag) innerhalb von 48 Stunden kann die Gabe von Infliximab 5mg/kg i.v., IVIG oder Mycophenolat mofetil 1,5g 2x täglich indiziert sein.
Bei schweren bis lebensbedrohlichen Nebenwirkungen (Grad 3 und 4) und rezidivierenden Grad-2-Reaktionen muss die Immuntherapie dauerhaft beendet werden.
Da die Nebenwirkungen mannigfaltig sein können, sollten die Zuweisung des Patienten sowie die Konsultation einer Spezialabteilung (z.B Dermatologie, Augenabteilung, Endokrinologie etc.) in einem interdisziplinären Team erfolgen, um die Lebensqualität der Patienten zu erhöhen.
Zielgerichtete Therapie mit Tyrosinkinaseinhibitoren
Die großteils oral verfügbaren Therapien mit Tyrosinkinaseinhibitoren zeigen im Allgemeinen ein günstiges Nebenwirkungsprofil.
Nach einer initialen Phase, in der die Patienten engmaschig klinisch kontrolliert werden, können die Kontrollen im Krankenhaus bei gutem Ansprechen auf bis zu 3 Monate ausgedehnt werden.
Eine regelmäßige Kontrolle von Blutbild, Leber- und Nierenfunktionsparametern sollte alle 4–6 Wochen erfolgen.
Nebenwirkungen, die unter TKI-Therapie auftreten können, sind unter anderem Blutdruckentgleisungen, Ödeme, akute Psychosen, QT-Zeit-Verlängerungen, Exantheme, Leberwerterhöhungen, Paronychien. Die Kombination aus Dabrafenib und Trametinib bei BRAF-V600-Mutation verursacht typischerweise Fieber.
In diesen Fällen muss die Dosis reduziert werden, bis die Nebenwirkungen abgeklungen sind, und eine symptomatische Behandlung erfolgen. Bei Anhalten muss auf eine andere Substanzklasse gewechselt beziehungsweise die Therapie beendet werden.
Wichtig ist auch ein adäquater Sonnenschutz, um schwerwiegende Hautveränderungen zu vermeiden.
Fazit
Die Therapievielfalt beim Bronchuskarzinom erfordert eine profunde Kenntnis der Nebenwirkungen, damit rasch und richtig reagiert und dadurch ein möglichst langes progressionsfreies Überleben mit einer verbesserten Lebensqualität der Patienten mit wirksamen Therapieschemata erreicht werden kann. Zur raschen Behandlung therapieinduzierter Nebenwirkungen für eine optimale 360-Grad-Versorgung der Patienten sind behandlungsspezifische und patientenspezifische Faktoren zu berücksichtigen.
Literatur:
● AWMF S3-Leitlinie Supportive Therapie bei onkologischen Patienten, Stand 2016 ● Hendriks LE et al.: Oncogene-addicted metastatic non-small-cell lung cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2023; 34(4): 339-57● Klastersky J et al.: Ann Oncol 2016; 27 (5): v111-v118 ● Österreichische Gesellschaft für Pneumologie: G-CSF Prophylaxe in der Behandlung des metastasierten Bronchuskarzinoms. Update 2018. https://www.ogp.at/wp-content/uploads/G-CSF-Prophylaxe_digital_Medbee_IC.pdf ; zuletzt aufgerufen am 23.5.2023 ● Statistik Austria: Pressemitteilung 12.719-017/22. https://www.statistik.at/fileadmin/announcement/2022/05/20220127Krebserkrankungen2019.pdf ; zuletzt aufgerufen am 23.5.2023 ● Statistik Austria: Krebserkrankungen in Österreich 2020. https://www.statistik.at/fileadmin/publications/Krebserkrankungen_in_OEsterreich_2020.pdf ; zuletzt aufgerufen am 23.5.2023● Subbiah V et al.: Dabrafenib plus trametinib in BRAFV600E-mutated rare cancers: the phase 2 ROAR trial. Nature Medicine 2023. doi: 10.1038/s41591-023-02321-8 ● Thompson AT et al.: NCCN Clinical Practice Guidelines in Oncology. Management of immunotherapy-related toxicities Version 1.2022. J Natl Compr Canc Netw 2022; 20(4): 387-405
Das könnte Sie auch interessieren:
Das Pollenjahr 2025
Die Pollen fliegen wieder – und Allergiker:innen spüren das zurzeit massiv. Wertvolle Informationen zu Pollenflug, Pollenallergien und auch dem Einfluss von Luftschadstoffen auf ...
Gewebeschädigung: Proteasen bahnen der Allergie den Weg
Warum entwickeln manche Menschen Allergien und andere nicht? Viele Aspekte dieser Frage sind nach wie vor ungeklärt. Auf der klinischen Seite zeigt sich zunehmend, dass die Behandlung ...