Pharmakogenetik zur Vermeidung unerwünschter Arzneimittelwirkungen
Autor:
Priv.-Doz. DDr. Stefan Wöhrer
Gruppenpraxis für Innere Medizin Doz. Wöhrer und Dr. Frixeder Dudczak, CEO Permedio
E-Mail: swoehrer@permedio.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Alle praktizierenden Mediziner:innen hatten schon einmal mit unerwünschten Arzneimittelwirkungen zu kämpfen. Wir gehen davon aus, dass diese Nebenwirkungen ein unangenehmer Teil von notwendigen Medikamenten sind und dass man einfach damit leben muss. Was jedoch nur wenigen bekannt ist, ist die tatsächliche Häufigkeit, mit der diese Nebenwirkungen auftreten.
Medikamentennebenwirkungen sind die vierthäufigste Todesursache in der westlichen Welt.1,2
Ein schneller Faktencheck mittels Google oder ChatGPT wird diese Aussage dem ersten Anschein nach widerlegen. Diese Diskrepanz kommt dadurch zustande, dass die Todesursache in den Spitälern meist nicht als Medikamentennebenwirkung codiert wird. Wenn zum Beispiel ein Patient nach der Einnahme von blutverdünnenden Substanzen eine spontane Hirnblutung erleidet und daran stirbt, wird dieser Tod als „I61 – intrazerebrale Blutung“ und somit auf das Konto der „Krankheiten des Herz-Kreislauf-Systems“ verbucht, welche in Österreich bekanntermaßen die häufigste Todesursache darstellen. Eigentlich sollte dieser Tod aber als „T88.7 – nicht näher bezeichnete unerwünschte Nebenwirkung eines Arzneimittels oder einer Droge“ gezählt werden. Dies wird aber selten gemacht, was dazu führt, dass Arzneimittelnebenwirkungen in den offiziellen Statistiken nicht aufscheinen. Das wiederum führt dazu, dass sie nicht als wirkliches Problem wahrgenommen und von unserem Gesundheitssystem relativ stiefmütterlich behandelt werden.
Die Autoren der oben erwähnten Studien haben sich die Mühe gemacht und die Krankenakten der im Spital verstorbenen Patient:innen genauer unter die Lupe genommen.Anhand deren konnten sie eine Abschätzung der tatsächlichen Häufigkeit von unerwünschten Nebenwirkungen vornehmen.1,2 Eine etwas rezentere Studie bestätigte die Häufigkeit von Nebenwirkungen und zeigte, dass von 2809 Spitalsaufnahmen 23% aufgrund von Nebenwirkungen („adverse events“) erfolgen.3 Fast jede vierte Spitalsaufnahme ist also durch Nebenwirkungen bedingt.
Die häufigsten dieser Nebenwirkungen (40%) waren Arzneimittelnebenwirkungen und 33% wurden als ernst („serious adverse event“) eingestuft.
Nachdem ich hoffentlich zeigen konnte, dass Medikamentennebenwirkungen nach wie vor ein häufiges und ernsthaftes Problem sind, möchte ich nun beleuchten, wie pharmakogenetische Testungen zur Verbesserung der Situation beitragen können.
Pharmakogenetik als Werkzeug
Uns ist seit Langem bekannt, dass Patient:innen unterschiedlich auf Medikamente ansprechen. Sir Archibald Garrod schrieb schon 1931, dass die unterschiedlichen Wirkungen der Medikamente durch die biochemische Individualität der Menschen verursacht werden. 1962 erwähnte Werner Kalow zum ersten Mal den Ausdruck Pharmakogenetik und beschrieb, dass sowohl Wirkungen als auch Nebenwirkungen von Medikamenten vererbt und somit genetisch determiniert sind.4
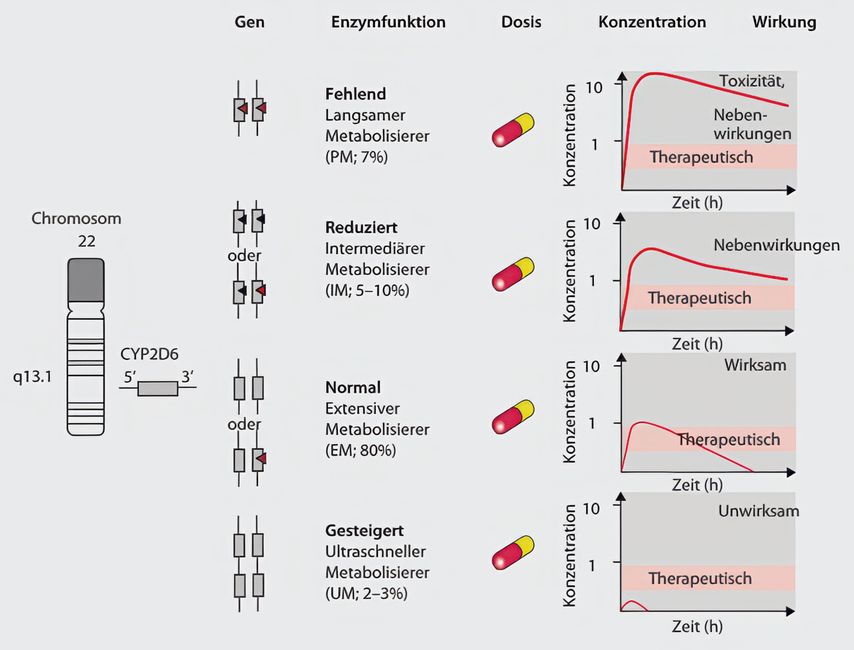
Tatsächlich brachte ihn ein tragischer Fall einer Familie mit maligner Hyperthermie nach operativen Eingriffen auf die Idee, dass manche Nebenwirkungen vererbt sein müssen.5 Unerwünschte Arzneimittelreaktionen sind die Folge einer Veränderung der Pharmakokinetik, welche sich aus Absorption, Distribution, Metabolisierung und Exkretion (ADME) zusammensetzt. Alle diese Funktionen werden genetisch beeinflusst und sind somit Teil einer pharmakogenetischen Analyse. Aktuel steht die Metabolisierung durch das Cytochrom-P450-System im Fokus der Pharmakogenetik. Sehr vereinfacht gesprochen, kommt es durch Veränderungen in diesem System zu unterschiedlich hohen Wirkspiegeln. Ist der Wirkspiegel zu hoch, kommt es zu Nebenwirkungen, ist er zu niedrig, bleibt die Wirkung aus und wir sprechen von einem „non responder“ (Abb. 1).
Abb. 1: Genetischer Polymorphismus des CYP2D6-Gens und Konsequenzen für davon betroffene Fremdstoffe
Ein typisches Beispiel für „non responder“ sind Patienten mit CYP2C19*2, die das Prodrug Clopidogrel schlechter in die aktive Form umwandeln können,wodurch es zu einer abgeschwächten Thrombozytenhemmung und vermehrten Todesfällen kommt. Shuldiner und Kollegen konnten zeigen, dass Menschen mit einer CYP2C19*2-Veränderung, die nach einem Herzinfarktmit Clopidogrel behandelt wurden, eine um 22% höhere Sterblichkeit oder Herzinfarktrate aufwiesen. Wenn Patienten mit CYP2C19*2 mit Ticagrelor behandelt wurden, hatten sie kein erhöhtes Risiko zu sterben.
In den USA führte diese Studie dazu, dass Clopidogrel mit einer „Blackbox“-Warnung versehen wurde. Im Mai 2024 wurden die Pharmaunternehmen Bristol Myers Squibb und Sanofi von einem Gericht in Hawaii dazu verurteilt, über 916 Millionen US-Dollar an den Bundesstaat zu zahlen. Der Vorwurf lautete, dass sie es versäumt hätten, angemessen über das Risiko einer verminderten Wirksamkeit von Clopidogrel aufgrund genetischer Unterschiede zu informieren.7 Es ist für mich nicht nachvollziehbar, dass man Herzinfarktpatient:innen Clopidogrel ohne genetische Testung verschreiben kann, wie es in Österreich derzeit noch üblich ist.
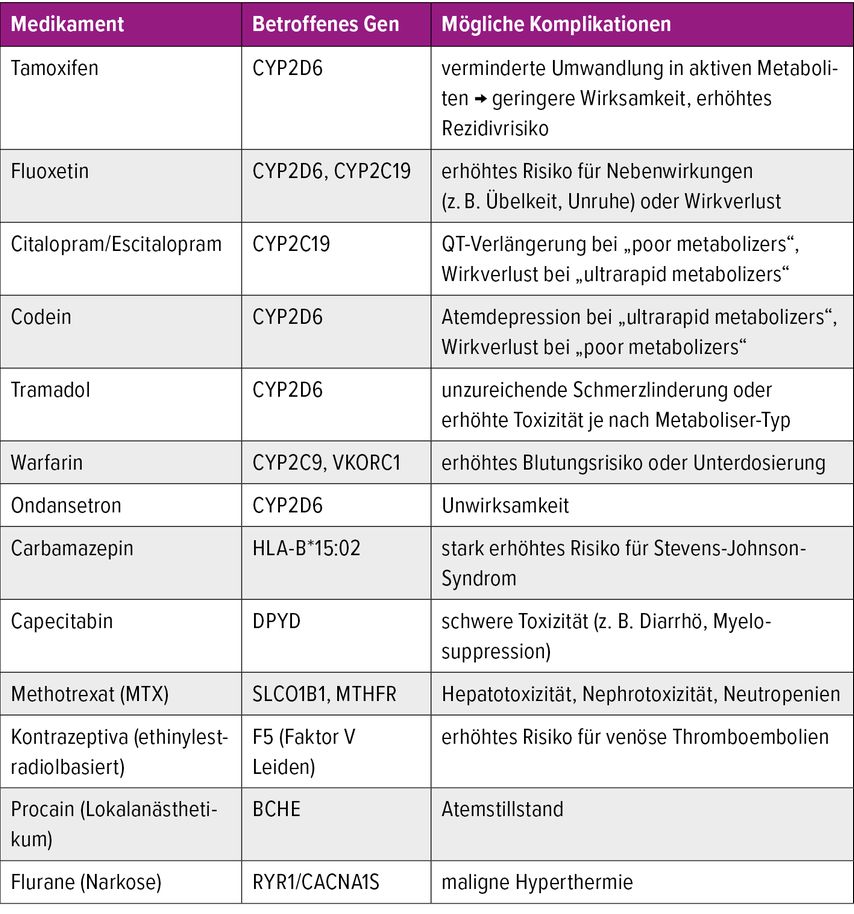
Auch zu hohe Wirkspiegel von Arzneimittel können, wie bereits erwähnt, ein Problem darstellen. Ein Exempel hierfür ist die Umwandlung von Codein zu Morphin durch CYP2D6. Ultraschnelle Metabolisierer wandeln das Prodrug Codein so schnell in Morphin um, dass es zu Atemstillständen und Todesfällen kommen kann.8 Weitere Beispiele für den Einfluss genetischer Merkmale auf Arzneimittelwirkungen aus dem Bereich der Gynäkologie sind in Tabelle 1 beschrieben.
Pharmakogenetische Testung als Standard?
Aufgrund der zunehmenden Evidenz für den Nutzen von pharmakogenetischen Testungen stellte sich die Frage, ob diese Testungen grundsätzlich bei allen Patienten zu empfehlen sind. Eine bahnbrechende Studie zu diesem Thema wurde von Swen et al. 2023 veröffentlicht.9 Es handelte sich dabei um die erste kontrollierte randomisierte Studie zur pharmakogenetischen Testung von Patient:innen, bei denen die Dutch Pharmacogenetics Working Group (DPWG) eine genetische Testung empfiehlt. Tatsächlich konnte gezeigt werden, dass die Nebenwirkungsrate signifikant um 30% gesenkt werden konnte.9 Diese Studie stellt einen Meilenstein für pharmakogenetische Testungen dar, obwohl nur zwölf Gene analysiert wurden. Es wurde aber auch klar, dass die pharmakogenetische Testung Nebenwirkungen nicht zu 100% eliminieren, sondern nur reduzieren kann. Es ist davon auszugehen, dass die Treffsicherheit durch zunehmende wissenschaftliche Erkenntnisse in den kommenden Jahren größer wird, aber es ist wichtig, den Patienten keine falschen Versprechungen zu machen.
Persönliches Fazit
Angesichts der mittlerweile deutlich gesunkenen Kosten pharmakogenetischer Testungen (ca. 389 Euro) sowie der soliden Evidenzbasis zu deren klinischem Nutzen erscheint mir persönlich eine routinemäßige Durchführung bei jeder Patientin und jedem Patienten gerechtfertigt. Die durchschnittliche Dauer der Analyse beträgt etwa vier Wochen – ein Zeitraum, der im Kontext vorausschauender Therapieplanung gut vertretbar ist. Da der Eintritt akuter Erkrankungen oder unerwarteter Therapiebedarfe nicht vorhersehbar ist, bietet eine frühzeitige Testung die Möglichkeit, im Ernstfall rasch eine individuell optimierte Pharmakotherapie einzuleiten.
Interessenkonflikt: Der Autor ist Geschäftsführer einer Firma, die pharmakogenetische Testungen anbietet.
Literatur:
1 Lazarou J et al.: Incidence of adverse drug reactions in hospitalized patients: a meta-analysis of prospective studies. JAMA 1998; 279(15): 1200-5 2 Gurwitz JH et al.: Incidence and preventability of adverse drug events in nursing homes. Am J Med 2000; 109(2): 87-94 3 Bates DW et al.: The safety of inpatient health care. N Engl J Med 2023; 388(2): 142-53 4 Kalow W: Pharmacogenetics; Heredity and the response to drugs. W.B. Saunders Co; 1962 5 Britt BA et al.: Malignant hyperthermia: an investigation of five patients. Can Anaesth Soc J 1973; 20(4): 431-67 6 Krämer T: Pharmakogenetik in der Rechtsmedizin. Rechtsmedizin 2011; 21(3): 233-44 7 Pierson B: Bristol Myers, Sanofi liability in Hawaii Plavix case grows to $916 million. U.S. News, 22.05.2024 8 Ciszkowski C et al.: Codeine, ultrarapid-metabolism genotype, and postoperative death. N Engl J Med 2009; 361(8): 827-8 9 Swen JJ et al.: A 12-gene pharmacogenetic panel to prevent adverse drug reactions: an open-label, multicentre, controlled, cluster-randomised crossover implementation study. Lancet 2023; 401(10374): 347-56
Das könnte Sie auch interessieren:
Welche Risiken sind zu erwarten?
Die präventive Mastektomie wird vor allem bei genetischer Vorbelastung, z.B. bei BRCA1/2-Mutationen, erwogen. Der Eingriff kann das Brustkrebs-Erkrankungsrisiko deutlich reduzieren, aber ...
Operative Therapie und Risikoreduktion bei BRCA-Mutations-Trägerinnen
Familiäre Krebserkrankungen, besonders durch pathogene Genveränderungen bedingt, sind vermehrt in den Fokus der Forschung gerückt. Dies zeigt sich vor allem bei Brustkrebs (BC). Das ...
AI in der Reproduktionsmedizin
Kein Thema bewegt derzeit die Menschen mehr als künstliche Intelligenz (AI – „artificial intelligence“). Wiewohl in der Behandlung des unerfüllten Kinderwunsches in den letzten ...