Wundbettkonditionierung mit autologem Wundpatch im Extremitätenbereich
Autoren:
Dr. Elisabeth Lahnsteiner
Prof. Dr. Stefan Marlovits
WUND.ORDINATION, Wien
E-Mail: info@wundordination.at
Epidemiologisch zeigen sich durch die Zunahme an Sport- und Freizeitunfällen sowie durch die Demografie große interdisziplinäre Herausforderungen bei der Behandlung akuter und chronischer Wunden unterschiedlicher Ätiologie. Im Wissen um die kausalen Zusammenhänge der Klinik, der Risikofaktoren und Differenzialdiagnosen sowie der Prozesse der Wundheilungsstörungen liegt der dauerhafte therapeutische Erfolg mit der damit verbundenen Patientenzufriedenheit in der wiedererlangten Mobilität und Lebensqualität.
Keypoints
-
Eine Kombination aus standardisierter phasengerechter Wundbettkonditionierung in therapeutischer Kombination mit einem „Platelet-rich plasma“ (PRP)- und„Platelet-rich fibrin“(PRF)-Wundpatch stimuliert bei traumatischen und chronischen Wunden im Extremitätenbereich die Ausbildung eines biologisch hochwertigen Granulationsgewebes bei gleichzeitig reduzierter inflammatorischer Exsudation.
-
Die Indikation und der richtige Zeitpunkt der Applikation eines autologen Wundpatches setzen eine sorgfältige ärztliche klinische Wunddiagnostik und chirurgische Weichteilsanierung voraus.
-
Plättchenreiches Plasma stellt somit aufgrund des biologischen Wirkprinzips in der Behandlung von Wunden unterschiedlicher Ätiologie eine vielversprechende neue Therapieergänzung dar.
Wundheilungsstörungen können traumatisch bedingte, patientenbezogene oder iatrogene Ursachen haben oder eine Kombination aus diesen Einflussgrößen darstellen. Die Besonderheit der gestörten Wundheilung für die Traumatologie und Orthopädie liegt in der möglichen Beteiligung des Knochens. Hauptaugenmerk der Behandlung muss es sein, durch entsprechende Maßnahmen Sekundärschäden wie chronische Osteitis/Osteomyelitis oder Funktionseinschränkung zu vermeiden.
Akute traumatische oder prolongierte Wundheilungsstörungen wie Wundrandnekrosen, Wunddehiszenzen und Hämatoserome bedürfen der raschen, notfallmäßigen Revision mit kompromisslosem Débridement und umfassender Nekrektomie und Sequesterektomie.
Die Strategien zur definitiven Weichteilsanierung reichen vom einfachen Wundverschluss mittels Sekundärnaht über Spalthauttransplantate bis zum lokalen oder freien Lappentransfer, wobei diese Maßnahmen auch zur Sanierung chronischer Wundheilungsstörungen eingesetzt werden können.
Ursachen gestörter Wundheilung
Der physiologische Heilungsprozess posttraumatischer oder chronischer postoperativer Wunden wird oft durch zahlreiche Faktoren gestört. Minderdurchblutung oder Gefäßverletzungen verursachen eine lokale schmerzhafte Hypoxämie und Zelluntergang. Nekrosen, Exsudat, Hämatome, phlegmonöse Weichteilinfekte und Unverträglichkeit von Nahtmaterial prädisponieren die Entwicklung einer Wunddehiszenz oder Fistulierung. Osteomyelitis und Osteolyse sind dabei häufige Begleitphänomene.
Fehlende Ruhigstellung und Druckentlastung an der operierten Extremität sowie inadäquates, nicht an die geänderten anatomischen Verhältnisse angepasstes, orthopädisches Schuhwerk sind zudem maßgebende Störfaktoren im Reparationsprozess.
Die Komorbidität begleitender systemischer Erkrankungen, wie Stoffwechselstörungen, Durchblutungsstörung, Immundefizienz oder eingeschränkte Mobilität, erfordert eine fächerübergreifende Behandlungsstrategie.
Biologie der Wundheilung
Der Wundheilungsprozess ist ein komplexer molekularbiochemischer Prozess, der durch das Zusammenspiel von Zytokinen, Proteasen, Wachstumsfaktoren und chemotaktischen Prozessen gesteuert wird. Die vielschichtigen Prozesse, wie Chemotaxis und Phagozytose, Bindegewebsproliferation, Degradation und Umbau von Kollagen, Angiogenese und Reepithelisation, sind fein aufeinander abgestimmt.
Der Verlauf der Wundheilung lässt sich in koordiniert ablaufende und interagierende Vorgänge gliedern:
-
Hämostase
-
Entzündungsphase
-
Proliferationsphase: Bildung von Granulationsgewebe, Angiogenese und Reepithelisation
-
Remodellierungsphase
In der Hämostase folgt nach initialer Vasokonstriktion eine Vasodilatation mit reaktiver Hyperämie. Die Zunahme der Gefäßpermeabilität bewirkt den Austritt von Blutplasma ins Interstitium und führt klinisch zum lokalen Wundödem. Dieser reaktive Prozess wird durch Prostaglandine aus dem Gewebedefekt, Histamine aus Mastzellen und vasoaktive Amine (z.B. Serotonin) aus aktivierten Thrombozyten gesteuert. Die Thrombozyten innerhalb des Blutgerinnsels sind dabei nicht nur verantwortlich für die Hämostase, sondern setzen auch zahlreiche Wundheilungsmediatoren, wie EGF, PDGF, IGF-1 und TGF-1, frei.
In der Entzündungsphase vermitteln chemotaktische Signale mit dem Prozess der Leukozytendiapedese den Übertritt der Leukozyten aus den Blutgefäßen in das Wundgebiet. Die neutrophilen Granulozyten habendie wichtige Funktion der Wundreinigung. Sie phagozytieren und eliminieren Bakterien, Fremdmaterial und devitales Gewebe und üben so die Funktion der Verhütung einer Wundinfektion aus. Neutrophile synthetisieren und setzen Entzündungsmediatoren wie TNF-α und IL-1 frei. Diese Mediatoren aktivieren Fibroblasten und Epithelzellen. Sie produzieren und speichern große Mengen aggressiver Proteasen und freier Sauerstoffmoleküle, mit denen sie phagozytiertes Material verdauen. Nach ihrem Zelltod gelangen diese Noxen in das Wundgebiet und können bei erhöhter Zelllast für einen prolongierten Entzündungsprozess mitverantwortlich werden. Letztlich werden sie mit dem Exsudat, Debris und Toxinen ausgeschieden oder von Makophagen phagozytiert.
Makrophagen nehmen eine Schlüsselfunktion bei der Reparation einer Wunde ein, indem sie den Übergang der Entzündungsphase zur Proliferation vermitteln. Sie produzieren zahlreiche Zytokine und Wachstumsfaktoren, z.B. TNF-α, PDGF, VEGF, TGF-α, TGF-β, IL-1, IL-6, IFG und FGF. Diese führen zur geordneten Rekrutierung und Proliferation von Fibroblasten und Endothelzellen und zur Ausbildung eines biologisch hochwertigen Granulationsgewebes. Eine Depletion von Monozyten und Gewebsmakrophagen verursacht eine Störung im physiologischen Wundheilungsprozess und hat mangelhaftes autologes Wunddébridement und verzögerte Bindegewebsproliferation zur Folge. Makrophagen regulieren und stimulieren die komplexen Prozesse der Fibroplasie und Angiogenese.
In der proliferativen Phase kommt der provisorischen Matrix eine wichtige funktionelle Schlüsselfunktion zu. Sie ist ein wichtiges Reservoir für Wachstumsfaktoren und Zytokine. Sie dient als Anker und inerte Leitstruktur bei der Zellteilung und Zellmigration und Differenzierung. Die Matrixmetalloproteasen (MMP) regulieren enzymatisch den Prozess der Zellmigration über und durch die extrazelluläre Matrix. Ist im katabolen und anabolen Umbauprozess das kritische Gleichgewicht der MMP und TIMP („tissue inhibitors of metalloprotease“) gestört, kann ein überschießender Abbau von MMP die Degradation von Wachstumsfaktoren und deren Rezeptoren und somit einen prolongierten Heilungsprozess verursachen.
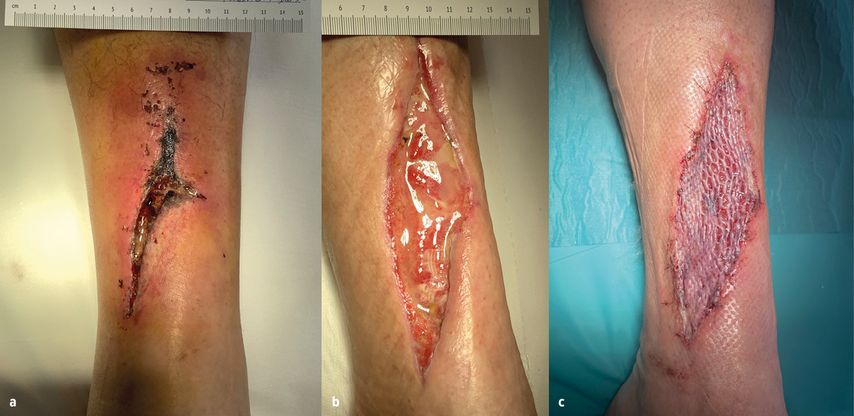
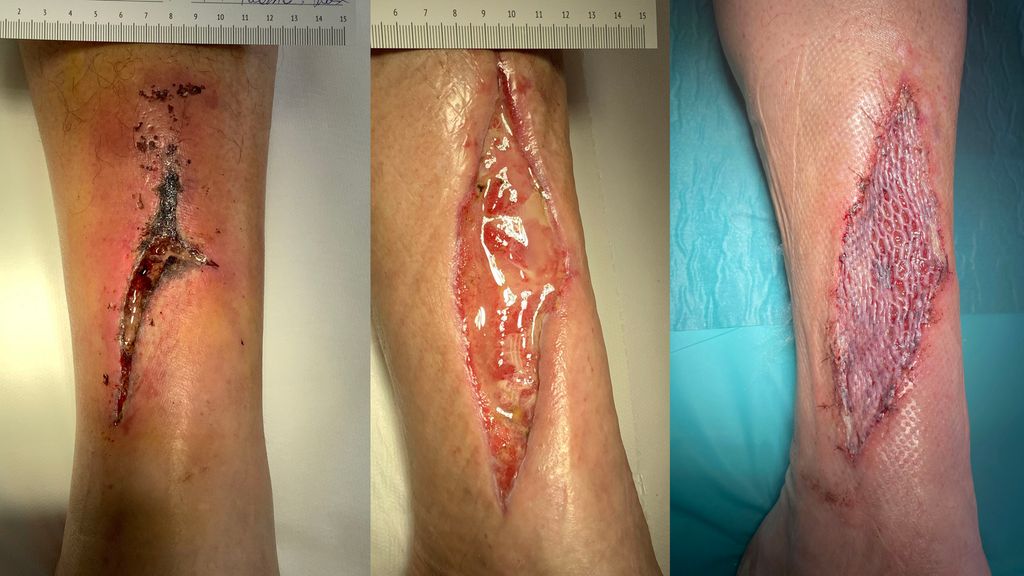
Abb. 1: a) Vulnus lacero-contusum cruris sin permagna infecta, Kompartmentsyndrom, b) autologer Wundpatch, c) Meshgraft TX + biologischer Wundverband mit PRF
Die Angiogenese und Neovaskularisation werden ebenfalls durch Wachstumsfaktoren, wie bFGF, TGF-β und VEGF, induziert. Das lokale Wundmilieu einschließlich Hypoxie, saurem pH-Wert und hoher Laktatspiegel stimuliert die Gefäßneubildung. Eine ausreichende Sauerstoffversorgung und Nährstoffanreicherung für den reparativen Gewebeprozess sind wiederhergestellt. Das Granulationsgewebe besteht im Aufbau strukturell und histologisch vorwiegend aus einem dichten Kapillarnetz, proliferierenden Fibroblasten und Gewebsmakrophagen, umgeben von einer Matrix aus Kollagen, Glykosaminglykanen (Hyaluronsäure) und Glykoproteinen.
In der Remodellierungsphase und Reepithelisation werden die Migration und Proliferation der Keratinozyten durch den „free edge effect“ und die lokale Freisetzung der Wachstumsfaktoren EGF, TGF-α, TGF-β und KFG sowie die Expression von Wachstumsfaktorrezeptoren angeregt. Die Ausbildung einer intakten Basallamina mit verhornender Epidermis wird eingeleitet. Die mechanische Stabilität wird kritisch beeinflusst von der geometrischen Form der Wunde, der chirurgischen Methodik und auch von der Wundätiologie.
Biologie der chronischen Wundheilung
Bei der chronischen Wunde ist der physiologische Heilungsprozess in der Entzündungsphase oder proliferativen Phase gestört. Chronische Wunden zeichnen sich in der Regel durch eine übermäßige zelluläre Entzündungsaktivität aus. Das Exsudat chronischer Wunden ist reich an proinflammatorischen Zytokinen wie TNF-α und IL-1-βund enthält eine erhöhte Konzentration freier Sauerstoffradikale. Die Makrophagen sind unzureichend aktiviert und dadurch wird die Freisetzung heilungsfördernder Zytokine und Wachstumsfaktoren unterdrückt. In einer im chronischen Wundmilieu erhöhten Aktivität proinflammatorischer Zytokine, im oxidativen Stress oder in einem Overload bakterieller Toxine werden der Grund für das Phänomen einer frühzeitigen Zellalterung und somit die Ursache einer gestörten Geweberegeneration vermutet. Die Akkumulation seneszenter Fibroblasten mit vermehrter Produktion proteolytischer Enzyme potenziert den chronischen Heilungsverlauf.
Die Rolle der Thrombozyten im Heilungsverlauf
Blutplättchen spielen eine Schlüsselrolle im Reparaturmechanismus des Weichteildefektes sowohl akuter als auch chronischer Wunden. Sie liefern essenzielle Wachstumsfaktoren, wie FGF, PDGF, TGF-β, EGF, VEGF und IGF, die an der Migration, Differenzierung und Proliferation von Stammzellen essenziell beteiligt sind. Zusätzlich werden durch die Blutplättchen auch die Fibroblasten und Endothelzellen zur Anlagerung neuer extrazellulärer Matrix bzw. zur Neovaskularisation angeregt.
Autologer thrombozytenreicher Wundpatch für die Behandlung chronischer Wunden im Extremitätenbereich
Zur Unterstützung einer konservativen oder auch operativen phasengerechten Wundbettkonditionierung stehen heute unterschiedliche Herstellungsmöglichkeiten von „platelet-rich plasma“ (PRP) und „platelet-rich fibrin“ (PRF) aus Blutplasma zur Verfügung.
Die aus Eigenblut durch Zentrifugation hergestellten Thrombozytenfraktionen zeigen ihre hohe Wirksamkeit durch Freisetzen von Wachstumsfaktoren, vorwiegend PDGF („platelet-derived growth factor“), TGF („transforminggrowthfactor“) und VEGF („vascular endothelial growth factor“). Der therapeutische Effekt liegt in der Aktivierung undifferenzierter Stammzellen und der Zellproliferation, der Unterdrückung der Zytokinfreisetzung und der Entzündungsmodulation.
Die Ausbildung einer autologen dreidimensionalen Fibrinmatrix schützt dabei körpereigene Wachstumsfaktoren vor proteolytischem Abbau und ermöglicht so eine prolongierte Abgabe zellregulierender Mediatoren zur Geweberekonstruktion mit hoher Biokompatibilität. Die autologe Fibrinmatrix dient so als Gerüst für die Zellmigration und Gewebeneubildung.
Das könnte Sie auch interessieren:
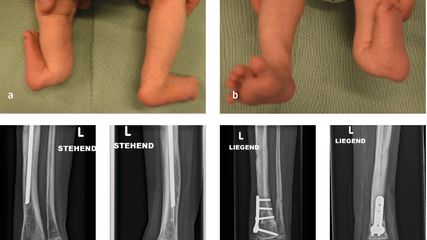
Angeborene Fehlstellungen des Unterschenkels
Kongenitale Deformitäten des Unterschenkels gehören zu den seltenen, aber medizinisch bedeutenden und operativ herausfordernden Diagnosen der Kinderorthopädie. Eine differenzierte ...
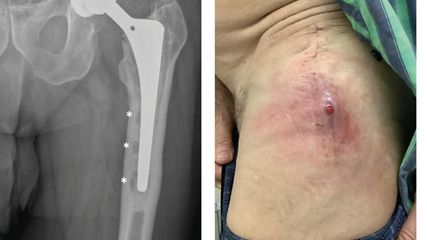
Einzeitiger und mehrzeitiger septischer Endoprothesenwechsel
Die periprothetische Infektion (PPI) stellt eine der gefürchtetsten Komplikationen im Bereich der Orthopädie und Traumatologie dar. Sie ist verbunden mit hohen Morbiditäts- und ...
Hochgradige ACG-Luxationen – wann konservativ behandeln, wann nicht?
Verletzungen des Akromioklavikulargelenks (ACG) gehören zu den häufigsten Schulterverletzungen bei jungen und aktiven Menschen, insbesondere auch aufgrund der zunehmenden Beliebtheit von ...