„Targeted Muscle Reinnervation“ zur intuitiven Prothesensteuerung
Autoren:
Dr. Gregor Längle1
Priv.-Doz. Dr. Stefan Salminger, PhD2
Univ.-Prof. Dr. Oskar C. Aszmann1
1 Klinisches Labor für Bionische Extremitätenrekonstruktion, Universitätsklinik für Plastische, Rekonstruktive und Ästhetische Chirurgie,
Medizinische Universität Wien
2 AUVA-Traumazentrum Wien, Standort Lorenz Böhler, Wien
E-Mail: oskar.aszmann@meduniwien.ac.at
Amputationen proximal des Ellenbogengelenks stellen enorme Einschränkungen für Patienten dar. Durch selektive Nerventransfers und gezielte Rehabilitation kann die Steuerung myoelektrischer Prothesen deutlich verbessert werden. Dieser Artikel gibt einen Überblick über Indikationen und chirurgische Techniken.
Keypoints
-
Bei Amputation oberhalb des Ellenbogengelenks gibt es ein Ungleichgewicht zwischen verfügbaren Muskelsignalen und zu ersetzenden Freiheitsgraden.
-
Targeted Muscle Reinnervation (TMR) ist eine Methode, mittels selektiver Nerventransfers neue und intuitive Muskelsignale für die Prothesensteuerung zu schaffen.
-
EMG-Feedbacktraining ist eine wichtige Therapieform zur Festigung der neuen Nervenverbindungen.
-
TMR ist auch zur Prophylaxe und Therapie von neuropathischen Schmerzen sinnvoll.
Amputationen an der oberen Extremität stellen besondere Einschränkungen für Patienten dar, weil die Fähigkeit, alltägliche Aufgaben durchzuführen, deutlich erschwert ist. Häufige Ursachen sind Arbeitsunfälle (z.B. Landwirtschaft) oder traumatische Ereignisse in der Freizeit (z.B. Verkehrsunfälle).
Das therapeutische Ziel ist, ein hohes Maß an Selbstständigkeit wiederzuerlangen, um langfristig wieder ins Berufsleben einsteigen zu können und im Alltag ohne Hilfe zurechtzukommen. Als Handersatz werden heutzutage am häufigsten myoelektrische Systeme verwendet, welche Muskelsignale von der Haut ableiten und in eine Bewegung umsetzen können. Die Anforderungen an die Prothesensteuerung ist es, möglichst intuitiv und gut erlernbar zu sein.
Durch die fortlaufende technische Entwicklung sind heutzutage sehr hochwertige Handprothesen verfügbar, welche jedoch einer feinen Steuerung bedürfen.1 Bei klassischer transradialer Amputation ohne eine proximale Nervenschädigung (z.B. Plexusläsion) sind genug Signale im Unterarm für die Steuerung einer myoelektrischen Prothese vorhanden. In der Regel sind hierfür zumindest zwei antagonistische Signale, welche von den restlichen Armbewegungen trennbar sind, notwendig (z.B. Hand öffnen und schließen oder Pronation/Supination).
Je proximaler das Amputationslevel, desto mehr Gelenke und somit Freiheitsgrade müssen durch die Prothese ersetzt werden. Dies erfordert beispielsweise bei transhumeraler Amputation mit lediglich zwei Signalen an M. biceps und triceps, dass die Bewegungsebenen (Ellenbogen, Handgelenk, Finger) nur seriell und zum Großteil nicht intuitiv angesteuert werden können. Die resultierenden unnatürlichen Bewegungsabläufe sind ein potenzieller Grund für Patienten, die Prothesen nur selten zu verwenden. Komplexere Bewegungen über mehrere Gelenksebenen hinweg erfordern daher selektive Ansteuerbarkeit durch individuelle Signale.
Targeted Muscle Reinnervation (TMR)
Um die Steuerbarkeit von Prothesen bei proximalen Amputationshöhen (transhumeral, glenohumeral) zu verbessern, wurde 2004 erstmals „Targeted Muscle Reinnervation“ (TMR) als chirurgische Technik beschrieben.2,3 Hierbei werden die wichtigen Handnerven (Nn. medianus, ulnaris, radialis), die ihr Erfolgsorgan verloren haben, in stumpfnahe, „funktionslose“ Muskeln umgeleitet, um einerseits mehr Muskelsignale zu schaffen und andererseits diese auch intuitiver zu gestalten. Dadurch kann der Patient an die ursprüngliche Bewegung denken (z.B. Faustschluss), was dann zur gewünschten Aktivierung in der Stumpfmuskulatur und Signalumsetzung führt. Aufgrund des unterschiedlichen Nervendurchmessers und der höheren motorischen Faseranzahl des Spendernerven im Vergleich zum Muskelast kommt es hierbei zu einer sog. Hyperreinnervation und dadurch Verstärkung des primären Signals, wodurch die Signalstabilität und -ablesbarkeit verbessert werden.4,5 Zusätzlich kann diese Methode auch zur Linderung von Neuromschmerzen angewandt werden.6,7
Indikation
In erster Linie kommen Patienten mit proximalen Amputationen auf transhumeraler oder glenohumeraler Höhe für TMR infrage, da hier der größte Bedarf für zusätzliche Signale gegeben ist. Die Anwendung auf transradialer Höhe ist zwar möglich, jedoch in der klinischen Routine für die Prothesensteuerung nicht unbedingt erforderlich und obliegt vorwiegend der Behandlung von Neurom- und/oder Phantomschmerzen.8
Zu Beginn werden in der klinischen Untersuchung die Schulterfunktion und Stumpfsituation evaluiert. Die Schulter sollte frei beweglich und die Muskeln und Weichteile sollten funktionstüchtig sein. Als Zielmuskeln können nur solche verwendet werden, die keine biomechanische Funktion mehr haben. So kann bei glenohumeraler Höhe der M. pectoralis major als Signalgeber verwendet werden, bei transhumeraler Höhe ist dieser jedoch für die Adduktion und Flexion in der Schulter essenziell.
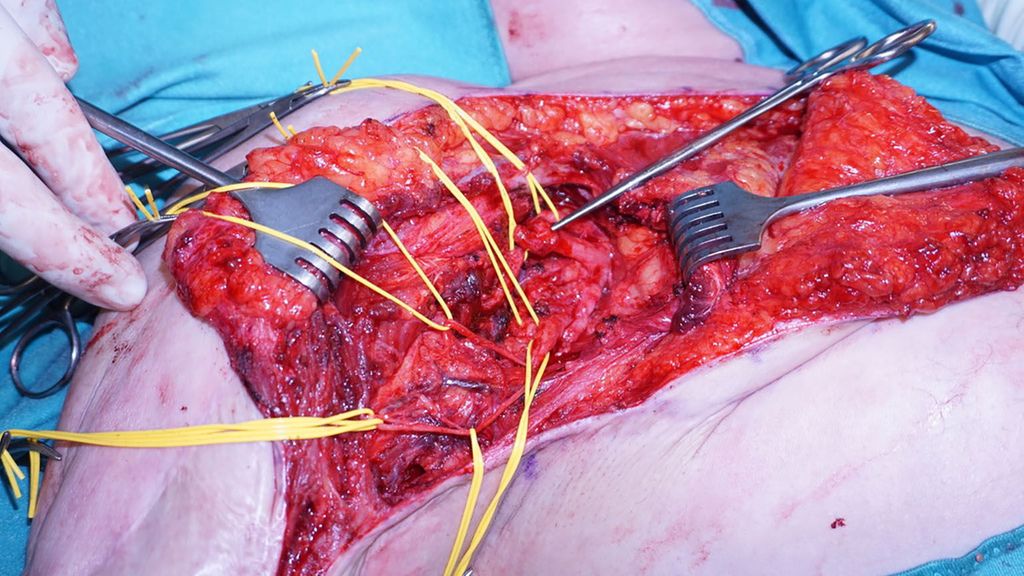
Ist aufgrund einer schlechten Weichteilsituation des Stumpfes eine Deckung mittels freien oder gestielten Muskeltransfers erforderlich, kann dieser ebenfalls als Signalgeber verwendet werden (z.B. M. latissimus dorsi, Abb. 1).
Weiters muss abgeklärt werden, ob ein proximaler Nervenschaden (z.B. Wurzelausriss) vorliegt, um die Integrität der Spendernerven sicherzustellen. Ein Tinel-Hoffmann’sches Zeichen im Stumpfbereich mit Projektion in den entsprechenden Nerv (z.B. radialer Handrücken für N. radialis oder Zeigefinger für N. medianus) gibt Aufschluss über eine durchgängige Nervenleitung. Bei Verdacht auf eine begleitende Nervenläsion sollte mittels MRT und Ultraschall Klarheit geschaffen werden.
Da nach TMR-Operation ein spezielles und intensives Rehabilitationstraining über mehrere Monate vorgesehen ist, muss der Patient ausreichend Motivation, Compliance und kognitive Lernfähigkeit für das Vorhaben mitbringen.
Chirurgische Technik
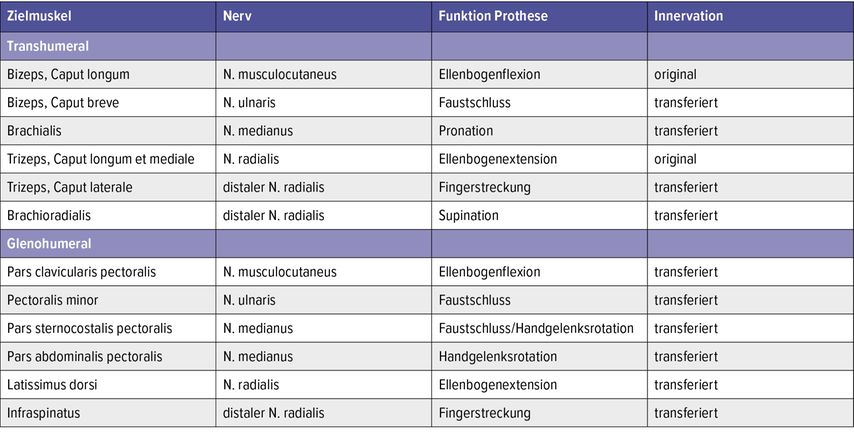
Grundlegende Schemata für die Anordnung der Nerventransfers wurden in der Literatur beschrieben und sind in Tabelle1 angeführt.9,10 Die Machbarkeit einer TMR-Operation muss für jeden Patienten individuell beurteilt und die Strategie der Nerventransfers gegebenenfalls angepasst werden.
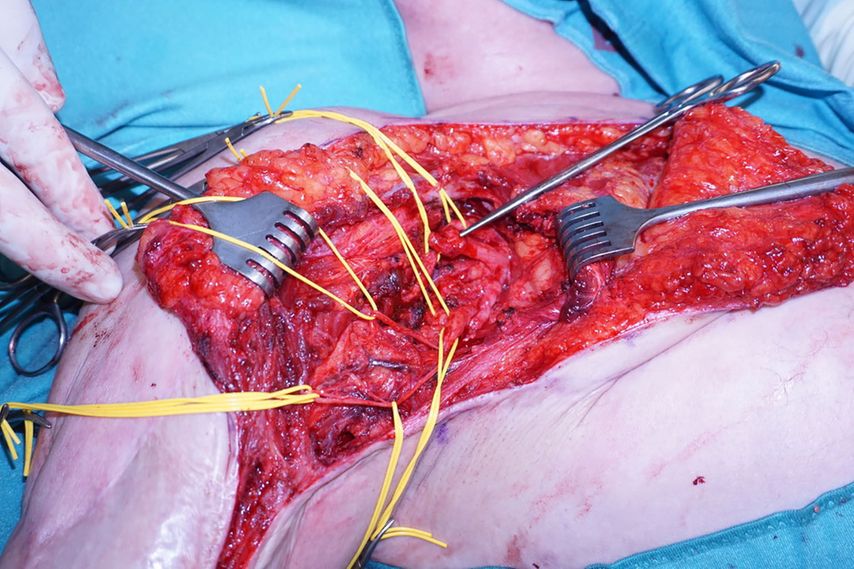
Abb. 2: Intraoperative Präparation der Äste des N. musculocutaneus bei einem Patienten mit transhumeraler Amputation
Bei transhumeraler Höhe sind die Empfängermuskeln der kurze Bizepskopf, der M. brachialis, der laterale Trizepskopf und ggf. der M. brachioradialis. Der Patient ist auf dem Rücken gelagert, mit komplett gewaschenem und frei beweglichem Stumpf. Durch eine Inzision entlang des Sulcus bicipitalis medialis werden die Nn. medianus und ulnaris aufgesucht und anschließend die Muskeläste des N. musculocutaneus präpariert (Abb. 2). Mithilfe eines Nervenstimulators können die einzelnen Äste herauspräpariert werden. Zur besseren Trennung für die spätere Signalableitung an der Haut kann der kurze Bizepskopf von seinem Ursprung am Coracoid abgetrennt und nach medial verlagert werden. Ebenso ist es empfehlenswert, das subkutane Fett über den Muskeln bei Bedarf auszudünnen. Dies dient der besseren Signalübertragung mittels Oberflächenelektroden.
Endständige Neurome der Spendernerven werden rückgekürzt, wobei auf eine ausreichende Länge für den Nerventransfer geachtet werden muss, um eine spannungsfreie Nervennaht zu erzielen. Die Nervenäste in die Empfängermuskeln werden möglichst nahe am Eintrittspunkt in den Muskel durchtrennt, um eine rasche Reinnervation zu ermöglichen. Die Nervennaht erfolgt unter Lupenvergrößerung mit einem monofilen Polyamid-Faden der Größe 8–0/9–0. Zum Schluss wird die Koaptationsstelle mit Fibrinkleber versiegelt.
Durch eine zweite Inzision an der Oberarmrückseite wird zwischen dem langen und lateralen Trizepskopf eingegangen und der N. radialis aufgesucht. Nach Darstellung des Nervenastes in das Caput laterale – bzw. bei langem Oberarmstumpf auch des M. brachioradialis – wird der distale N. radialis entweder einzeln auf den lateralen Trizepskopf oder zusätzlich auf den M. brachioradialis transferiert. Dies dient dem Zweck, die Signale „Hand öffnen“ und „Supination“ zu trennen.
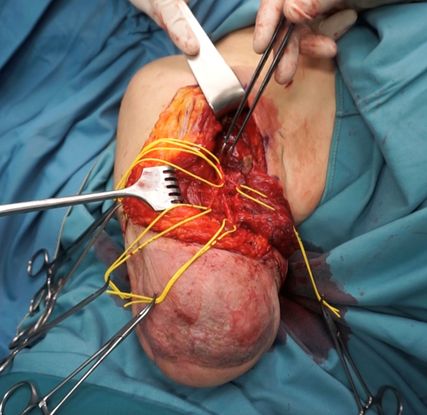
Bei glenohumeralen Patienten kann meist durch die alte OP-Narbe bzw. durch eine bogenförmige Inzision infraklavikular in die Mohrenheim’sche Grube eingegangen werden, um die Nn. pectorales darzustellen. Da der M. pectoralis major segmental innerviert wird (Pars clavicularis, Pars sternocostalis, Pars abdominalis) kann jeder dieser Anteile separat für die Reinnervation genutzt werden. Von lateral werden die Mm. pectorales major et minor abgelöst und die Nn. pectorales laterales et mediales dargestellt. Der M. pectoralis minor kann zur räumlichen Trennung bipolar abgelöst und an seinem Gefäßstiel nach lateral verlegt werden. Weitere potenzielle Zielmuskeln stellen der M. latissimus dorsi (N. thoracodorsalis) und der M. infraspinatus (N. suprascapularis) dar (Abb. 3). Die Identifizierung der einzelnen Anteile des Plexus brachialis erfolgt anhand der A. axillaris, wobei auch hier wieder die Nn. medianus, ulnaris und radialis die Spendernerven darstellen. Das Standardschema für TMR auf dieser Höhe ist in Tabelle1 angeführt. Die Nervenkoaptation erfolgt wie oben beschrieben.
Abb. 3: Austestung der Muskelsignale eines glenohumeralen Patienten nach TMR-Operation
Rehabilitation und Outcome
Nach der Wundheilung sollten die klinischen Kontrollen circa alle 3 Monate erfolgen. Aufgrund der kurzen Reinnervationsstrecke kann ab ca. 3 Monaten mit ersten Muskelsignalen gerechnet werden, wobei eine stabile Reinnervation nach ca. 6–9 Monaten vorhanden sein sollte.
Während dieser Regenerationsphase kann der Patient mittels gezielter Therapiemethoden (z.B. Bewegungsvorstellungen, Spiegeltherapie) schon auf die Prothesensteuerung vorbereitet und sensibilisiert werden. Aufgrund der Dysbalance durch das asymmetrische Körperbild sollten Stamm und Beine durch laufende Physiotherapie trainiert werden, um Fehlhaltungen zu vermeiden.
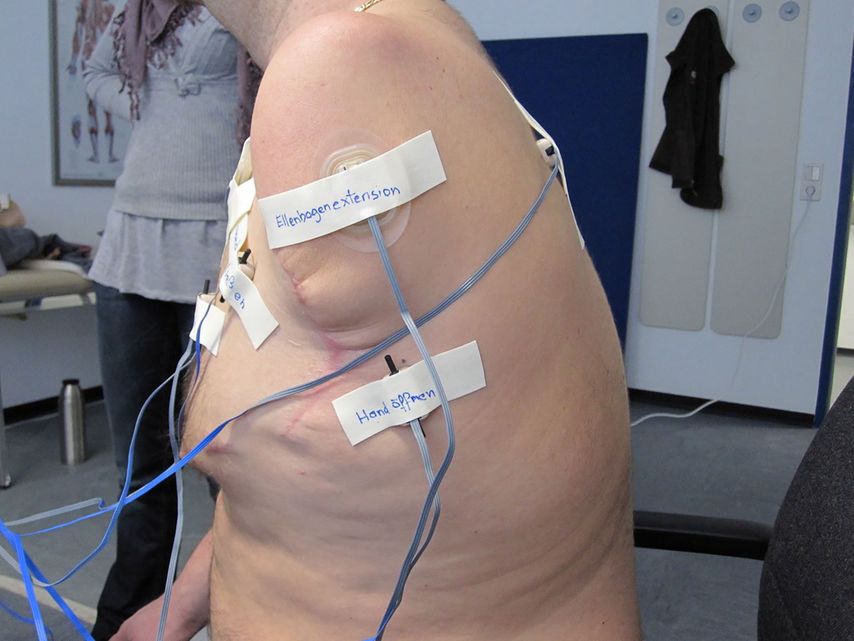
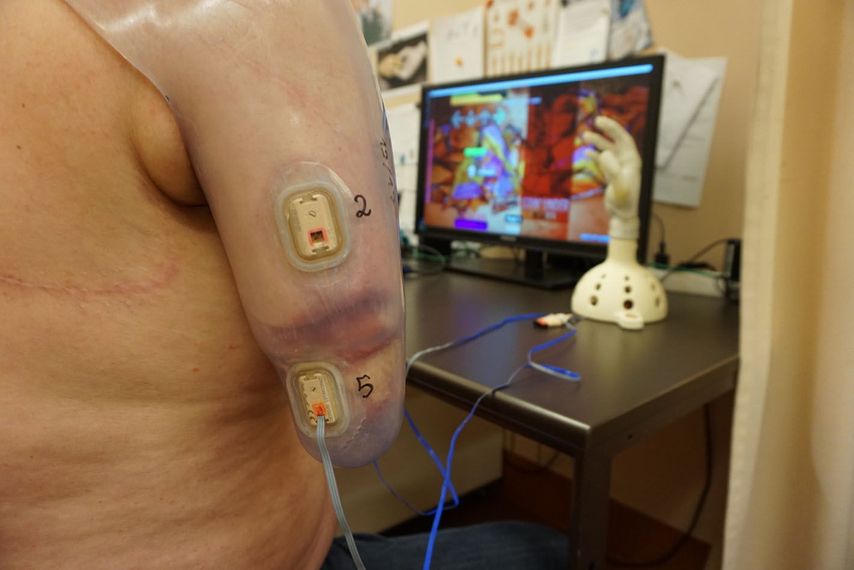
Sobald die erste Muskelaktivität im Oberflächen-EMG zu sehen ist, wird dieses in die Therapieübungen miteinbezogen. Dadurch kann das anfangs erschwerte Ansteuern der neuen Nerven-Muskel-Matrix erleichtert werden. Durch visuelles Feedback der Muskelaktivität und spielerische Anwendungen kann der Patient die Signale gezielt trainieren und kräftigen (Abb. 4).11
Abb. 4: EMG-Feedbacktraining eines transhumeral Amputierten in Form einer spielerischen Anwendung
Ca. 9–12 Monate nach der Operation hat der Patient die Signale ausreichend gefestigt und die Prothese ist im Alltag einsatzbereit. Sobald die prothetische Versorgung fertiggestellt ist, soll die Prothese in die Therapieübungen und in den Alltag möglichst viel miteinbezogen werden.
Mithilfe intensiver Rehabilitation kann durch TMR somit eine deutliche Funktionsverbesserung erzielt werden, die auf die größere Anzahl der Signale und die intuitivere Ansteuerung zurückzuführen ist.12 Dennoch sind Amputationen über dem Ellenbogen für Patienten sehr einschränkend, weshalb auch nach TMR die Rate der Prothesenverweigerer relativ hoch ist.10
Der Erfolg einer TMR-Operation liegt nicht nur in der Schaffung neuer Signale zur besseren Prothesensteuerung, sondern auch in der Reduktion von Nervenschmerzen. So wurde in einer randomisierten kontrollierten Studie gezeigt, dass Neurom- und Phantomschmerzen deutlich reduziert werden konnten, weshalb die Indikation bei Schmerzpatienten immer großzügiger gestellt wird.7
Ausblick
Ein ähnlicher Ansatz wie bei TMR wird bei dem in den letzten Jahren entwickelten Konzept des „regenerative peripheral nerve inteferace“ (RPNI) verfolgt.13,14 Hierbei werden die großen Spendernerven (z.B. N.medianus) interfaszikulär neurolysiert und einzelne Faszikeln mit avaskulären Muskeltransplantaten umhüllt. Diese kleinen neuromuskulären Einheiten können individuelle Signale erzeugen, die mittels EMG-Elektroden abgelesen werden können. Diese Therapie wurde primär für die Prothesensteuerung konzipiert, jedoch findet sie zunehmend auch Anwendung zur Behandlung neuropathischer Schmerzen.15,16
In den letzten Jahren gibt es starke Bemühungen, implantierbare Technologien zu schaffen, um die Signalableitung zu verbessern. Da die Anbringung und Signalqualität von Oberflächenelektroden gewisse Limitationen aufweisen (schlechter Hautkontakt, Schweißproduktion etc.), bieten kleinere Elektroden mit besserer Auflösung, die direkt am Muskel liegen, vielversprechende Alternativen.17–20 Bisherig vorhandene Systeme zeigten gute Ergebnisse, weshalb in den nächsten 5–10 Jahren eine zunehmende Anwendung am Patienten zu erwarten ist.
Mit der Kombination aus TMR und Mustererkennungs-Software ist die motorische Steuerung von Prothesen mittlerweile sehr intuitiv anwendbar.21 Im Gegensatz dazu gibt es beim sensiblen Feedback bisher nur wenig Fortschritt.22 Patienten nehmen Bewegungen der Prothese vornehmlich durch visuelle Überprüfung, Motorgeräusche und unspezifische Stumpfsensibilität wahr. Die Schaffung eines natürlichen und zuordenbaren Gefühls wäre ein Durchbruch in der Behandlung amputierter Patienten, da sich hierdurch auch die gesamte Anwendbarkeit und das Körperbild ändern würden.
Literatur:
1 Bates TJ et al.: Technological advances in prosthesis design and rehabilitation following upper extremity limb loss. Curr Rev Musculoskelet Med 2020; 13(4): 485-93 2 Kuiken TA et al.: The use of targeted muscle reinnervation for improved myoelectric prosthesis control in a bilateral shoulder disarticulation amputee. Prosthet Orthot Int 2004; 28: 245-53 3 Hijjawi JB et al.: Improved myoelectric prosthesis control accomplished using multiple nerve transfers. Plast Reconstr Surg 2006; 118(7): 1573-8 4 Bergmeister KD et al.: Peripheral nerve transfers change target muscle structure and function. Sci Adv 2019; 5(1): eaau2956 5 Luft M et al.: Proof of concept for multiple nerve transfers to a single target muscle. eLife 2021; 10: e71312 6 Souza JM et al.: Targeted muscle reinnervation: a novel approach to postamputation neuroma pain. Clin Orthop Relat Res 2014; 472(10): 2984-90 7 Dumanian GA et al.: Targeted muscle reinnervation treats neuroma and phantom pain in major limb amputees: a randomized clinical trial. Ann Surg 2019; 270(2): 238-46 8 Morgan EN et al.: Targeted muscle reinnervation for transradial amputation: description of operative technique. Tech Hand Up Extrem Surg 2016; 20(4): 166-71 9 Gart MS et al.: Targeted muscle reinnervation in the upper extremity amputee: a technical roadmap. J Hand Surg Am 2015; 40(9): 1877-88 10 Salminger S et al.: Outcomes, challenges, and pitfalls after targeted muscle reinnervation in high-level amputees: is it worth the effort? Plast Reconstr Surg 2019; 144(6): 1037e-43. 11 Prahm C et al.: Game-based rehabilitation for myoelectric prosthesis control. JMIR Serious Games 2017; 5(1): e3 12 Cheesborough JE et al.: Targeted muscle reinnervation and advanced prosthetic arms. Semin Plast Surg 2015; 29(1): 62-72 13 Urbanchek MG et al.: Development of a regenerative peripheral nerve interface for control of a neuroprosthetic limb. Biomed Res Int 2016; 2016: 5726730 14 Vu PP et al.: A regenerative peripheral nerve interface allows real-time control of an artificial hand in upper limb amputees. Sci Transl Med 2020; 12(533): eaay2857 15 Kubiak CA et al.: Prophylactic regenerative peripheral nerve interfaces to prevent postamputation pain. Plast Reconstr Surg 2019; 144(3): 421e-30e 16 Santosa KB et al.: Regenerative peripheral nerve interfaces for prevention and management of neuromas. Clin Plast Surg 2020; 47(2): 311-21 17 Salminger S et al:. Long-term implant of intramuscular sensors and nerve transfers for wireless control of robotic arms in above-elbow amputees. Sci Robot 2019; 17; 4(32): eaaw6306 18 Gstoettner C et al:. Feasibility of a wireless implantable multi-electrode system for high-bandwidth prosthetic interfacing: animal and cadaver study. Clin Orthop Relat Res 2022; 480(6): 1191-204 19 Ortiz-Catalan M et al.: Self-contained neuromusculoskeletal arm prostheses. N Engl J Med 2020; 382(18): 1732-8 20 Bergmeister KD et al.: Prosthesis control with an implantable multichannel wireless electromyography system for high-level amputees: a large-animal study. Plast Reconstr Surg 2016; 137(1): 153-62 21 Hargrove LJ et al.: Myoelectric pattern recognition outperforms direct control for transhumeral amputees with targeted muscle reinnervation: a randomized clinical trial. Sci Rep 2017; 7(1): 13840 22 Svensson P et al.: A review of invasive and non-invasive sensory feedback in upper limb prostheses. Expert Rev Med Devices 2017; 14(6): 439-47
Das könnte Sie auch interessieren:
Angeborene Fehlstellungen des Unterschenkels
Kongenitale Deformitäten des Unterschenkels gehören zu den seltenen, aber medizinisch bedeutenden und operativ herausfordernden Diagnosen der Kinderorthopädie. Eine differenzierte ...
Einzeitiger und mehrzeitiger septischer Endoprothesenwechsel
Die periprothetische Infektion (PPI) stellt eine der gefürchtetsten Komplikationen im Bereich der Orthopädie und Traumatologie dar. Sie ist verbunden mit hohen Morbiditäts- und ...
Hochgradige ACG-Luxationen – wann konservativ behandeln, wann nicht?
Verletzungen des Akromioklavikulargelenks (ACG) gehören zu den häufigsten Schulterverletzungen bei jungen und aktiven Menschen, insbesondere auch aufgrund der zunehmenden Beliebtheit von ...