Septische Arthritis des Hüftgelenks
Autor:innen:
Dr. Klemens Vertesich
Priv.-Doz. Dr. Madeleine Willegger, FEBOT
Medizinische Universität
Universitätsklinik für Orthopädie und Unfallchirurgie, Klinische Abteilung für Orthopädie, Wien
Korrespondenz:
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die septische Arthritis (SA) des Hüftgelenks oder Coxitis septica isteine durch Bakterien verursachte Infektion des Gelenks. Bei pädiatrischen Patient:innen stellt die Diagnose einen orthopädischen Notfall dar, mit der Notwendigkeit einer umgehenden Therapieeinleitung. Die Abgrenzung zur aseptischen, transitorischen Synovitis oder Coxitis fugax stellt in vielen Fällen ein diagnostisches Dilemma dar. Daher ist ein klar strukturierter Diagnose- und Behandlungsalgorithmus essenziell, um eine zielführende Behandlung zu starten und damit die Prognose der betroffenen Patient:innen langfristig zu verbessern.
Keypoints
-
Die septische Arthritis des Hüftgelenks stellt eine schwerwiegende Erkrankung mit möglichen Langzeitfolgen für pädiatrische Patient:innen dar.
-
Rasche Diagnostik und umgehende Therapieeinleitung sind essenziell, um Langzeitfolgen zu vermeiden.
-
Die antibiotische Therapie zusammen mit chirurgischer Spülung und Debridement stellen die Therapie der Wahl dar.
-
Krankheitssymptome und laborchemische Parameter sind essenziell in der Unterscheidung einer SA des Hüftgelenks von einer Coxitis fugax.
-
Bei klinisch suspektem, trübem Punktat sollte das Gelenk lavagiert werden: „When in doubt, wash it out!“
Die septische Arthritis (SA) des Hüftgelenks bei Kindern und Jugendlichen stellt mit einer Inzidenz von 2–13 Fällen pro 100000 in entwickelten Ländern eine seltene Erkrankung dar, ist jedoch die häufigste septische Gelenksaffektion im Kindesalter. Häufigeres Auftreten wird bei Buben mit der Rate von 3:1 im Vergleich zu Mädchen beschrieben.1 Neben dem Geschlecht ist vor allem das Alter ein entscheidender Risikofaktor. 33–50% der SA des Hüftgelenks treten bei Kindern mit einem Alter von unter 2 Jahren auf.2 Die verursachenden Mikroorganismen (Bakterien) zeigen ebenso eine typische Altersverteilung. Bei Neugeborenen unter 1 Jahr sind vor allem Beta-hämolysierende Streptokokken und gram-negative Bakterien typisch.3,4 Im Alter von 1–5 Jahren werden typischerweise Staphylococcus (S.) aureus, S. pneumoniae und Kingella kingae (K. kingae) detektiert.5 Bei Kindern über 5 Jahren ist vor allem S. aureus der prädominante Mikroorganismus, der zu einer SA führt.
Der Nachweis von K. kingae als Ursache für SA nahm in den letzten 10 Jahren durch die routinemäßige Anwendung von molekularen Diagnosemethoden wie PCR deutlich zu.6,7 Dieses gram-negative Bakterium besiedelt vor allem die Atemwege. Im Rahmen einer SA durch K. kingae zeigen Kinder ein geringer ausgeprägtes Krankheitsbild als im direkten Vergleich mit klassischen S.-aureus-Infetionen, mit sub- oder afebrilen Temperaturen und niedrigeren Werten von C-reaktivem Protein (CRP).8,9 Rezente Studien beschreiben sogar K. kingae als häufigsten Verursacher einer SA bei Kindern unter 3 Jahren.6,7
Bei adoleszenten und sexuell aktiven Kindern oder im Rahmen von sexuellen Übergriffen kann eine Infektion mit Neisseria gonorrhoeae ebenso zu SA führen. Kinder mit Sichelzellanämie haben ein erhöhtes Risiko, eine SA mit Salmonella-Spezies zu entwickeln; ungeimpfte Kinder haben ein Risiko, Infektionen und folglich eine SA mit Haemophilus influenzae zu erleiden.10 Immunkompromittierte, pädiatrische Patient:innen können atypische Infektionen mit Pseudomonaden, Propionibakterien oder fungalen Erregern entwickeln und sollten diesbezüglich im Rahmen der Abklärung eine Ausweitung der Diagnostik erfahren.
In 33–66% der Fälle kann jedoch trotz moderner Methoden kein Keim nachgewiesen werden.11
Ätiologie
Es wurden verschiedene Mechanismen beschrieben, durch die bakterielle Organismen den intraartikulären Raum besiedeln können und so die Entstehung einer SA begünstigen. Als häufigster Mechanismus wird die hämatogene Streuung von Mikroorganismen in Gelenksstrukturen im Rahmen einer systemischen Bakteriämie beschrieben. Die hohe Vaskularität der Synovialmembran mit fehlender Basalmembran, die für die Blutversorgung des Gelenkraumes essenziell ist, bietet eine Eintrittspforte für das Eindringen und die Kolonisation von Bakterien.12,13 Von klinischer Relevanz sind hier vor allem Katheter-assoziierte Infektionen durch periphere, venöse und/oder zentralvenöse Zugänge. Speziell bei jungen Patient:innen sollen diese Interventionen minimiert werden.
Weiters kann eine direkte Verschleppung der Bakterien in den Gelenksraum im Rahmen eines Traumas, einer direkten Injektion oder einer Operation eine SA auslösen. Dies kann häufig zu atypischen und/oder polymikrobiellen Infektionen mit erschwerter Behandelbarkeit führen.14
Eine angrenzende Knochen- oder Weichteilinfektion kann ebenso zu einer bakteriellen Affektion des Gelenks führen und so zur Entstehung einer SA führen. Häufig wurde suszipiert, dass anatomische Unterschiede mit dem Vorhandensein von transphysealen Blutgefäßen die Ausbreitung einer metaphysären Osteomyelitis in den Gelenksraum vor allem bis zum Alter von 18 Monaten begünstigen können. Allerdings scheint diese Erläuterung aufgrund der relativ hohen gleichzeitigen Prävalenz einer SA und einer Osteomyelitis bei Kindern und Jugendlichen über 18 Monaten als unzureichend.15,16
In experimentellen Tiermodellen wurde die Pathophysiologie der lokalen Immunantwort des Körpers untersucht, welche vor allem auf der Ausschüttung von makrophagen-, neutrophilen- und lymphogen assoziierten Zytokinen basiert. Die einhergehende Ausschüttung von TNF-alpha und Interleukin 1 bedingt eine systemische Reaktion, was häufig zu Fieber und konstitutionellen Symptomen, wie Ermüdung und Krankheitsgefühl, führt.
Die folglich eintretende Knorpeldestruktion ist charakterisiert durch eine sequenzielle Reduktion der Proteoglykane und Kollagene in der Knorpelmatrix.17–19 In den Tierversuchsmodellen ist besonders der Zeitfaktor hervorzuheben, da bereits 8 Stunden nach der Infektion Destruktionen von Glykosaminoglykanen nachzuweisen waren.19
Diagnostik zur Unterscheidung zwischen einer SA des Hüftgelenks und einer Coxitis fugax
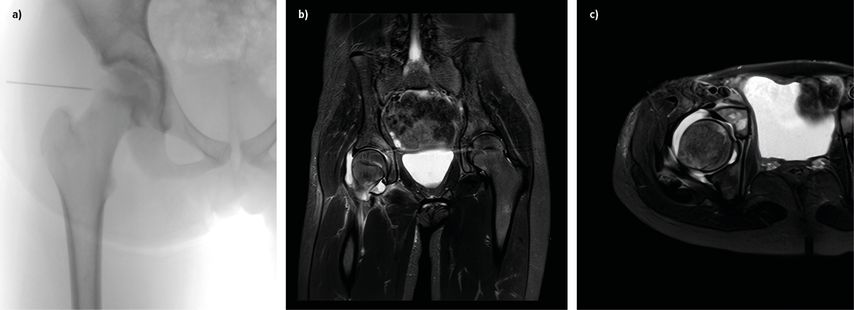
Krankheitssymptome und laborchemische Parameter sind essenziell in der Unterscheidung einer SA des Hüftgelenks von einer Coxitis fugax. Hüftschmerz ist ein häufiges Symptom bei pädiatrischen Patient:innen und kann bei benignen Prozessen wie einer selbstlimitierenden, transienten Synovitis auftreten, aber auch führendes Symptom bei gelenksschädigenden Erkrankungen wie einem Morbus Perthes (M. Perthes), einer Epiphyseolysis capitis femoris (ECF) oder einer SA des Hüftgelenks sein. Eine Vielzahl an Studien wurde veröffentlicht mit dem Ziel, eine diagnostische Abgrenzung zwischen Coxitis fugax und SA des Hüftgelenks zu finden. Spezifisch stellen die Kocher-Kriterien ein diagnostisches Modell mit 4 Kriterien dar, einschließlich des Vorhandenseins von Fieber (>38,5°C), der Blutsenkungsgeschwindigkeit (BSG) (>40mm/h), des Vorhandenseins von Schonhinken und systemischer Leukozytose (>12G/l).20 Die diagnostische Wahrscheinlichkeit für das Vorhandensein einer SA liegt bei 93%, wenn alle 4 Faktoren positiv sind. Folgestudien konnten zeigen, dass vor allem das CRP einen deutlichen diagnostischen Vorteil gegenüber der BSG hat.21,22 Ein CRP-Wert von 2mg/dl korreliert deutlich mit dem Vorhandensein einer SA. Obwohl die Abnahme von Blutkulturen häufig in der Behandlungsfindung hilfreich sein kann, sind Blutkulturen nur in 10–40% der SA positiv. Adäquate Bildgebung in der Diagnostik ist ebenso unumgänglich. Die Durchführung von Röntgenaufnahmen in 2 Ebenen bietet die Möglichkeit, Differenzialdiagnosen wie M. Perthes, ECF oder auch bereits manifeste ossäre Destruktionen oder Lysen bei Osteomyelitis auszuschließen.2 Mediale Gelenksspaltverbreiterung (mit oder ohne Subluxation des Hüftgelenks) oder periartikuläre Fettpolster-Verschiebung können einen Gelenkserguss radiologisch demaskieren. Die Sensitivität des Röntgens ist hier jedoch der Ultraschalluntersuchung signifikant unterlegen.23–27 Die Ultraschalluntersuchung beider Hüften im Seitenvergleich bietet die Möglichkeit einer umgehenden, strahlungsfreien und gut verfügbaren Diagnostik, die bei Präsenz oder Absenz eines Ergusses direkt die weitere Behandlung beeinflusst.2 Die Magnetresonanztomografie (MRT) findet im klinischen Alltag noch keine routinemäßige Anwendung. Aufgrund des häufig jungen Alters der Patient:innen ist eine MRT oft nur in Narkose durchführbar und diese Kapazitäten sind nicht flächendeckend gegeben.28–30 Die MRT ist jedoch diagnostisch sinnvoll bei uneindeutigen sonografischen Befunden oder um die Differenzialdiagnose einer hüftgelenksnahen Osteomyelitis abzuklären. Periartikuläre Veränderungen, Infektionen oder Retentionen, die weder im Röntgen noch in der Sonografie manifest sind, können zur Darstellung gebracht werden, was die Entscheidung bezüglich einer notwendigen Operation erleichtert.31 Dies wird auch im Fallbeispiel in Abbildung 1 gezeigt.
Abb. 1 a–c:11-jährige Patientin vorstellig mit diskret erhöhtem CRP von 0,8mg/dl ohne Fieber und Schonhinken der rechten Hüfte. Die Ultraschalluntersuchung zeigte einen Erguss, woraufhin eine Punktion des Hüftgelenks durchgeführt wurde (a). Bei klarem Erguss wurde von einer offenen Lavage initial abgesehen. Eine Keimdetektion aus gewonnenem Punktat war negativ. Im stationären Verlauf wurde aus der Blutkultur S. aureus nachgewiesen. Des Weiteren kam es zu einem Stagnieren der klinischen Besserung und einem Anstieg des CRP unter Antibiose. Eine MRT-Untersuchung zeigte einen Gelenkserguss mit begleitender Signalalteration im Sinne einer möglichen Osteomyelitis im ventralen Acetabulumbereich (b–c). Aufgrund dessen waren die offene Lavage und das Gelenks-Debridement indiziert
Adäquate Therapie
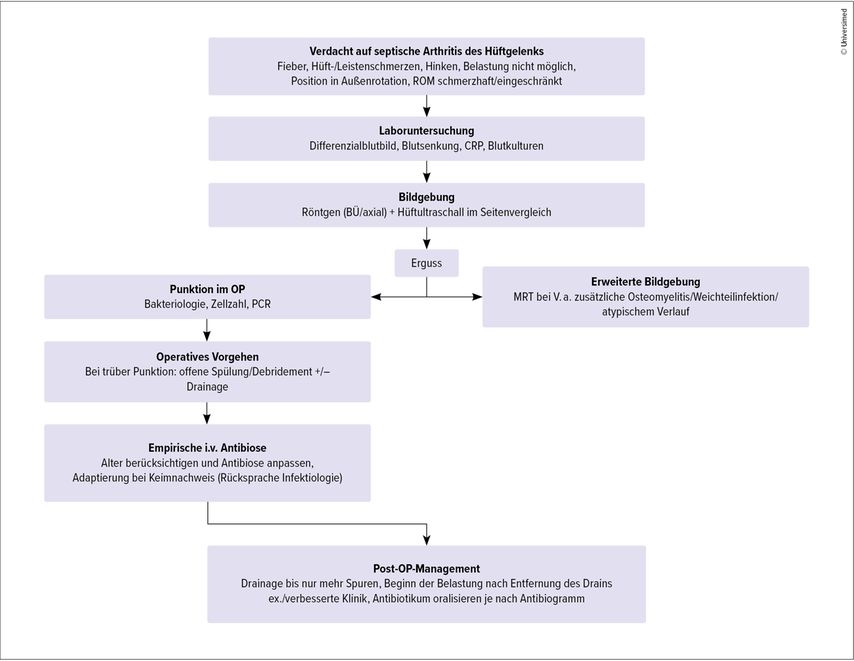
Die Etablierung eines Algorithmus wie in Abb. 2 ist hilfreich, um nach durchgeführter Diagnostik die adäquate Behandlung einzuleiten. Im Falle des Vorhandenseins positiver Infektionskriterien mit begleitendem Erguss des Hüftgelenks wird die sterile Punktion unter Ultraschall- oder Röntgenkontrolle empfohlen.32 Aus dem gewonnenen Punktat sollten mikrobiologische Untersuchungen wie eine Bakterienkultur, gegebenenfalls Gram-Färbung, PCR sowie Bestimmung der Zellzahl mit Differenzialzählung durchgeführt werden. Leukozyten-Grenzwerte von >50000 Zellen/mm3 und >75% segmentkernigen Granulozyten korrelieren mit dem Vorhandensein einer SA.33,34
Abb. 2: Empfohlener Diagnose- und Behandlungsalgorithmus der septischen Arthritis des Hüftgelenks bei pädiatrischen Patient:innen
Die initiale Therapie von Kindern mit SA des Hüftgelenks soll im Rahmen eines stationären Aufenthalts erfolgen. Nach erfolgter Probengewinnung ist eine empirische, intravenöse (i.v.) Antibiose indiziert.35 Das empirische antibiotische Schema ist – abhängig vom Alter der erkrankten Patient:innen – anhand des zu erwartenden Keimspektrums zu wählen.36,37 Aktuelle Empfehlungen beinhalten Amoxicillin/Clavulansäure oder Ampicillin/Sulbactam zu drei täglichen Dosen gewichtsadaptiert bei Kindern unter 2–4 Jahren.38 Hier kann vor allem eine etwaige Infektion mit K. kingae adressiert werden. Für Kinder über 4 Jahren oder älter wird vor allem der empirische Einsatz von Cephalosporinen wie Cefazolin zu drei täglichen und gewichtsadaptierten Dosen empfohlen.36
Empfehlenswert ist bereits vor Beginn der Antibiose eine interdisziplinäre Rücksprache mit Infektiolog:innen, da auf regions- oder krankenhausspezifische Keimspektren bereits in der empirischen Antibiose geachtet werden sollte. Bei Keimdetektion ist auf eine spezifische Antibiose zu wechseln. Aktuelle Daten empfehlen eine Dauer der i.v. Therapie von circa 7 Tagen, gefolgt von einer oralen Antibiose von 10–30 Tagen.39,40 In unserer Institution wird neben der klinischen Besserung der Symptomatik auch der laborchemische Verlauf des CRP zur Bestimmung der Dauer der i.v. Antibiose verwendet. Der zusätzliche Einsatz von Kortikosteroiden im Rahmen einer SA wird in einigen Studien empfohlen.41,42 Die Ergebnisse sind jedoch aufgrund des Studiendesigns und der limitierten Gruppengröße als eingeschränkt zu betrachten.2
Die Notwendigkeit einer operativen Therapie ist ein wichtiger Aspekt in der Behandlung der SA und sollte zügig bei gesicherter Diagnose und systemischer Inflammation erfolgen.36 Die chirurgische offene Lavage und das Debridement des Gelenks entlasten den intrakapsulären Druck, reduzieren die lokale Keimlast und bieten die Möglichkeit, bei begleitender Osteomyelitis auch ossäre Strukturen zu adressieren.36
Bei Kindern ist die Punktion des Gelenks häufig nur in Narkose im operativen Setting durchführbar. Daher empfehlen wir, bereits im Rahmen der Punktion bei bereits laufender Narkose die Indikation zur Lavage des Gelenks großzügig zu stellen. Bei gewonnenem Punktat mit bereits zweifelhafter, diskreter Trübung sollte die operative Therapie erfolgen, um das Risiko einer notwendigen sekundären Operation nach Keimgewinn und einer neuerlichen Narkose für das Kind zu reduzieren.5,37
Wir empfehlen ein offenes Vorgehen unter Verwendung eines modifizierten Smith-Peterson-Zugangs (Bikini-Inzision). Die intraartikuläre oder perikapsuläre Einlage einer Drainage wird in unserer Institution regelmäßig durchgeführt, wobei in der Literatur hierzu keine Angaben gemacht werden.
Arthroskopische Spülungen über ein singuläres Portal werden in der Literatur in den letzten Jahren häufig beschrieben.43,44 Wobei hier schlechtere Outcomes bei später Präsentation der Patient:innen beschrieben werden.45 Die alleinige perkutane Punktion des Gelenks wird in Studien als insuffizient bei SA beschrieben.5
Die Prognose der Patient:innen bei suffizienter Behandlung wird mit gut bis moderat angegeben.37 Verzögerter Therapiebeginn oder Fehldiagnosen als Risikofaktoren können mit Komplikationen und schlechterem Outcome mit langfristigen Veränderungen enden. Osteonekrosen, Beinlängendifferenz, Sub- oder Dislokation des Hüftkopfes, Wachstumsverzögerung, Osteomyelitis oder progressive Ankylose werden beschrieben.46 Langzeitergebnisse nach bis zu 20 Jahren zeigen in 81% exzellente radiologische Outcomes. Schlechte klinische Outcomes wurden in circa 31% der Fälle beschrieben.47 Behandlungsoptionen bei Deformierung des Hüftgelenks nach SA beinhalten konservative Maßnahmen wie Orthesenversorgung und Physiotherapie. Operativ stehen epiphysäre Bohrungen zur Verbesserung der Durchblutung, Gelenksrekonstruktionen oder Osteotomien zur Deformitätenkorrektur zur Verfügung.46 Solche operativen Maßnahmen werden entsprechend der individuellen Morphologie adaptiert und sollten in Zentren mit Erfahrung in Planung und Durchführung dieser Eingriffe erfolgen.
Literatur:
1 Nunn TR et al.: J Bone Joint Surg Br 2007; 89(1): 100-6 2 Swarup I et al.: JBJS Rev 2020; 8(2): e0103 3 Arnold SR et al.: J Pediatr Orthop 2006; 26(6): 703-8 4 Edwards MS et al.: J Pediatr 1978; 93(4): 578-83 5 Arkader A et al.: JAm Acad Orthop Surg 2016; 24(9): e112-21 6 Lundy DW, Kehl DK: J Pediatr Orthop 1998; 18(2): 262-7 7 Yagupsky P: Lancet Infect Dis 2004; 4(6): 358-67 8 Basmaci R et al.: Pediatr Infect Dis J 2011; 30(10): 902-4 9 Ceroni D et al.: JPediatr Orthop 2010; 30(3): 301-4 10 Burnett MW, Bass JW: Pediatrics 1998; 101(2): 296-7 11 Yagupsky P et al.: Arch Pediatr Adolesc Med 1995; 149(5): 537-40 12 Tarkowski A et al.: Trends Microbiol 2001; 9(7): 321-6 13 FitzGerald O, Bresnihan B: Ann Rheum Dis 1995; 54(6): 511-5 14 McNeil JC et al.: Pediatr Infect Dis J 2018; 37(12): 1204-10 15 Perlman MH et al:. J Pediatr Orthop 2000; 20(1): 40-3 16 Montgomery CO et al.: J Pediatr Orthop 2013; 33(4): 464-7 17 Curtiss PH Jr., Klein L: J Bone Joint Surg Am 1963; 45-a: 797-806 18 Curtiss PH Jr., Klein L: J Bone Joint Surg Am 1965; 47(8): 1595-604 19 Smith RL et al.: JBone Joint Surg Am 1987; 69(7): 1063-8 20 Kocher MS et al.: J Bone Joint Surg Am 1999; 81(12): 1662-70 21 Caird MS et al.: J Bone Joint Surg Am 2006; 88(6): 1251-7 22 Singhal R et al.: J Bone Joint Surg Br 2011; 93(11): 1556-61 23 Kocher MS et al.: J Bone Joint Surg Am 2004; 86(8): 1629-35 24 Jung ST et al.: J Pediatr Orthop 2003; 86(8): 1629-35 25 Eich GF et al.: Eur J Pediatr 1999; 158(11): 923-8 26 Zamzam MM: J Pediatr Orthop B 2006; 15(6): 418-22 27 Gordon JE et al.: J Pediatr Orthop 2002; 22(3): 312-6 28 Rosenfeld S et al.: J Pediatr Orthop 2016; 36(1): 70-4 29 Nguyen A et al.: J Pediatr Orthop 2017; 37(2): e114-e119 30 Refakis CA et al.: J Pediatr Orthop 2019; 39(5): 268-74 31 Mignemi ME et al.: J Pediatr Orthop 2014; 34(3): 316-25 32 Shmerling RH et al.: JAMA 1990; 264(8): 1009-14 33 Dart AH et al.: Pediatrics 2018; 141(5): e20173810 34 Heyworth BE et al.: J Bone Joint Surg Am 2015; 97(5): 389-95 35 Dodwell ER: Curr Opin Pediatr 2013; 25(1): 58-63 36 Sucato DJ et al.: J Am Acad Orthop Surg 1997; 5(5): 249-60 37 Sanpera I et al.: J Child Orthop 2025; 19(1): 14-9 38 Wagner N et al.: Paediatrica 2017; 28(1): 8 39 Kim HK et al.: J Pediatr Orthop 2000; 20(1): 44-7 40 Peltola H et al.: Clin Infect Dis 2009; 48(9): 1201-10 41 Odio CM et al.: Pediatr Infect Dis J 2003; 22(10): 883-8 42 Harel L et al.: J Pediatr Orthop 2011; 31(2): 211-5 43 Weigl DM et al.: J Pediatr Orthop B 2016; 25(6): 514-9 44 Chung WK et al.: J Pediatr Orthop 1993; 13(4): 444-6 45 Sanpera I et al.: Orthop Traumatol Surg Res 2016; 102(1): 87-9 46 Samora JB, Klingele K: J Am Acad Orthop Surg 2013; 21(10): 632-41 47 Hoswell RL et al.: ANZ J Surg 2019; 89(5): 562-6
Das könnte Sie auch interessieren:
Periphere Nervenkompressionssyndrome der oberen Extremität
Periphere Nervenkompressionssysteme der oberen Extremitäten sind verhältnismäßig häufig, insbesondere der Nervus medianus und der Nervus ulnaris sind oft im Bereich des Hand- bzw. ...
Konservative Behandlungsmöglichkeiten bei peripheren Nervenläsionen
Eine periphere Nervenläsion erfordert nicht nur eine Dekompression, Naht oder Rekonstruktion. Um Gelenke beweglich zu erhalten, eine Atrophie der Muskulatur zu verhindern und die ...
Bildgebende Diagnostik des peripheren Nervensystems
Die komplexen Nerventopografien machen die Nervenbildgebung zu einer fordernden Aufgabe, die allerdings eine wichtige Rolle dabei spielt, eine funktionelle Wiederherstellung der ...