Postoperative spinale Implantatinfektionen – eine aktuelle Übersicht
Autoren:
Dr. Julian Schiebel
Assoc. Prof. Priv.-Doz. Dr. Kambiz Sarahrudi
Abteilung für Unfallchirurgie,
Landesklinikum Wiener Neustadt
Korrespondierender Autor:
Dr. Julian Schiebel
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Obwohl postoperative spinale Implantatinfektionen (PSII) zu den wachsenden Herausforderungen des klinischen Alltags zählen, besteht bis dato kein allgemeiner Konsens zur Behandlung dieser Komplikation. Dieser Artikel soll einen Überblick zu PSII inklusive Epidemiologie, Diagnose, Therapie und Prophylaxe liefern.
Keypoints
-
Eine ausreichende Prophylaxe kann PSII vermeiden helfen.
-
Bei Frühinfekten kann oft ein Erhalt der Implantate erreicht werden.
-
Zur Erregerbestimmung sollten zumindest drei Proben gewonnen werden.
-
Therapiekonzepte sollten am besten interdisziplinär erstellt werden.
-
Zu PSII besteht noch kein allgemeiner Konsens, da auch der Begriff nicht einheitlich definiert ist.
Zunächst stellt sich die Schwierigkeit der genauen Definition, da die meisten Arbeiten auf diesem Gebiet generelle spinale Infektionen, auch ohne vorangegangene Operation, bzw. unspezifische postoperative Nosokomialinfektionen („surgical site infections“, SSI) untersuchten. Eine mögliche Definition wurde von Trampuz et al. auf Basis der Kriterien der periprothetischen Gelenkinfektion der EBJIS (European Bone and Joint Infection Society) entwickelt. Hierbei wird eine PSII bei einem Auftreten innerhalb von 6 Wochen postinterventionell als akut und danach als chronisch definiert, wobei diese als bestätigt gilt, wenn zumindest eines der folgenden Kriterien erfüllt ist:
-
Klinik: Fistel/Wunddehiszenz oder sichtbarer Eiter oder positiver „Probe-to-implant“-Test
-
Histologie: Entzündung in periimplantärem Gewebe
-
Mikrobiologie: signifikanter Erregernachweis in zumindest zwei periimplantären Gewebeproben oder ein Sonikat des Implantats mit ≥50 Kolonien/ml, wobei bei hoch virulentem Erreger (z.B. S. aureus, E. coli, Streptokokken) oder Patienten unter Antibiotikatherapie eine positive Probe ausreicht bzw. ein Sonikationsresultat mit <50 Kolonien/ml signifikant sein kann
Ausgehend von der aktuellen Literatur treten unspezifische postoperative Nosokomialinfektionen nach Wirbelsäulenoperationen bei etwa 0,7–20% der Fälle auf, wobei die Arbeit von Horn et al. aus dem Jahr 2019 mit der höchsten Anzahl an inkludierten Fällen (90551 elektive Wirbelsäulenoperationen, 2005–2013) eine durchschnittliche Infektionsrate von 1,4% feststellte.
Eine prospektive Studie mit 250 eingeschlossenen Patienten mit PSII von Margaryan et al. zeigte 2020, dass 98% der aufgetretenen Infektionen während der Operation erworben wurden. Die meisten davon (61%) traten akut innerhalb von sechs Wochen auf. Die vorherrschend bestimmten Erreger hierbei waren Koagulase-negative Staphylokokken, Staphylococcus aureus und Cutibacterium spp.
Risikofaktoren
Zu den Risikofaktoren, die zur Entstehung einer PSII beitragen können, zählen zunächst generelle, unspezifische patientenassoziierte Faktoren, wie erhöhtes Patientenalter, Diabetes mellitus, ein hoher ASA-Score, Adipositas, Immunsuppression, Alkohol- und Tabakkonsum und Krebserkrankungen. Spezifisch für Wirbelsäulenoperationen konnten mehrere Studien zeigen, dass der posteriore offene im Vergleich zum anterioren Zugang eine höhere Anzahl an involvierten Wirbelsegmenten und Stahl im Vergleich zu Titan als Implantatmaterial höhere Infektionsraten nach sich zog.
Symptome und Diagnose
Bei einer akuten Infektion können Symptome wie akute Schmerzen, Fieber, prolongierte Wundsekretion (>7–10 Tage) und/oder akute neurologische Defizite auftreten. Diese wird meist durch hoch virulente Erreger wie Staphylococcus aureus, Streptokokken und gramnegative Bakterien ausgelöst. Spätinfektionen zeigen chronische Schmerzen, Implantatmigration/-lockerung, Fistelbildung und/oder neurologische Defizite. Hier sind typische Erreger Koagulase-negative Staphylokokken und Cutibacterium acnes.
Einer Diagnose sollten immer eine ausführliche Anamnese inklusive durchgeführter Operationen/Interventionen sowie eine komplette körperliche Untersuchung vorangehen. Laboruntersuchungen zur Bestimmung von Entzündungsparametern, wie CRP, Procalcitonin, Blutsenkung und Leukozytenzahl, können weiteren Aufschluss bringen, schließen – insbesondere bei chronischen, niedrig virulenten Infektionen – jedoch eine PSII nicht aus. Bei Anzeichen von systemischen Infektionen sollten unbedingt zusätzlich Blutkulturen angelegt werden.
Konventionelle Röntgenbilder in zwei Ebenen sowie eine Computertomografie können Begleitpathologien, wie Frakturen sowie Implantatmigration oder -lockerung, zeigen. Zusätzlichen Aufschluss kann eine MRT oder PET-CT bringen.
Essenziell ist weiters die Identifikation von möglichen Infektionsherden, die hämatogen (Zähne, Herz, Lunge, Urogenitaltrakt), lokal (Haut, umgebendes Weichteilgewebe, Knochen) oder anderwärtig ausgelöst (Operationen, zahnärztliche Behandlungen, immunsuppressive Therapie) sein können.
Anschließend sollte zur prä- auch eine intraoperative Diagnostik, ähnlich wie bei periprothetischen Gelenkinfektionen, durchgeführt werden. Diese inkludiert die Entnahme von zumindest drei Gewebeproben zur histopathologischen bzw. mikrobiologischen Untersuchung sowie eventuell zusätzlich eine Sonikation von entfernten Implantaten.
Therapie
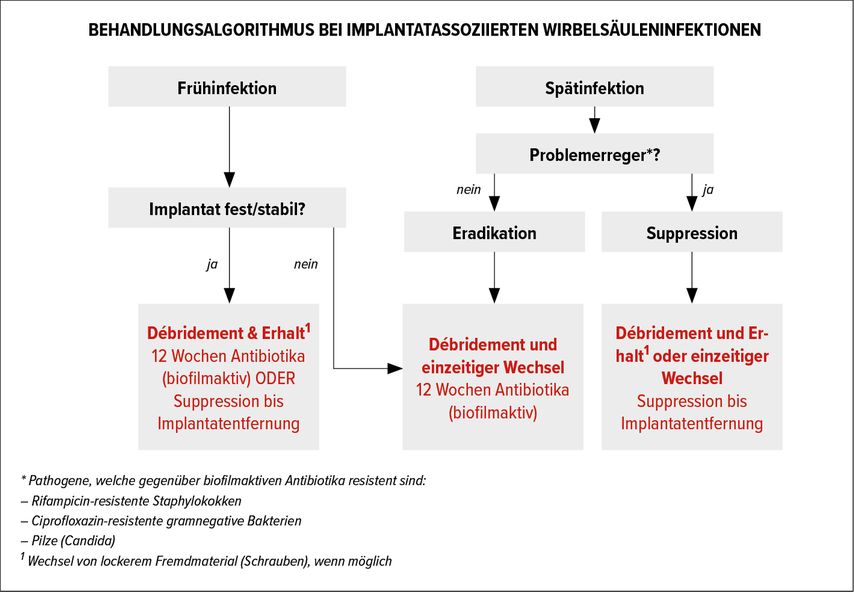
Bis dato besteht kein einheitliches Therapieschema zur Behandlung der PSII. Generell wird empfohlen, die Therapie interdisziplinär mit den Fächern der Mikrobiologie und Pathologie zu gestalten. Bei instabilen Implantaten und Patienten mit neurologischen Symptomen sollte ein sofortiger Implantatwechsel erfolgen. Ist der Patient nicht operabel, besteht die Möglichkeit einer suppressiven Antibiotikatherapie. Bei der Bildung eines Biofilms oder von speziellen Erregern, die nicht mittels Antibiotikum eradiziert werden können, ist ebenfalls ein Implantatwechsel mit Antibiotikatherapie nötig. Vor allem bei akuten Infektionen besteht die Möglichkeit des Erhalts des Implantats durch Débridement und Therapie mit Antibiotika, eventuell mit zusätzlicher Anlage eines Vakuumverbands. Eine gute Übersicht dazu bietet der Behandlungsalgorithmus der PRO-IMPLANT Foundation (Abb. 1).
Abb. 1: Behandlungsalgorithmus bei implantatassoziierten Wirbelsäuleninfektionen der PRO-IMPLANT Foundation
Die Dauer der Antibiotikagabe wird nach wie vor diskutiert, sie variiert zwischen sechs und zwölf Wochen. Trampuz et al. empfehlen eine Dauer von zwölf Wochen, wobei die Therapie in den ersten zwei Wochen i.v. und anschließend p.o. erfolgt.
Prophylaxe
In Anbetracht der Komplexität der Behandlung der PSII ist die adäquate Prophylaxe einer Infektion essenziell. Wichtige Strategien dafür sind eine prä-/perioperative Antibiotikaprophylaxe, der vordere Zugang, regelmäßiges Wechseln der OP-Handschuhe und minimal invasiv durchgeführte Operationen. Zur prä-/perioperativen Prophylaxe werden am häufigsten Cephalosporine der ersten und zweiten Generation verwendet. Bei bekannten Allergien gegen Penicillin oder Cephalosporin verwenden die meisten Autoren Vancomycin. In einer Metaanalyse von Phillips et al. 2020 konnte kein signifikanter Unterschied zwischen einer rein prä-/perioperativen und einer postoperativ fortgeführten Antibiotikaprophylaxe festgestellt werden.
Abschließend werden noch zwei Fälle unserer Abteilung vorgestellt. Der erste Patient (männlich, 64 Jahre) fügte sich bei einem Sturz eine Fraktur des dritten Lendenwirbelkörpers zu. Diese wurde mittels dorsaler Stabilisierung Th V bis Th VIII operativ versorgt. Nach etwa 3,5 Wochen entwickelte sich bei dem Patienten eine akute PSII, die sich durch putride Sekretion aus den Operationswunden äußerte. Es erfolgten anschließend der sofortige Beginn einer intravenösen Antibiotikumgabe und die Revision der Operationswunden inklusive Débridement und Anlage eines Vakuumverbands. Dieser wurde nach einer Woche gewechselt und nach drei weiteren Tagen entfernt und die Wunden wurden bei blanden Weichteilverhältnissen verschlossen. Aus den in der ersten Revision entnommenen Proben konnten Cutibacterium-acnes-Kulturen gewonnen werden, die auf das bereits etablierte Antibiotikum sensibel waren. Nach weiteren drei Wochen entwickelte sich jedoch eine Fistel im Bereich des Implantats. Da die Fraktursituation noch instabil war, musste von einer Entfernung der Implantate zunächst abgesehen werden und die Infektion wurde mit oraler Antibiotikumgabe supprimiert. Aufgrund der über die nächsten vier Wochen zunehmenden Infektsituation – nun auch mit Schmerzen für den Patienten verbunden – wurde die Entscheidung gefällt, das gesamte Stabilisierungsmaterial zu entfernen und die Behandlung der Fraktur mittels Mieder fortzuführen. Nach insgesamt 12 Wochen antibiotischer Therapie konnte diese beendet und der Patient mit blanden Wundverhältnissen aus der Behandlung entlassen werden.
Der zweite Patient (männlich, 54 Jahre) kam beim Mountainbiken zu Sturz und zog sich dabei u.a. eine Fraktur des zweiten Halswirbels und des ersten Lendenwirbelkörpers zu. Es erfolgte eine ventrale Verplattung des zweiten auf den dritten Halswirbelkörper mit Diskektomie C2/3 und Auffüllung mit einem Knochenspan, der aus dem Beckenkamm entnommen wurde. Zusätzlich wurde von dorsal vom elften und zwölften Brustwirbel auf den zweiten Lendenwirbel perkutan stabilisiert. Der postoperative Verlauf gestaltete sich zunächst komplikationsfrei, sodass der Patient mit antibiotischer Prophylaxe entlassen werden konnte. Am zehnten postoperativen Tag entleerte sich putrides Sekret aus den Operationswunden der Brust- bzw. Lendenwirbelsäule und der Entnahmestelle am Beckenkamm. Der Patient wurde daraufhin erneut zur operativen Wundrevision stationär aufgenommen. Zunächst wurde eine empirische antibiotische Therapie mit Ampicillin/Sulbactam 3g 3x1 intravenös etabliert und am darauffolgenden Tag die Wunden eröffnet, drei bakteriologische Proben entnommen, débridiert, ausgiebig gespült, die Wunden wieder locker verschlossen und Redondrainagen eingelegt. Diese wurden für zwei Tage belassen. Der mikrobiologische Kulturbefund ergab Methicillin-resistenten Staphylococcus aureus (MRSA) und es wurde nach Antibiogramm die antibiotische Therapie auf Trimethoprim/Sulfamethoxazol und Rifampicin umgestellt. Nach einer Woche konnte der Patient bei so weit blanden Wundverhältnissen mit oraler Linezolid-Therapie für weitere zwei Wochen entlassen werden. Nach Ablauf dieser zwei Wochen war der Patient vollkommen beschwerdefrei mit bland abgeheilten Operationsnarben.
Zusammenfassend herrscht noch kein allgemeiner Konsens zur eindeutigen Definition der PSII und die Behandlung sollte interdisziplinär mit den Fächern der Mikrobiologie und Pathologie erfolgen, um ein bestmögliches Ergebnis für die Patienten zu erzielen.
Literatur:
● Gerometta A et al.: Infections in spinal instrumentation. Int Orthop 2012; 36(2): 457-64 ● Horn SR et al.: Predictors of hospital-acquired conditions are predominately similar for spine surgery and other common elective surgical procedures, with some key exceptions. Global Spine J 2019; 9(7): 717-23 ● Karczewski D et al.: Postoperative spinal implant infections (PSII) - a systematic review: what do we know so far and what is critical about it? Global Spine J 2021; 21925682211024200 ● Kasliwal M et al.: Infection with spinal instrumentation: review of pathogenesis, diagnosis, prevention, and management. Surg Neurol Int 2013; 4(6): 392 ● Margaryan D et al.: Spinal implant-associated infections: a prospective multicentre cohort study. Int J Antimicrob Agents 2020; 56(4): 106116 ● Phillips BT et al.: Preoperative versus extended postoperative antimicrobial prophylaxis of surgical site infection during spinal surgery: a comprehensive systematic review and meta-analysis. Adv Ther 2020; 37(6): 2710-33 ● Quaile A: Infections associated with spinal implants. Int Orthop 2012; 36(2): 451-6 ● Trampuz A: Pocket guide to diagnosis and treatment of spinal infections. Version 4. PRO-IMPLANT Found 2021; https://pro-implant.org
Das könnte Sie auch interessieren:
Mehr kardiovaskuläre Ereignisse und Malignome?
Mit Tofacitinib, einem Strukturanalogon von ATP, wurde 2013 erstmals ein Januskinase-Inhibitor (JAKi) in der Schweiz zugelassen. Die Vertreter dieser Medikamentenklasse haben sich gut ...
Seltene Kleingefässvaskulitiden im Fokus
Bei Vaskulitiden der kleinen Gefässe liegt eine nekrotisierende Entzündung der Gefässwand von kleinen intraparenchymatösen Arterien, Arteriolen, Kapillaren und Venolen vor. Was gilt es ...
Elektive Hüft-TEP bei Adipositas Grad III
Übergewichtige Patient:innen leiden früher als normalgewichtige Personen an einer Hüft- oder Kniearthrose. Allerdings sieht die aktuelle S3-Leitlinie zur Behandlung der Coxarthrose in ...