Partikeltherapie als Chance für Sarkompatienten
Autoren:
PD Mag. Dr. Birgit Lohberger1
Prof. Dr. Andreas Leithner1
PD Dr. Petra Georg2
1 Universitätsklinik für Orthopädie und Traumatologie, Medizinische Universität Graz
2 MedAustron, Zentrum für Ionentherapie und Forschung, Wiener Neustadt
Korrespondierende Autorin:
PD Mag. Dr. Birgit Lohberger
E-Mail: birgit.lohberger@medunigraz.at
Das österreichische Zentrum für Ionentherapie und Forschung MedAustron bietet Tumorpatienten seit 2016 eine schonende Alternativtherapie zur herkömmlichen Strahlentherapie an: die Partikeltherapie. Durch die speziellen strahlenphysikalischen Eigenschaften können die Protonen oder Kohlenstoffionen millimetergenau auf das Tumorgewebe ausgerichtet werden. Umliegendes Gewebe bleibt so überwiegend geschont. Diese Eigenschaft spielt eine besondere Rolle bei Tumoren, die neben hoch strahlensensiblen Organstrukturen liegen.
Keypoints
-
Partikeltherapie mit Protonen und Kohlenstoffionen gewährleistet eine hohe Effektivität bei strahlenresistenten Tumoren wie Chordomen und Chondrosarkomen.
-
Durch die strahlenphysikalischen Besonderheiten können Tumoren mit sehr hoher Treffgenauigkeit bestrahlt werden, das umliegende gesunde Gewebe wird somit geschont.
-
Vor allem durch die Anwendung der Kohlenstoffionen kann auch die Anzahl der erforderlichen Sitzungen verringert werden, was zu einer kürzeren Therapiedauer führt.
-
Aufgrund der biologischen Aggressivität der Kohlenstoffionen ist die Wahrscheinlichkeit höher, hypoxische, inoperable Tumoren zu zerstören.
Strahlentherapie bei Knochen- und Weichteilsarkomen
Sarkome sind seltene maligne Knochen- und Weichteiltumoren mit mehr als 150 Untergruppen.1 Zu den Knochensarkomen zählen unter anderem das Osteosarkom, das Ewing-Sarkom, das Chondrosarkom und das Chordom. Die häufigsten Weichteilsarkome sind das Liposarkom, das Leiomyosarkom, das Synovialsarkom und – vor allem im Kindesalter – das Rhabdomyosarkom.
Neben einer operativen Entfernung und manchmal auch einer Chemotherapie nimmt die Strahlentherapie einen hohen Stellenwert ein. Um sicherzustellen, dass jeder Patient die für sein individuelles Krankheitsbild beste Therapieoption erhält, sollte über den Behandlungsplan innerhalb eines Sarkomzentrums im Rahmen eines interdisziplinären Tumorboards entschieden werden. Strahlentherapie bei Sarkomen erfolgt sowohl vor einem operativen Eingriff (neoadjuvant), um den Tumor zu verkleinern, als auch postoperativ (adjuvant), um die im Körper noch vorhandenen Tumorzellen zu vernichten.
Partikelbestrahlung ist bei Tumoren indiziert, bei denen mit einer konventionellen Photonentherapie (Röntgenstrahlung) keine zufriedenstellenden Erfolge erzielt werden.2 Insbesondere die Chordome und Chondrosarkome der Schädelbasis gelten als anerkannte Indikation für eine Partikeltherapie.3–4 Da diese Tumoren häufig an kritischen Strukturen wie dem Hirnstamm, dem Sehnerv oder dem Temporallappen liegen, können sie nicht oder nur teilweise operativ entfernt werden. Zusätzlich zeigen diese Tumorentitäten eine geringe Sensibilität gegenüber einer konventionellen Photonenbestrahlung. Aufgrund der strahlenphysikalischen Eigenschaften einer Partikeltherapie können diese Tumoren schonend mit höheren Dosen bestrahlt werden, ohne das umliegende Gewebe zu schädigen, was zu einer lokalen Tumorkontrolle von 70–90% führt.5–6
Strahlenphysikalische Charakteristika der Partikeltherapie
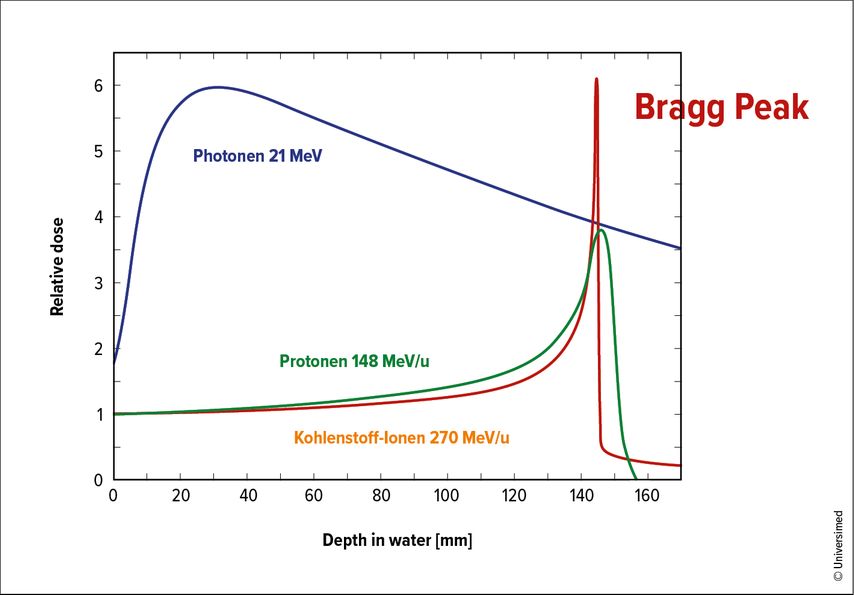
Der große Unterschied zwischen einer Photonentherapie und einer Partikeltherapie beruht auf der Art und Weise, wie die Energie im Körper des Patienten abgegeben wird. Photonenstrahlung wird auf ihrem Weg durch den Körper exponentiell abgeschwächt, was bedeutet, dass in der Nähe der Oberfläche mehr Energie abgegeben wird als bei tieferliegenden Tumoren. Hingegen geben die geladenen Partikel, die entweder Protonen- oder Kohlenstoffionen sein können, ihre Energie an die Materie zunächst nur geringfügig ab und werden nach einer konstanten Durchdringungsstrecke gestoppt. Am Ende dieser definierten Reichweite wird die gesamte Energie konzentriert im Bereich des sogenannten „Bragg peak“ abgegeben (Abb. 1).7–8 Diese Eigenschaft wird als „linearer Energietransfer“ (LET) bezeichnet. Diese hohe Treffgenauigkeit ist von unschätzbarem Wert für die Behandlung von Tumoren, die sehr nahe an strahlenempfindlichem gesundem Gewebe lokalisiert sind, und ergibt somit einen vorteilhafteren Tiefendosis-Verlauf. Durch die definierte, scharf begrenzte Reichweite wird sowohl das Gewebe vor als auch das nach dem Tumor geschont. Da die räumliche und energetische Streuung bei Kohlenstoffionen geringer als jene bei Protonen ist, können sie bei gleicher Tiefe sogar noch präziser angewendet werden. Die Kohlenstoffionen können dazu noch einen 2–3x größeren Schaden in der Tumorzelle (z.B. durch multiple Induktion von DNA-Doppelstrangbrüchen) bewirken, weshalb eine höhere biologische Aggressivität besteht. Das eignet sich besonders zur Zerstörung von inoperablen, radioresistenten und hypoxischen Tumoren, wie es bei Chordomen, Chondrosarkomen oder Osteosarkomen oft der Fall ist.
Abb. 1: Schematische Darstellung der unterschiedlichen LET(Linearer Energietransfer)-Verlaufskurven der Photonenstrahlung versus Protonen- und Kohlenstoffionen. Der „Bragg peak“ definiert jenen Bereich, bei dem die Partikelstrahlung die gesamte Energie abgibt und somit das umliegende gesunde Gewebe schont
Die größte Einschränkung dieser innovativen und hochwirksamen Technologie ist logistischer Natur. Die Partikeltherapie erfordert einen Teilchenbeschleuniger in unmittelbarer Nähe zum Behandlungsraum. Bedingt durch die extrem hohen Kosten gibt es derzeit in Europa nur vier Standorte, welche auf eine solche Infrastruktur zurückgreifen können. Zwei davon befinden sich in Deutschland (das Heidelberger Ionenstrahl-Therapiezentrum, HIT, und das Marburger Ionenstrahl-Therapiezentrum, MIT), eines in Italien (Centro Nazionale di Adroterapia Oncologica,CNAO, in Pavia nahe Mailand) und eines inÖsterreich: das Österreichische Zentrum für Ionentherapie und Forschung (MedAustron) in Wiener Neustadt.
MedAustron, das österreichische Zentrum für Ionentherapie und Forschung
MedAustron ist ein Ionentherapiezentrum, welches im Jahr 2016 die ersten Behandlungen an Patient*innen durchgeführt hat. Die Ionenarten für eine Therapieanwendung sind sowohl Protonen als auch Kohlenstoffionen. Neben der Behandlung von Patient*innen in klinischen Studien (wie z.B. einer prospektiven Registerstudie zur Erfassung von Therapieeffizienz und Nebenwirkungen von Partikeltherapie und anderen indikationsspezifischen Studien) werden auch translationale Forschungsthemen beantwortet. Einen hohen Stellenwert nehmen weiters Fragestellungen der Strahlenphysik und der angewandten Teilchenphysik ein.
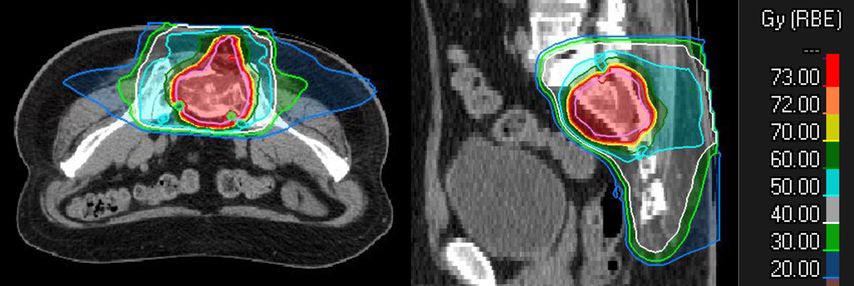
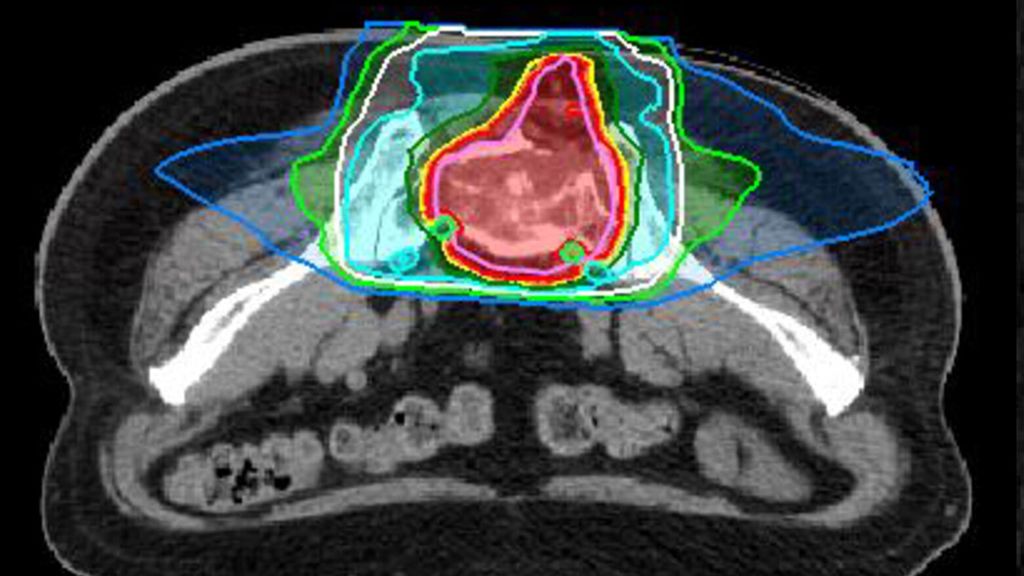
MedAustron behandelt nationale und internationale Patient*innen. Eine Therapieanfrage kann durch Fachkolleg*innen oder durch Patient*innen selbst erfolgen. Die Indikation zur Behandlung wird durch ein interdisziplinäres Tumorboard geprüft. Die Behandlungskosten trägt die Gesundheitsversicherung. Nach Bestätigung der Indikation und der Behandlungskostenübernahme wird mit der Behandlungsplanung begonnen. Voraussetzung dafür ist ein ausführliches ärztliches Aufklärungsgespräch. Danach werden individuelle Positionierungen, eine Planungs-Computertomografie und -Magnetresonanztomografie durchgeführt. Diese sind für die Bestrahlungstarget-Definition und die Berechnung des Bestrahlungsplans essenziell. Ein Beispiel für einen solchen Behandlungsplan ist in Abbildung 2 zu sehen.
Abb. 2: Planbeispiel einer definitiven Behandlung eines Chordoms des Sakrums mit 16 Fraktionen à 4,6 Gy RBE pro Fraktion bis zu einer Gesamtdosis von 73,6 Gy RBE mit Kohlenstoffionen
Die Behandlung selbst wird in mehreren Fraktionen (Einzelbehandlungen) durchgeführt. Die Anzahl ist von der Partikelart und der Tumorlokalisation abhängig. Kohlenstoffionen werden üblicherweise in 16 oder 22 Fraktionen appliziert, Protonen in 22 oder mehr Fraktionen, abhängig davon, ob es sich um reine postoperative Behandlung handelt oder ob ein Tumorrest besteht. Die Reduktion der Fraktionsanzahl hat auch logistische Vorteile, weil dadurch die Gesamtdauer der Behandlung verkürzt werden kann.
Zelluläre Grundlagenforschung als Basis für eine bessere therapeutische Anwendung
Obwohl die klinische Anwendung der Partikeltherapie therapeutische Erfolge zeigt, gibt es in der Fachliteratur nur wenige fundierte strahlenbiologische In-vitro-Studien bei Sarkomen. Aus diesem Grund hat sich unsere Forschung der letzten 3 Jahre auf zellbiologische und molekularbiologische Mechanismen konzentriert, die nach einer Bestrahlung humaner Chondrosarkomzellen mit Protonen und Kohlenstoffionen auftreten. Durch ein besseres Verständnis der tumorbiologischen Vorgänge kann die klinisch-therapeutische Anwendung verbessert werden.
Wir konnten nachweisen, dass sowohl Photonen- als auch Protonenbestrahlung zu einer verringerten Zellüberlebensrate und einem Stillstand des Zellzyklus in der G2/M-Phase führen. Bereits eine Stunde nach der Bestrahlung wurde ein signifikanter, dosisabhängiger Anstieg der phosphorylierten γH2AX-Foci, eines anerkannten Biomarkers für DNA-Schäden, beobachtet. Dies ging mit einer Umprogrammierung des zellulären Stoffwechsels einher. Interessanterweise war innerhalb von 24 Stunden die Mehrzahl dieser deutlich sichtbaren DNA-Schäden repariert und der Stoffwechselphänotyp wiederhergestellt. Beteiligte DNA-Reparaturmechanismen sind neben der homolog gerichteten Reparatur (HDR) und der nichthomologen Endverbindung (NHEJ) vor allem der Mismatch-vermittelte Reparaturweg (MMR) mit den Hauptakteuren EXO1, MSH3 und PCNA. Somit konnten wir nachweisen, dass humane Chondrosarkomzellen in der Lage sind, den Großteil der DNA-Schäden innerhalb von 24 Stunden zu reparieren.9
Um diese effizienten DNA-Reparaturmechanismen zu unterdrücken und damit die Chondrosarkomzellen empfindlicher für eine Strahlentherapie zu machen, behandelten wir die Sphäroidkulturen mit dem Proteasom-Inhibitor Bortezomib. Leider konnte damit nicht der gewünschte Effekt hervorgerufen werden, obwohl eine kombinierte Behandlung mit Bortezomib die Verteilung der Zellzyklusphasen veränderte und einen synergistischen Rückgang der Expression von Survivin und der nachgeschalteten Gene HSP90 („heat shock protein 90“), XIAP („X-linked inhibitor of apoptosis protein“), smad 2 und smad 3 hervorrief. Diese Hemmung des Survivin-Signalwegs enthüllte einen neuen, interessanten Aspekt in der Tumorbiologie von Chondrosarkom-3D-Sphäroid-Kulturen und könnte eine zukünftige Option für die klinische Nutzung darstellen.10
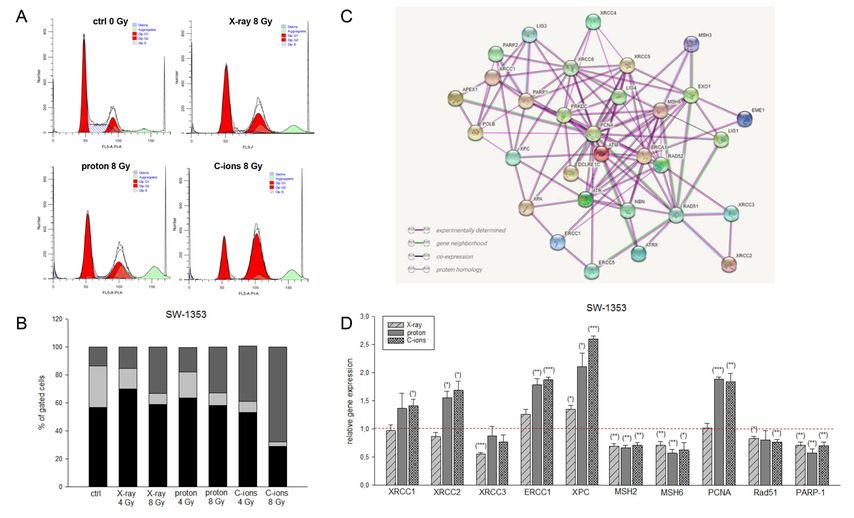
Um unser Verständnis der grundlegenden zellulären Strahlenreaktion als Funktion der Dosis und des linearen Energietransfers (LET) zu verbessern, haben wir einen neuartigen, wasserphantombasierten Aufbau für Zellkulturexperimente entwickelt und dosimetrisch charakterisiert. In einem direkten Vergleich wurden menschliche Chondrosarkom-Zelllinien hinsichtlich ihrer Lebensfähigkeit, der Zellproliferation, des Zellzyklus und des DNA-Reparaturverhalten nach Bestrahlung mit Röntgen-, Protonen- und Kohlenstoffionen analysiert. Unsere Ergebnisse zeigten deutlich, dass die Lebensfähigkeit und Proliferation der Zellen mit zunehmender Ionisationsdichte, d.h. LET, der Bestrahlungsarten gehemmt wurden. Außerdem wurde eine ausgeprägte G2/M-Arretierung festgestellt (Abb. 3A/B). Die Erstellung von Genexpressionsprofilen belegte die Hochregulierung der Seneszenzgene CDKN1A (p21), CDKN2A (p16NK4a), BMI1 und FOXO4 nach einer Partikelbestrahlung. Sowohl die Protonen- als auch die Kohlenstoffionen-Bestrahlung führte zu einer positiven Regulierung der DNA-Reparaturgene ATM, NBN, ATXR und XPC und zu einem hochsignifikanten Anstieg der Expression von XRCC1/2/3, ERCC1, XPC und PCNA, wobei die Kohlenstoffionen offenbar die DNA-Reparaturmechanismen effektiver aktivieren (Abb.3C/D).11
Abb. 3: Zelluläre und molekulare Modifikationen nach Partikelbestrahlung. A) Repräsentative Zellzyklusmessungen mittels Durchflusszytometrie. Es kommt zu einer deutlichen Arretierung der Chondrosarkomzellen in der G2/M-Phase. B) Verteilung der Zellzyklusphasen mit und ohne Bestrahlung. C)Netzwerkdarstellung der wichtigsten DNA-Reparaturgene. D) Genexpressionsanalysen wichtigster DNA-Reparaturgene nach Bestrahlung mit Photonen, Protonen und Kohlenstoffionen
Die Verbindung zwischen den physikalischen Daten und den zellulären Reaktionen ist ein wichtiger Beitrag zur Verbesserung des Behandlungssystems.
Literatur:
1 The WHO Classification of Tumours Editorial Board: WHO Classification of tumours – soft tissue and bone tumors. 5th ed. Lyon: IARC Press; 2020 2 Guan X et al.: The preliminary results of proton and carbon ion therapy for chordoma and chondrosarcoma of the skull base and cervical spine. Radiat Oncol 2019; 14(1): 206 3 Cuccia F et al.: Outcome and toxicity of carbon ion radiotherapy for axial bone and soft tissue sarcomas. Anticancer Res 2020; 40(5): 2853-9 4 Riva G et al.: Particle radiotherapy for skull base chondrosarcoma: a clinical series from Italian National Center for Oncological Hadrontherapy. Cancers (Basel) 2021; 13(17): 4423 5 Hwang EJ et al.: Particle therapy toxicity outcomes: a systematic review. Med Imaging Radiat Oncol 2020; 64(5): 725-37 6 Hwang EJ et al.: Particle therapy tumour outcomes: an updated systematic review. Med Imaging Radiat Oncol 2020; 64(5): 711-24 7 Durante M et al.: Report of a National Cancer Institute special panel: characterization of the physical parameters of particle beams for biological research. Med Phys 2019; 46(2): e37-e52 8 Kuess P et al.: Lateral response heterogeneity of Bragg peak ionization chambers for narrow-beam photon and proton dosimetry. Phys Med Biol 2017; 62(24): 9189-206 9 Lohberger B et al.: Activation of efficient DNA repair mechanisms after photon and proton irradiation of human chondrosarcoma cells. Sci Rep 2021; 11(1): 24116 10 Lohberger B et al.: Effects of a combined therapy of bortezomib and ionizing radiation on chondrosarcoma three-dimensional spheroid cultures. Oncol Lett 2021; 21(6): 428 11 Lohberger B et al.: Cellular and molecular biological alterations after photon, proton, and carbon ions irradiation in human chondrosarcoma cells linked with high quality physics data. Int J Mol Sci 2022; 23:11464
Das könnte Sie auch interessieren:
Angeborene Fehlstellungen des Unterschenkels
Kongenitale Deformitäten des Unterschenkels gehören zu den seltenen, aber medizinisch bedeutenden und operativ herausfordernden Diagnosen der Kinderorthopädie. Eine differenzierte ...
Einzeitiger und mehrzeitiger septischer Endoprothesenwechsel
Die periprothetische Infektion (PPI) stellt eine der gefürchtetsten Komplikationen im Bereich der Orthopädie und Traumatologie dar. Sie ist verbunden mit hohen Morbiditäts- und ...
Hochgradige ACG-Luxationen – wann konservativ behandeln, wann nicht?
Verletzungen des Akromioklavikulargelenks (ACG) gehören zu den häufigsten Schulterverletzungen bei jungen und aktiven Menschen, insbesondere auch aufgrund der zunehmenden Beliebtheit von ...