Osteomyelitis beim Kind
Autoren:
Dr. Martina Blocher
Dr. Franz Landauer
Universitätsklinik für Orthopädie und Traumatologie, Paracelsus Medizinische Privatuniversität Salzburg
E-Mail: m.blocher@salk.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Osteomyelitis im Kindesalter war bisher in Industrieländern mit einer Inzidenz von 8 pro 100 000 Kindern pro Jahr eher selten, sie ist jedoch steigend.1 Global gesehen ist sie mit 43–80 pro 100 000 Kindern dagegen deutlich höher.2 Übersehen bzw. un- oder untertherapiert kann sie schwerwiegende Folgen für die jungen Erkrankten haben. Aufgrund fehlender groß angelegter, prospektiver, randomisierter Studien sind Diagnostik- und Therapieentscheidungen in vielen Fällen immer noch individuell zu treffen.
Keypoints
-
Rasche Ausschöpfung verfügbarer diagnostischer Möglichkeiten (Labor, Sonografie, Röntgen, MRT etc.)
-
Beachtung möglicher Differenzialdiagnosen
-
Therapiebeginn so rasch wie möglich, um Wachstumsfugenschädigungen und Gelenkdestruktionen zu vermeiden
-
Interdisziplinäres Therapiekonzept unter Berücksichtigung patientenspezifischer individueller Parameter (Fokussuche, Immundefizite etc.)
Einteilung
Grundsätzlich können Osteomyelitiden beim Kind akute, subakute und chronische Formen annehmen. Die akute Osteomyelitis hat ihren Symptombeginn unter 2 Wochen, die subakute zwischen 2 Wochen und 3 Monaten, die chronische einen Krankheitsverlauf von über 3 Monaten.1,3 Für sämtliche Stadien gibt es aber auch Sonderformen. Die akute Form kann uni- oder multifokal auftreten. Chronische Stadien können sich aus akuten Krankheitsverläufen entwickeln, aber auch primär chronisch sein, wie z.B. die Osteomyelitis sclerosans Garré. Eine Sonderform stellt die CRMO (chronisch-rezidivierende multifokale Osteomyelitis) –oder auch CNO (chronische nicht bakterielle Osteomyelitis) genannt–dar, die als entzündliche Erkrankung nicht den infektiösen Osteomyelitiden zuzuordnen ist.4 Schließlich sollen die Bacille-Calmette-Guérin- und die spezifische tuberkulöse Osteomyelitis nicht unerwähnt bleiben, Letztere nimmt in den letzten Jahren gerade bei Kindern mit Migrationshintergrund zu.
Ätiologie
Hauptursache für das Entstehen einer Osteomyelitis ist die hämatogene Streuung. Eine Traumaanamnese liegt in 63% der Fälle vor.2 Die Ursache für die Streuherde bleibt aber oft unbekannt.4 Zu den patientenspezifischen Risikofaktoren zählen eine rezente Infektanamnese (gastrointestinal, respiratorisch, urologisch, kieferchirurgisch), rezente chirurgische Eingriffe, Fremdkörper, Alter unter 5 Jahren und männliches Geschlecht. Buben sind bis zu zweimal häufiger betroffen als Mädchen. Ursache dafür ist wahrscheinlich die erhöhte Inzidenz von Mikrotraumen.2,3 Aber auch ein angeborenes oder erworbenes Immundefizit, wie die Sichelzellanämie oder die Frühgeburtlichkeit, erhöhen das Risiko für eine Entstehung.3
Mikrobiologische Ursache für die akute Osteomyelitis ist zu 70–90% eine Infektion mit Staphylococcus aureus. Meist ist der Erreger Methicillin-sensibel (MSSA), aber die MRSA-Infektionen sind zunehmend. Die Bestimmung des Panton-Valentin-Leukozidins als Toxin des Staphylococcus aureus kann hilfreich sein (sie erhöht die Wahrscheinlichkeit schwerer Verläufe).3 Bei Neugeborenen sind mögliche Erreger auch Streptokokken der Gruppe B und gramnegative Bakterien. Bei den 2- bis 5-Jährigen sind auch Infektionen mit Streptococcus pyogenes und pneumoniae sowie Haemophilus influenzae Typ B zu finden. Rezente Studien zeigen, dass der Nachweis von Kingella kingae bei Kindern unter 3 Jahren mit Osteomyelitiden steigt. Infektionen mit Salmonellen (Abb. 1) sind vor allem bei Kindern mit Sichelzellanämie anzutreffen.1–3 Ein Keimnachweis bei begonnener antibiotischer Therapie vor Probenentnahme gelingt aber nicht immer (Abb. 2).
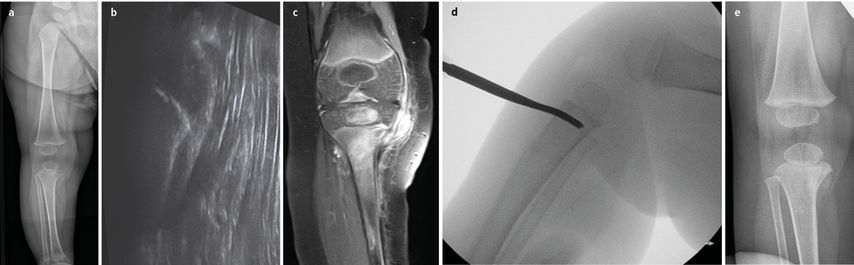
Abb. 1: Ein 1-jähriger Patient wurde aufgrund einer Coxitis fugax antiphlogistisch anbehandelt. Nach 3 Wochen stellte sich der Patient mit einem Streckdefizit von 20° im Bereich des rechten Kniegelenks vor. Das Gelenk war reizlos, ohne Erguss oder Überwärmung. Der Patient war bei Aufnahme schmerzfrei. Die Entzündungsparameter waren im Normbereich. Radiologisch (a) und sonografisch (b) verhärtete sich der Verdacht auf eine Infektion am medialen Tibiaplateau, der sich im MRT (c) bestätigte. Es erfolgten eine Biopsie und Kürettage (d). Der bakteriologische Befund zeigte eine Infektion mit Salmonellen der Gruppe B. Nach der lokalen Herdausräumung konnte das Gelenk zunehmend frei bewegt werden. 3 Monate postoperativ zeigte sich auch der nativ-radiologische Befund deutlich regredient (e)
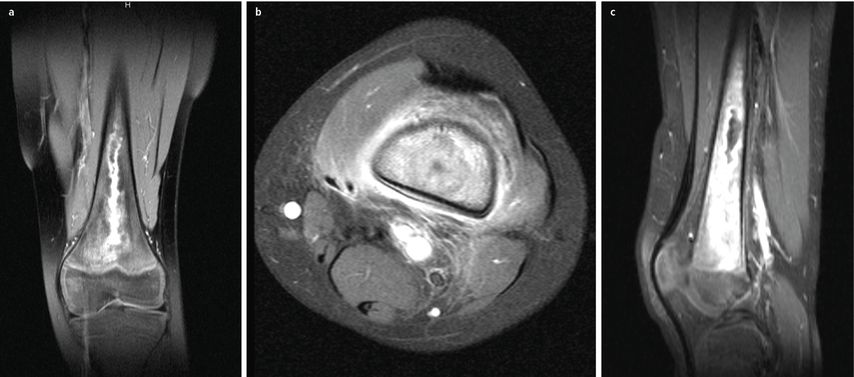
Abb. 2: Ein 9-Jähriger hatte seit 4 Wochen beim Fußballspielen Schmerzen am linken Oberschenkel und leichtes Fieber. Er wurde vom Hausarzt mit homöopathischen Mitteln anbehandelt. Bei Beschwerdepersistenz nach 2 Wochen und nach wie vor leicht erhöhter Temperatur wurde eine Antibiose mit Amoxicillin/Clavulansäure begonnen. Eine Sportkarenz wurde nicht eingeleitet. Es erfolgte dann die auswärtige MRT-Diagnostik. Hier zeigte sich eine Osteomyelitis des distalen Femurs. Daraufhin wurde der Patient 4 Wochen nach Symptombeginn in der Notfallambulanz vorstellig. Nach chirurgischer lokaler Infektausräumung und Probengewinnung wurde eine Antibiose empirisch mit Cefotaxim und Clindamycin parenteral für 2 Wochen gegeben. Ein Keimnachweis gelang nicht. 3 Wochen postoperativ war der Patient beschwerdefrei
Lokalisation
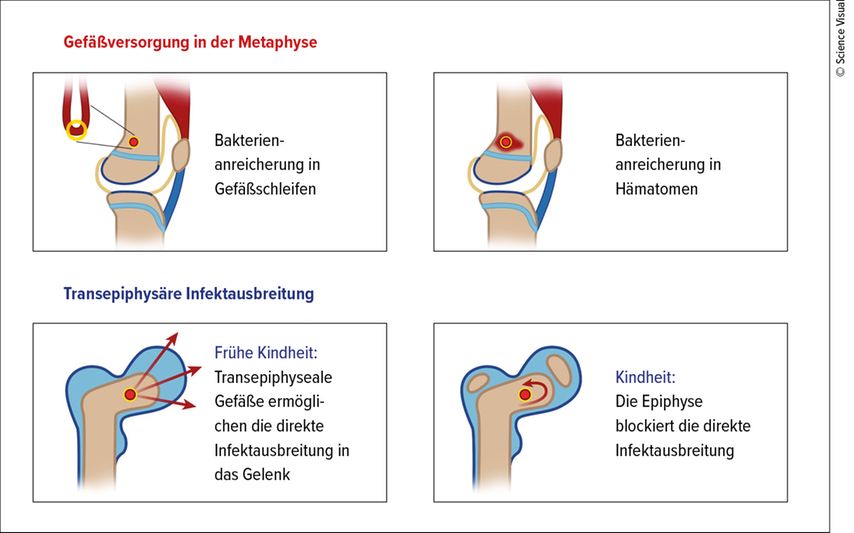
Meist ist die akute Osteomyelitis in den Metaphysen langer Röhrenknochen lokalisiert. Grund dafür ist deren besondere Blutversorgung (Abb. 3). Im Bereich des metaepiphysären Übergangs gehen enge afferente Kapillarschlingen in erweiterte efferente über und begünstigen dadurch die Keimbesiedelung. Bis zum dritten Lebensjahr kreuzen Blutgefäße die Wachstumsfuge, daher kommt es bei Säuglingen und Kleinkindern häufig sekundär auch zur septischen Arthritis. Nach dem dritten Lebensjahr verschwinden die kreuzenden Gefäße und es entsteht eine natürliche Barriere, die eine weitere Infektausbreitung verhindern kann. Femur und Tibia sind mit 27% und 26% am häufigsten betroffen, gefolgt vom Humerus mit 5–13%.3,4
Diagnostik
Eine ausführliche Anamnese stellt die Grundvoraussetzung für die weitere Diagnostik dar. Erste Schritte sind die Erhebung möglicher, bereits genannter Risikofaktoren, gefolgt von einer klinischen Untersuchung.
Bei den akuten Formen der Osteomyelitis ist das Hauptsymptom der Schmerz. Meist zeigen sich aber auch eine Schwellung, Überwärmung und Rötung des betroffenen Gebiets. Fieber und Bewegungseinschränkung sind ebenfalls Leitsymptome. Bei Neugeborenen hingegen sind die Symptome unspezifischer, oft auch ohne Fieber.2,3 Die akute Osteomyelitis sollte bei allen Patienten mit Fieber unklarer Genese und protrahierten Fieberverläufen (über 7–10 Tage) ausgeschlossen werden.1,2 Für die Bildgebung ist primär meist ein Röntgen erforderlich. Bei den akuten Formen ist jedoch zu weniger als 20% eine radiologische Veränderung im konventionellen Übersichtsröntgen ersichtlich.3 Die MRT-Diagnostik hingegen stellt den Goldstandard der weiterführenden Diagnostik dar, gerade in der Frühphase des Krankheitsverlaufs. Auch die Ultraschalluntersuchung kann die Diagnostik unterstützen. Subperiostale Abszesse, aber auch intraartikuläre Ergüsse können sonografisch dargestellt werden.3
Bei den chronischen Formen kann auch die CT-Diagnostik hilfreich sein, um mögliche Pseudarthrosen besser beurteilen zu können. Bei Unsicherheit über mögliche vorliegende tumoröse Veränderungen, aber auch bei Verdacht auf multifokale Läsionen kann das Durchführen einer Szintigrafie sinnvoll sein.
Eine Labordiagnostik mit Abnahme von BB, BSG, CRP und IL-6 ist standardmäßig durchzuführen. Ebenso ist die Abnahme von Blutkulturen zum möglichen Erregernachweis unerlässlich. CRP und BSG haben eine Sensitivität von 98% beim Vorliegen einer akuten Osteomyelitis.3 Regelmäßige Verlaufskontrollen sind notwendig, um den Therapieerfolg zu überwachen. Auch die invasive Diagnostik mittels Punktion bzw. Biposie zur Erregerbestimmung ist in vielen Fällen unumgänglich, vor allem auch für die Materialgewinnung bei negativen Blutkulturen und zur weiterführenden PCR-Diagnostik. Nach der Keimgewinnung ist der Beginn einer Breitbandantibiose wichtig.
Therapie
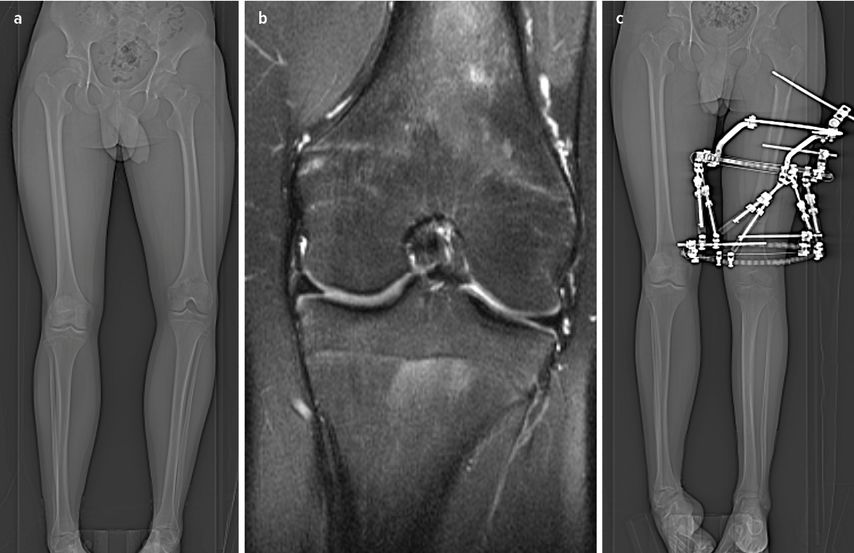
Der Beginn einer Therapie sollte so früh wie möglich und interdisziplinär erfolgen, um langfristig Achsenfehlstellungen, vermindertes Längenwachstum und Gelenkdestruktionen zu vermeiden (Abb. 4).
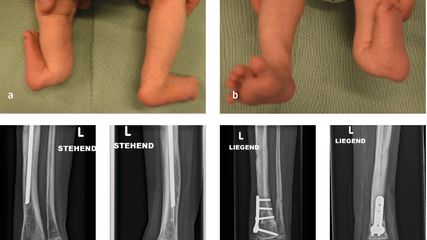
Abb. 4: Achsenabweichung (a) nach Meningokokkensepsis und Gelenkdestruktion (b), Achsenkorrektur und Beinlängenausgleich erfolgte mittels Taylor Spatial Frame (c)
Bei den akuten Formen ist die konservative Therapie mittels parenteraler oder enteraler Antibiose und engmaschiger Laborkontrollen nach wie vor der Goldstandard. Grundsätzlich sollte eine gute Knochengängigkeit der Antibiose in adäquater Dosierung angestrebt werden. Therapie der ersten Wahl bei Infektionen mit MSSA bei Säuglingen unter 3 Monaten sind Cephalosporine der dritten Generation in Kombination mit Oxacillin. Bei geimpften Kindern über 3 Monate sind Oxacillin oder Cefazolin Mittel der ersten Wahl, bei ungeimpften Patienten über 3 Monate Oxacillin und Ceftriaxon. Bei vorliegendem Erregernachweis mit MRSA sind Clindamycin oder Vancomycin empfohlen. Nach Erhalt des Antibiogramms ist die Antibiose dem Erregerspektrum und seiner Sensibilität anzupassen.3
Aufgrund des niedrigen Evidenzgrades vorliegender Studien gibt es nach wie vor keinen internationalen Standard in Hinblick auf Dauer und Art der antibiotischen Therapie. Da jedoch kein signifikanter Unterschied zwischen längerer und kürzerer intravenöser Antibiotikagabe und Outcome bei unkomplizierten Verläufen bestehen dürfte, verkürzt sich die i.v. Zeit zunehmend: 3–4 Tage und im Anschluss eine orale Antibiose mit einer Gesamttherapiezeit von 3 Wochen dürften ausreichend sein. Voraussetzung für die Oralisierung ist eine stetige Abnahme der Entzündungsparameter (EZP) und klinische Besserung. Bei Absetzen der Antibiose sollten die EZP im Normbereich und der Patient weitestgehend beschwerdefrei sein.
Bei Neugeborenen sollte aufgrund der fehlenden Datenlage eine i.v. Gabe über 4 Wochen erfolgen. Bei Kindern über 3 Monate kann Cefazolin auf Cephalexin oder Cefuroxim umgestellt werden sowie Clindamycin auch oralisiert werden.1–3,5 Bei der subakuten und chronischen Form der Osteomyelitis ist eine i.v. Gabe von 4–6 Wochen aufgrund der Revaskularisierung 3–4 Wochen nach chirurgischen Interventionen mit einer Gesamtdauer von 3–6 Monaten je nach individuellem Verlauf empfohlen.6
Die chirurgische Intervention ist eine Domäne chronischer und protrahierter akuter Verläufe. Sobald eine lokal fortschreitende Infektion vorliegt oder auch radiologische Veränderungen wie Sequester bzw. Gelenksbeteiligungen oder Abszesse auftreten, ist eine chirurgische Sanierung des Infektherdes unumgänglich. Leider kommt es in bis zu 33% der Fälle zu Rezidiveingriffen. MRSA-Infektionen erhöhen das Risiko dafür.1,2
Auch die hyperbare Sauerstofftherapie kann in ausgewählten Fällen zur Anwendung kommen. Ruhigstellung betroffener Extremitäten ist je nach Befund optional.
Sonderform CRMO/CNO
Die CRMO oder auch CNO genannt, stellt eine Sonderform der abakteriellen Osteomyelitis dar. Die genaue Pathogenese der CNO ist noch nicht geklärt, proinflammatorische Zytokine, wie IL-6, IL-1β und IL-10 spielen bei der Inflammation möglicherweise eine Rolle. Auch genetische Ursachen der Autoinflammation werden postuliert. Die CNO kommt gehäuft in den Metaphysen der unteren Extremität, dem Becken und der Klavikula vor (Abb. 5). Auch die Wirbelsäule ist nicht selten betroffen. Je nach Ort des Geschehens steht meist der Schmerz im Vordergrund. Aber auch ein generalisiertes Krankheitsempfinden mit Fieber kann auftreten. Die Diagnosestellung erfolgt im Sinne einer Ausschlussdiagnostik. Eine Bakteriämie, aber auch maligne Veränderungen müssen ausgeschlossen werden. Auch hier ist die MRT-Diagnostik Mittel der Wahl nach einem Standardröntgen. Auch die Skelettszintigrafie zur Lokalisation multipler Herde hat ihren Stellenwert. Die invasive Diagnosesicherung erfolgt in den meisten Fällen mit einer Biopsie, vor allem bei monofokalen Läsionen. Grundsätzlich wird die CNO primär mit NSAR anbehandelt. Bei fehlender Besserung sind Bisphosphonate und TNF-α-Blocker, aber auch Cortison mögliche Therapieoptionen.7,8
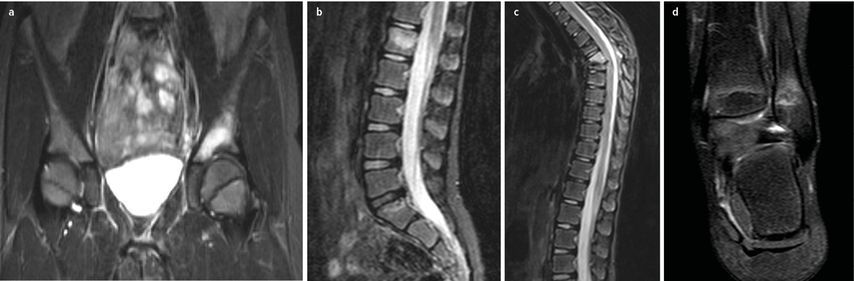
Abb. 5: 7-jährige Patientin mit Schmerzen im Bereich der Brust- und Lendenwirbelsäule sowie im linken Sprunggelenk, ohne Trauma, seit 1 Monat, negative Infektanamnese, internistische Abklärung über die Kinderrheumatologie unauffällig, radiologisch zeigen sich multifokale Läsionen im Bereich des Acetabulums links (a), LWK I (b), BWK 6/7 mit Gibbusbildung (c) und Außenknöchel links (d), interdisziplinär wurde die Diagnose CRMO gestellt
Differenzialdiagnosen
Akute Verletzungen, wie Frakturen, Osteonekrosen, Osteochondrosen, aber auch benigne und maligne Tumoren zählen zu den häufigsten Differenzialdiagnosen der Osteomyelitis. Infektionen können auch nur den Weichteilmantel betreffen, ohne Beteiligung von Knochen oder Gelenken, aber auch seltene Erkrankungen, wie die Mukopolysaccharidose (Abb. 6) oder die Hämochromatose mit Knochen- bzw. Gelenkdestruktionen können das Bild einer Osteomyelitis imitieren.3
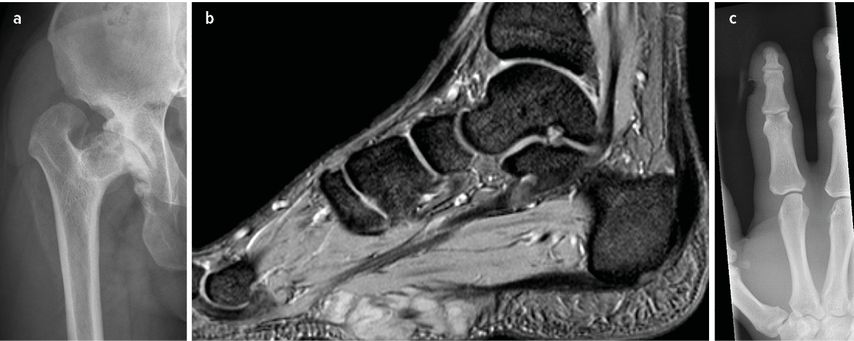
Abb. 6: Ein 18-jähriger Patient präsentiert sich mit Schmerzen in der rechten Hüfte und ausgeprägter Bewegungseinschränkung. Beinlängendifferenz von 3 cm im Vergleich zur linken Seite. Laut begleitender Mutter hatte der Patient eine Säuglingsosteomyelitis der rechten Hüfte (a). Weiters zeigen sich ein Morbus Ledderhose (b) und auffällig plumpe Langfinger (c). In der weiterführenden radiologischen Diagnostik konnten weitere epiphysär-dysplastische Veränderungen festgestellt werden. Die genetische Abklärung ergab eine Mukopolysaccharidose Typ I. Eine Enzymersatztherapie mit Laronidase wurde begonnen
Literatur:
1 Peltola H, Pääkkönen M: Acute osteomyelitis in children, N Engl J Med 2014, 370(4): 352-60 2 Gornitzky AL et al.: Diagnosis and management of osteomyelitis in children: acritical analysis. JBJS Rev 2020; 8(6): e19.00202 3 Congedi S et al.: Acute infectious osteomyelitis in children: new tratment strategies for an old enemy. World J Pediatr 2020; 16(5): 446-55 4 Hefti F.: Kinderorthopädie in der Praxis. 3. Auflage, Berlin/Heidelberg: Springer, 2015 5 Howard-Jones AR, Isaacs D: Systematic review of duration and choice of systemic antibiotic therapy for acute haematogenous bacterial osteomyelitis in children. J Paediatr Child Health 2013; 49(9): 760-8 6 Howard-Jones AR, Isaacs D: Systematic review of systemic antibiotic treatment for children with chronic and sub-acute pyogenic osteomyelitis. J Paediatr Child Health 2010; 46(12): 736-41 7 Taddio A et al.: Dealing with chronic non-bacterial osteomyelitis: a practical approach. Pediatr Rheumatol Online J 2017; 15(1): 87 8 Hofmann S et al.: Chronic recurrent multifocal osteomyelitis (CRMO): presentation, pathogenesis, and treatment. Curr Osteoporos Rep 2017; 15(6): 542-54 9 Gigante A et al.: Acute osteomyelitis and septic arthritis in children: a systematic review of systematic reviews. Eur Rev Med Pharmacol Sci 2019; 23(2 Suppl): 145-58
Das könnte Sie auch interessieren:
Angeborene Fehlstellungen des Unterschenkels
Kongenitale Deformitäten des Unterschenkels gehören zu den seltenen, aber medizinisch bedeutenden und operativ herausfordernden Diagnosen der Kinderorthopädie. Eine differenzierte ...
Einzeitiger und mehrzeitiger septischer Endoprothesenwechsel
Die periprothetische Infektion (PPI) stellt eine der gefürchtetsten Komplikationen im Bereich der Orthopädie und Traumatologie dar. Sie ist verbunden mit hohen Morbiditäts- und ...
Hochgradige ACG-Luxationen – wann konservativ behandeln, wann nicht?
Verletzungen des Akromioklavikulargelenks (ACG) gehören zu den häufigsten Schulterverletzungen bei jungen und aktiven Menschen, insbesondere auch aufgrund der zunehmenden Beliebtheit von ...