Mesenchymale (Stamm-)Zellen: Zukunft der regenerativen Orthopädie?
Autoren:
Dr. Markus Neubauer, PhD1,2
Assoc. Prof. Dr. Dietmar Dammerer2
Univ.-Prof. Dr. Stefan Nehrer1,2
1 Zentrum für Regenerative Medizin
Donau-Universität Krems
2 Karl Landsteiner Privatuniversität für Gesundheitswissenschaften, Abteilung für Orthopädie und Traumatologie, Universitätsklinikum Krems
E-Mail: stefan.nehrer@donau-uni.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mesenchymale (Stamm-)Zellen („mesenchymal stem cells“, MSCs) sind eine vielversprechende Therapieoption in der Orthopädie und Traumatologie. Die Indikationen reichen von Knorpelläsionen und manifester Arthrose bis zu Muskelverletzungen und darüber hinaus. Die klinische Evidenz ist bei vielen dieser Indikationen gering. Dennoch konnte bei einigen Indikationen – wie BMAC in Kombination mit Scaffolds bei Knorpelläsionen – bereits ein moderater „body of evidence“ aufgebaut werden. Die Heterogenität von Produkten, Zellquellen, Prozessierungen etc. macht die wissenschaftliche Vergleichbarkeit von Methoden oft herausfordernd.
Let’s change Ortho Care together!
Die regenerative Orthopädie und Traumatologie hat das Potenzial, ein chirurgielastiges Fach von einem reparativen-replatzierenden Fokus hin zu einem regenerativen-präventiven zu disruptieren. Dies erfordertein Umdenken von einer „Restitutio ad Optimum“ („so gut, wie es geht“) hin zu einer „Restitutio ad Integrum“ („zurück zur Unversehrtheit“). Dieses Neudenken des zugrunde liegenden Heilverständnisses ist eine zentrale Herausforderung in der Translation regenerativer Medizin.
MSCs als Therapeutikum sind in der regenerativen Orthopädie und Traumatologie eine zentrale Behandlungsoption bei unterschiedlichsten Indikationen wie Arthrose, Knorpelregeneration, Muskelverletzungen u.v.m. Ziel dieses Artikels ist, 1) eine Einführung zum Thema mit Hintergründen zu postulierten Wirkmechanismen zu geben, 2) klinische Evidenz für wichtige Anwendungen zu beleuchten und 3) zu versuchen, die Relevanz des Themas für die regenative Orthopädie in toto zu beleuchten.
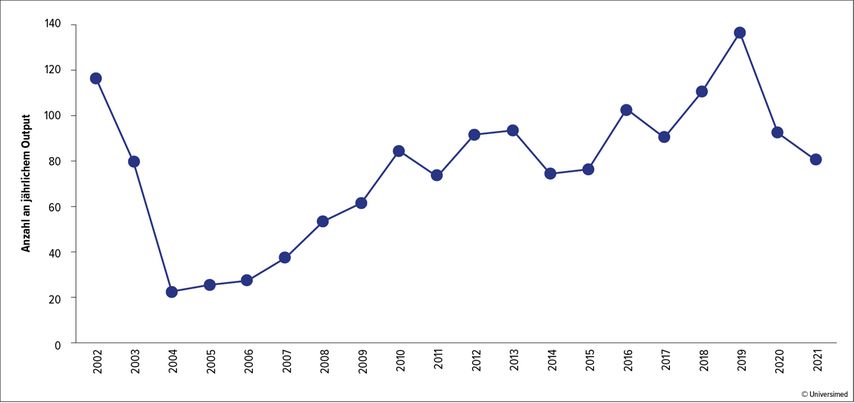
Ein in den frühen 2000er-Jahren abgeflachter „Hype“ hat sich besonders in der vergangenen Dekade zu einem kontinuierlichen Trend entwickelt. Dieser Trend spiegelt sich auch im weltweiten Output an Publikationen zum Thema wider, wie in bibliografischen Studien dargestellt werden konnte (Abb.1).
Historie und Nomenklatur
Der Begriff „Stammzelltherapie“ wurde besonders in der vergangenen Dekade inflationär und unscharf begrenzt benutzt. Dieser Fehlgebrauch hat in Summe zu einigen negativen Konnotationen geführt.2 Caplan et al. waren in den frühen 1990er-Jahren die Namensgeber.3 Die damalige Entdeckung, dass adulte MSCs im Gegensatz zu embryonalen Stammzellen existieren, die weiterhin das Potenzial haben, sich in verschiedene Zelltypen wie Adipozyten, Chondrozyten und Osteozyten (neben anderen) differenzieren zu können, war Grund für die Namensgebung.4 Zudem war sie Grund für diverse Hoffnungen auf therapeutische Einsatzmöglichkeiten insbesondere im Tissue-Engineering.
Nachdem die Biologie dieser Zellen über die nachfolgenden Jahre besser untersucht worden war, hat Caplan 2017 selbst eine Namensänderung vorgeschlagen.5 Zu der ursprünglichen Idee, dass MSCs primär aufgrund ihres Differenzierungspotenzials therapeutisch einsetzbar werden, zeigte sich, dass ebenso ihre parakrinen Faktoren Einfluss auf das sie umgebende Gewebe nehmen. Es konnte zwischenzeitlich gezeigt werden, dass MSCs beispielsweise immun- und apoptosemodulierend wirken.6 Vermittler dieser Effekte sind Botenstoffe wie diverse Wachstumsfaktoren, aber auch extrazelluläre Vesikel (EVs). Diese dienen vor allem einem Cargo-Mechanismus, bei dem auch nichtwasserlösliche Stoffe innerhalb der Vesikel transportiert werden können. Zu den prominentesten Frachten zählen diverse Micro-RNAs, die ihrerseits in den Targetzellen Wirkungen triggern können. Dieses komplexe „Reaktom“-Muster von EVs wurde bei autologen Blutprodukten an der Donau-Universität von Otahal et al. publiziert.7 Dabei zeigt sich, dass die Gesamtheit einer – eventuell auch klinisch – messbaren Wirkung durch eine Vielzahl einzelner ausgelöster Signalwege zustande kommt – per se eine Netzwerkwirkung.
EVs – insbesondere auch aus MSCs – könnten eine entscheidende Grundlage für zellfreie regenerative Medizin bilden. Eine mögliche Zukunftsvariante sind GMP(„good manufacturing practice“)-Einrichtungen, in denen EVs von MSC-Banken für therapeutische Zwecke geerntet werden können.
Wegen dieser parakrinen Faktoren trat die ursprüngliche Idee, dass vor allem das Einwandern von MSCs in den Defekt und die dortige Differenzierung der Zellen zum Zielgewebe („Engrafting“) die Heilung fördern, etwas in den Hintergrund. Jedoch muss zwischen den Indikationen für die Anwendung der MSCs unterschieden werden. Eine osteochondrale Läsion beispielsweise braucht, wenn eine zellbasierte Therapie indiziert ist, eher Zellmaterial in Kombination mit Scaffolds wie bei der autologen Chondrozytentransplantation. Ob MSCs in solchen Fällen zu vergleichbaren Ergebnissen wie die autologe Chondrozytentransplantation führen, bleibt in vielen Fällen noch unklar. In diesen Fällen könnte jedoch die ursprüngliche Theorie der Differenzierbarkeit der Zellen als therapeutischer Mechanismus eine Rolle spielen. Eine wichtige Frage dabei bleibt derzeit nur teilweise beantwortet: Können allogene Zellen ebenso gut in „host tissue“ integrieren wie autologe Zellen? Und im Falle autologer Zellen: Welche Rolle spielt das exakte Quellgewebe? Dieser Frage ist weiter unten ein kurzer Absatz gewidmet.
Bei Indikationen wie Osteoarthrose, bei denen zellbasierte Therapien eher kontraindiziert wären, ist das therapeutische Ziel primär,die Gelenkhomöostase weg von einer inflammatorisch-feindlichen hin zu einer physiologischeren zu bewegen, um den Restknorpel zu stabilisieren. Klassische Knorpelregeneration spielt vor allem bei fortgeschrittener Osteoarthrose keine Rolle! In diesem Fall steht der Wirkmechanismus bezogen auf die parakrinen Faktoren der MSCs im Verdacht, primär orchestrierend zu sein.
MSC-Quellgewebe
MSCs können aus vielen unterschiedlichen Geweben gewonnen werden, wie beispielsweise aus Nabelschnur, Knochenmark, Fettgewebe oder Synovialflüssigkeit.4 Für die Anwendung in der Orthopädie und Traumatologie wird meist das Knochenmark als Quellgewebe verwendet.4 Dieses ist interessant aufgrund der minimalen Zellmanipulation, die notwendig ist,und der Möglichkeit der Point-of-Care-Anwendung.8
In der letzten Dekade drängte sich neben Knochenmark bzw. Knochenmarkaspiraten („Bone Marrow Aspirate Concentrate“, BMAC) zunehmend Fettgewebe als viable MSC-Quelle in die akademische Diskussion. Bestechend dabei war vor allem, dass Fettgewebe in vielen Fällen üppig vorhanden ist und die Entnahmemorbidität im Vergleich zu BMAC (vor allem aus dem Beckenkamm) überschaubarer wirkt.
Darüber hinaus scheint die weitere Sub-klassifikation des Quellgewebes Auswirkungen auf die Zelleigenschaften zu haben. MSCs aus Fettgewebe („adipose-derived“ MSCs = ASCs) haben nicht nur teilweise andere Eigenschaften als MSCs aus BMAC, sondern es gibt auch Unterschiede der biologischen Eigenschaften zwischen den ASCs von Fettgewebe aus unterschiedlichen anatomischen Lokalisationen.
Unterschiede der biologischen Eigenschaften von MSCs
Verschiedene Faktoren beeinflussen die biologischen Eigenschaften von MSCs. Beispielsweise beeinflussen die Schritte in der Bearbeitung bzw. des Prozessierens die Zellen ebenso wie die Entnahmemodalität. Eine Strategie, um potenziell negative Einflüsse auf Zellen auszugleichen oder deren positive Eigenschaften zu unterstützen, ist deren Kombination mit Blutprodukten wie plättchenreichem Plasma. Dieses Konzept wurde seit ca. 2011 bereits in klinischen Studien verfolgt.9,10 Das Rationale war dabei, dass in Laborstudien gezeigt werden konnte, dass Blutprodukte die Differenzierungsfähigkeit sowie die Viabilität von MSCs beeinflussen können.11,12
Ein anderer zentraler Faktor ist die Wahl des Ursprungsgewebes. Beispielsweise hat sich gezeigt, dass ASCs, die aus Fettgewebe des Hoffa-Fettkörpers stammen, ein deutlich höheres chondrogenes Differenzierungspotenzial aufweisen als jene aus subkutanem Fettgewebe, obwohl beide Quellgewebe per se Fett sind.13–15 Offensichtlich haben das Mikroenvironment und die anatomische Nische, in der sich histologisch gleiches oder ähnliches Gewebe befindet, einen entscheidenden Einfluss auf die Biologie der darin enthaltenen Zellen. Dieser Einfluss steht auch im Verdacht, klinisch-therapeutisch relevant zu sein.
Weitere die Biologie beeinflussende Faktoren sind die oben angesprochene Prozessierung der Zellen und ihre Anwendungsarten. Ähnlich wie bei Blutprodukten existiert im Bereich der MSCs eine große Heterogenität bezogen auf die Prozessierungsprotokolle und die daraus resultierenden Produkte. Wenn ASCs beschrieben werden, ist oft die Stromal Vascular Fraction (SVF) gemeint. In diesem Fall wird meist Kollagenase für die enzymatische Verdauung zugesetzt und nachher wieder entfernt.16,17 Diese SVF enthält neben ASCs eine große Anzahl an Zelltypen, wie unter anderem Fibroblasten oder weiße Blutkörperchen. Auch die Enzymzugabe beeinflusst die Biologie der zu applizierenden Zellen.16,17 Manche kommerziell erhältlichen Systeme hingegen verwenden eine rein mechanische Disruption von Fettgewebe, etwa mit Metallkügelchen.
Auch die Viabilität von Zellen ist bedeutend. Zellen, die ihre Viabilität verlieren, verlieren ihr regeneratives Potenzial. Beispielsweise ist die Zellexposition mit Kortikosteroiden ein negativer Einflussfaktor. Kortikosteroide reduzieren die Überlebensfähigkeit von MSCs, während Hyaluron den gegenteiligen Effekt hat.18,19 Ebenso muss bedacht werden, dass Lokalanästhetika, die meist an der Harvest-Stelle (bzw. am Beckenkamm oder bei der Entnahme von Fett ebendort) appliziert werden, einen negativen Effekt auf die Zellviabilität haben.
Dem stehtgegenüber, dass viele autologe MSC-Anwendungen in einem Point-of-Care-Setting verwendet werden können, also am Ort der Entnahme wie dem OP direkt angewandt werden. Damit ist das Fenster für Ex-vivo-Zellmanipulationen deutlich kleiner als bei biotechnologischer Aufarbeitung von Zellen.
Auch konnte am Zentrum für Regenerative Medizin in Krems gezeigt werden, dass eine Kombination mit Blutprodukten, die ebenso in einem Point-of-Care-Setting Anwendung finden, vorteilhafte Effekte auf die Viabilität von MSCs hat, was denNutzen einer Kombination unterstreicht.12
Die Bedeutung der MSC-Zellzahl
Der Anteil an MSCs in Knochenmarkaspiraten rangiert in sehr geringen Prozentsätzen von 0,01–0,02%.20Vor dem Hintergrund solcher Zahlen drängt sich der Gedanke auf, dass der klinische Effekt mit der Anzahl der angewandten Zellen korreliert. Die Ergebnisse einer Arbeit von Jo et al. unterstützen diesen intuitiven Schluss. Die Forschergruppe injizierte drei unterschiedliche Zelldosen in Knie mit Arthrose, beginnend bei 10×106 über 50×106bis zu 100×106 Zellen. Höhere Zelldosen brachten signifikant bessere klinische Ergebnisse.21 Eine weitere Untersuchung zwei Jahre später zeigte ebenfalls, dass die positiven klinischen Effekte signifikant stärker in der Gruppe mit der höchsten Dosis waren.
Dem stehen jedoch kontraintuitive Untersuchungen wie die von Pers et al. gegenüber. Diese zeigten im Jahr 2016, dass autologe ASCs mit geringen Dosen von 2×106als einzige Gruppe zu signifikanten Verbesserungen der klinischen Ergebnisse führten – anders als die beiden Gruppen mit höheren Zellzahlen von 10×106 und 50×106 Zellen.22 Somit ist nicht klar, welche Zellzahl – relativ oder absolut – anzustreben ist.
Klinische Anwendungen von MSCs
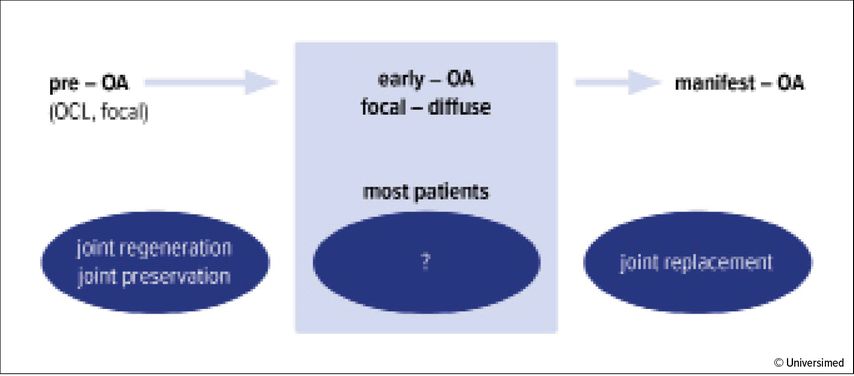
Es existieren unterschiedliche Indikationen für die Anwendung von MSCs in der Orthopädie und Traumatologie. Prominent zu erwähnen sind die Arthrose, wobei das Kniegelenk am meisten untersucht ist, sowie Knorpelläsionen, bei denen eine teilweise moderate Evidenz durch klinische Studien besteht. Die Genese von fokalen Knorpelschäden hin zur manifesten Arthrose kann in einen Zusammenhang gesetzt werden. Erwähnenswert dabei ist, dass eine „Zwischenentität“, die frühe Arthrose (early OA), zunehmend in den Fokus rückt. MSCs scheinen in der Regeneration von Knorpel, also bei fokalen Knorpelläsionen, eine Rolle zu spielen, jedoch ebenso bei frühen (und späteren) Arthroseformen. Abbildung 2 gibt dazu einen Überblick.
Bei genauerer Betrachtung des Studiendesigns fällt oft auf, dass die Begriffsabgrenzung zwischen Knorpelläsionen, (Früh-)Arthrose und manifester Arthrose oft unscharf verwendet wird. Dieser Umstand trägt neben den oben erwähnten Gründen weiter zur Heterogenität der Anwendungen bei.
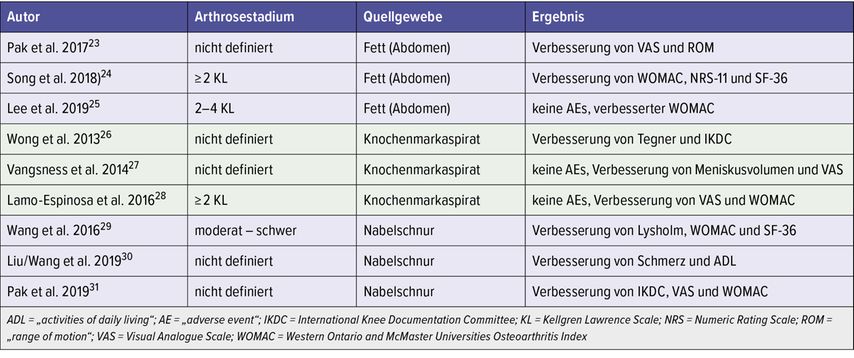
Tabelle 1 gibt einen Überblick über klinische Studien, bei denen MSCs für Arthrose angewandt wurden, wobei eine zusätzliche Gliederung in die drei Quellgewebe (Fett, Knochenmark, Nabelschnur) in dieser Reihenfolge dargestellt ist.
Tab. 1: Klinische Studien mit der Anwendung von MSCs bei Osteoarthrose; dabei werden jeweils drei Studien von den drei Quellgeweben (Fettgewebe, Knochenmarkaspirat und Nabelschnurblut) vorgestellt
MSCs als eine Zellquelle für die Regeneration von Knorpelläsionen sind ein spannender Ansatz, da sie das Potenzial bieten, Herausforderungen der autologen Chondrozytentransplantation (ACT) zu begegnen, beispielsweise als alleinige Zellalternative, in Kombination mit Chondrozyten oder in erweiterten Anwendungen. Die aktuelle Literatur zeigt, dass MSCs aus verschiedenen Ursprungsgeweben, wie Nabelschnur oder peripherem Blut, mit Knochenmark-MSCs vergleichbar sind, was ihr Potenzial betrifft, Knorpelläsionen zu regenerieren.32 So konnte etwa von Koga et al. in einem Tiermodell gezeigt werden, dass die Transplantation von synovialen MSCs zu einer Produktion von Knorpelmatrix an der Stelle der Knorpelläsion führte. Auch konnte gezeigt werden, dass MSCs in tieferen Schichten des Defekts eher osteogen differenzierten. Vermutlich spielen die Umgebungsfaktoren wie die mechanische Robustheit eine Rolle bei der Differenzierungslinie, die die MSCs einschlagen.33
Die Rolle von „Tissueresidual“-MSCs in der sehr geringen Heilungstendenz oberflächlicher Knorpelläsionen bzw. auch deren Rolle bei Knorpeldegeneration ist Gegenstand aktueller Diskussionen. Interessant ist, dass die Menge an synovialen MSCs oder auch derer, die wahrscheinlich aus dem Hoffa-Fettkörper stammen, in der Synovialflüssigkeit mit zunehmenden Knorpelläsionen bzw. -degenerationen (Meniskusdegeneration, Ligamentdegeneration etc.) zunimmt.32,34
Aussichten und Herausforderungen in der Anwendung von MSCs
Damit sich regenerative Therapien etablieren können, sind neben den diskutierten Themen, wie etwa biologische Eigenschaften und klinische Anwendbarkeit, auch ethische Fragen und gesetzliche Vorschriften auf dem Weg zur Anwendungentscheidend. Ein breiter Konsens in der orthopädischen Gemeinschaft besteht darin, dass MSC-Applikationen sicher sind. Teratomformationen oder Ähnliches spielen keine Rolle. Dies ist ein bedeutender Unterschied zu embryonalen Stammzellen.35
Regulierungen und der juristische Rahmen spielen sowohl bei der Richtung, in die geforscht wird, als auch bei der Anwendung von Therapien eine Rolle.So ist das Quellgewebe der Zellen bedeutend. Ein Fokus liegt auf der Unterscheidung zwischen gleichartiger und nicht gleichartiger Zellverwendung. Damit wäre etwa eine Transplantation von Zellen von gelenkfernen Geweben in Gelenke nicht erlaubt – was jedoch bei der Transplantation von ASCs aus subkutanem Fettgewebe in Gelenke passiert. Dies wird als „non-homologous use“ bezeichnet.36
Diese Beispiele zeigen die Komplexität der klinischen Translation. Neben der Biologie und Evidenz beeinflussen kulturelle, rechtliche und legistische Bedingungen die Wahrscheinlichkeit der Translation maßgeblich.
Ausblick und Fazit
MSC-Therapien sind eine vielversprechende Strategie in der Behandlung von diversen Erkrankungen des muskuloskelettalen Systems. In einigen Anwendungsbereichen liegen vielversprechende Ergebnisse aus der Grundlagenwissenschaft und in Tiermodellen vor. Diese müssen noch in der klinischen Anwendungsforschung durch randomisierte kontrollierte Studien ihre Wertigkeit in der Praxis zeigen. Die derzeitige Evidenzlage ist in den meisten Bereichen dünn.
Innovation ist entscheidend, um das Potenzial von MSCs zu erschließen und die aufgezeigten Herausforderungen zu meistern. Die Wahrscheinlichkeit klinischer Translation korreliert mit der Menge an Innovation, die auf soliden Daten basiert. Um den komplexen Prozess der Innovation und Translation zu optimieren, hat sich die Gesellschaft für Arthroskopie und Gelenkchirurgie (AGA) entschlossen, ein eigenes Komitee „Innovation und Translation“ unter der Leitung von Univ.-Prof. Dr. Stefan Nehrer zu gründen. Dessen Ziel ist es, durch systematische Maßnahmen wie das Vernetzen von Opinionleadern, Industrie, Wissenschaft, Klinik und Patient*innen in Formaten wie Think-Tanks, Symposien und Ähnlichem disruptive Innovation in der Orthopädie und Traumatologie zu ermöglichen.
Literatur:
1 Deng Z et al.: Research trends of mesenchymal stem cells application in orthopedics: a bibliometric analysis of the past 2 decades. Front Public Health 2022; 10: 3472 2 Warnung vor dubiosen Stammzell-Therapien. https://kurier.at/wissen/wie-die-notlage-von-schwerkranken-ausgenuetzt-wird-warnung-vor-stammzell-therapien/283.878.668 (accessed 26. Feb. 2023) 3 Caplan AI: Mesenchymal stem cells. J Orthop Res 1991; 9: 641-50 4 Stoltz JF et al.: Stem cells and regenerative medicine: myth or reality of the 21th century. Stem Cells Int 2015; 2015: 734731 5 Caplan AI: Mesenchymal stem cells: time to change the name! Stem Cells Transl Med 2017; 6: 1445 6 Barry F, Murphy M: Mesenchymal stem cells in joint disease and repair. Nat Rev Rheumatol 2013; 9: 584-94 7 Otahal A et al.: Functional repertoire of EV-associated miRNA profiles after lipoprotein depletion via ultracentrifugation and size exclusion chromatography from autologous blood products. Sci Rep 2021; 11: 5823 8 Neubauer M et al.: Bone-marrow-aspirate-concentrate for chondral defects: surgical techniques, clinical applications and basic science. Ann Jt 2018; 3: 107 9 Pak J: Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose-tissue-derived stem cells: a case series. J Med Case Rep 2011; 5: 296 10 Pak J et al.: Cartilage regeneration in humans with adipose tissue-derived stem cells and adipose stromal vascular fraction cells: updated status. Int J Mol Sci 2018; 19(7): 2146 11 Hart PH et al.: Comparison of the suppressive effects of interleukin-10 and interleukin-4 on synovial fluid macrophages and blood monocytes from patients with inflammatory arthritis. Immunology 1995; 84: 536-42 12 Neubauer M et al.: The effect of blood-derived products on the chondrogenic and osteogenic differentiation potential of adipose-derived mesenchymal stem cells originated from three different locations. Stem Cells Int 2019; 2019: 1358267 13 Park JS et al.: The promotion of chondrogenesis, osteogenesis, and adipogenesis of human mesenchymal stem cells by multiple growth factors incorporated into nanosphere-coated microspheres. Biomaterials 2011; 32(1): 28-38 14 Mochizuki T et al.: Higher chondrogenic potential of fibrous synovium- and adipose synovium-derived cells compared with subcutaneous fat-derived cells: distinguishing properties of mesenchymal stem cells in humans. Arthritis Rheum 2006; 54: 843-53 15 Wickham MQ et al.: Multipotent stromal cells derived from the infrapatellar fat pad of the knee. Clin Orthop Relat Res 2003; 412: 196-212 16 Zuk PA et al.: Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell 2002; 13: 4279-95 17 Pak J et al.: Regeneration of cartilage in human knee osteoarthritis with autologous adipose tissue-derived stem cells and autologous extracellular matrix. Biores Open Access 2016; 5(1): 192-200 18 Wong TY et al.: Hyaluronan keeps mesenchymal stem cells quiescent and maintains the differentiation potential over time. Aging Cell 2017; 16: 451-60 19 Wyles CC et al.: Differential cytotoxicity of corticosteroids on human mesenchymal stem cells. Clin Orthop Relat Res 2015; 473: 1155-64 20 Hernigou P et al.: Percutaneous autologous bone-marrow grafting for nonunions. Influence of the number and concentration of progenitor cells. J Bone Joint Surg Am 2005; 87: 1430-7 21 Jo CH et al.: Intra-articular injection of mesenchymal stem cells for the treatment of osteoarthritis of the knee: a proof-of-concept clinical trial. Stem Cells 2014; 32: 1254-66 22 Pers Y-M et al.: Adipose mesenchymal stromal cell-based therapy for severe osteoarthritis of the knee: a phase I dose-escalation trial. Stem Cells Transl Med 2016; 5(7): 847-56 23 Pak J et al.: Efficacy of autologous adipose tissue-derived stem cells with extracellular matrix and hyaluronic acid on human hip osteoarthritis. Biomed Res 2017; 28(4): 1654-8 24 Song Y et al.: Human adipose-derived mesenchymal stem cells for osteoarthritis: a pilot study with long-term follow-up and repeated injections. Regen Med 2018; 13: 295-307 25 Lee WS et al.: Intra-articular injection of autologous adipose tissue-derived mesenchymal stem cells for the treatment of knee osteoarthritis: a phase IIb, randomized, placebo-controlled clinical trial. Stem Cells Transl Med 2019; 8: 504-11 26 Wong KL et al.: Injectable cultured bone marrow-derived mesenchymal stem cells in varus knees with cartilage defects undergoing high tibial osteotomy: a prospective, randomized controlled clinical trial with 2 years’ follow-up. Arthroscopy 2013; 29(12): 2020-8 27 Vangsness CT et al.: Adult human mesenchymal stem cells delivered via intra-articular injection to the knee following partial medial meniscectomy: a randomized, double-blind, controlled study. J Bone Joint Surg Am 2014; 96: 90-8 28 Lamo-Espinosa JM et al.: Intra-articular injection of two different doses of autologous bone marrow mesenchymal stem cells versus hyaluronic acid in the treatment of knee osteoarthritis: multicenter randomized controlled clinical trial (phase I/II). J Transl Med 2016; 14(1): 246 29 Wang Y et al.: [Curative effect of human umbilical cord mesenchymal stem cells by intra-articular injection for degenerative knee osteoarthritis]. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi 2016; 30(12): 1472-7 30 Wang L et al.: Efficacy and safety of umbilical cord mesenchymal stem cell therapy for rheumatoid arthritis patients: a prospective phase I/II study. Drug Des Devel Ther 2019; 13: 4331-40 31 Pak J-Y: Clinical outcomes of human umbilical cord blood derived mesenchymal stem cells application in knee osteoarthritis patients. Osteoarthritis Cartilage 2019; 27(Suppl 1): S511 32 Broderick JM et al.: Optimizing stem cell engineering for orthopaedic applications. J Am Acad Orthop Surg 2014; 22: 63-5 33 Koga H et al.: Synovial stem cells are regionally specified according to local microenvironments after implantation for cartilage regeneration. Stem Cells 2007; 25: 689-96 34 Matsukura Y et al.:Mesenchymal stem cells in synovial fluid increase after meniscus injury. Clin Orthop Relat Res 2014; 472(5): 1357-64 35 Hernigou P et al.:Cancer risk is not increased in patients treated for orthopaedic diseases with autologous bone marrow cell concentrate. J Bone Joint Surg Am 2013; 95: 2215-21 36 Raposio E, Ciliberti RG: Clinical use of adipose-derived stem cells: European legislative issues. Ann Med Surg 2017; 24: 61-4
Das könnte Sie auch interessieren:
Angeborene Fehlstellungen des Unterschenkels
Kongenitale Deformitäten des Unterschenkels gehören zu den seltenen, aber medizinisch bedeutenden und operativ herausfordernden Diagnosen der Kinderorthopädie. Eine differenzierte ...
Korrektur assoziierter Gelenkspathologien beim kongenitalen Femurdefekt
Der kongenitale Femurdefekt ist eine der spannendsten und komplexesten angeborenen Fehlbildungen in der Kinderorthopädie und in der klinischen Präsentation sehr vielgestaltig. Während ...
Hochgradige ACG-Luxationen – wann konservativ behandeln, wann nicht?
Verletzungen des Akromioklavikulargelenks (ACG) gehören zu den häufigsten Schulterverletzungen bei jungen und aktiven Menschen, insbesondere auch aufgrund der zunehmenden Beliebtheit von ...