Extrazelluläre Vesikel, die Botenstoffe der Regeneration
Autoren:
Alexander Otahal, PhD, MSc
Ass.-Prof. Mag. Andrea De Luna, PhD
Univ.-Prof. Dr. Stefan Nehrer, MSc
Zentrum für Regenerative Medizin Universität für Weiterbildung Krems
Korrespondierender Autor:
Alexander Otahal, PhD, MSc
E-Mail: alexander.otahal@donau-uni.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Extrazelluläre Vesikel sind membranumschlossene biogene Partikel, die von den meisten Zelltypen synthetisiert werden können und als Transferplattform von Signalmolekülen zwischen unterschiedlichen Zelltypen fungieren. Die enthaltenen Moleküle bieten nicht nur eine Erklärung für die Wirkungsweise von bereits angewandten Therapien wie Blutproduktinjektionen oder mesenchymalen Stammzelltherapien, sondern eröffnen auch neue Perspektiven für die klinische Praxis als Botenstoffe der Regeneration.
Keypoints
-
Extrazelluläre Vesikel sind biogene membranumschlossene Nanopartikel.
-
Die meisten Zelltypen können extrazelluläre Vesikel freisetzen.
-
Extrazelluläre Vesikel können molekulare Botschaften übermitteln.
-
Signalmoleküle wie microRNAs regulieren Genexpression in Chondrozyten.
Biogene Nanopartikel
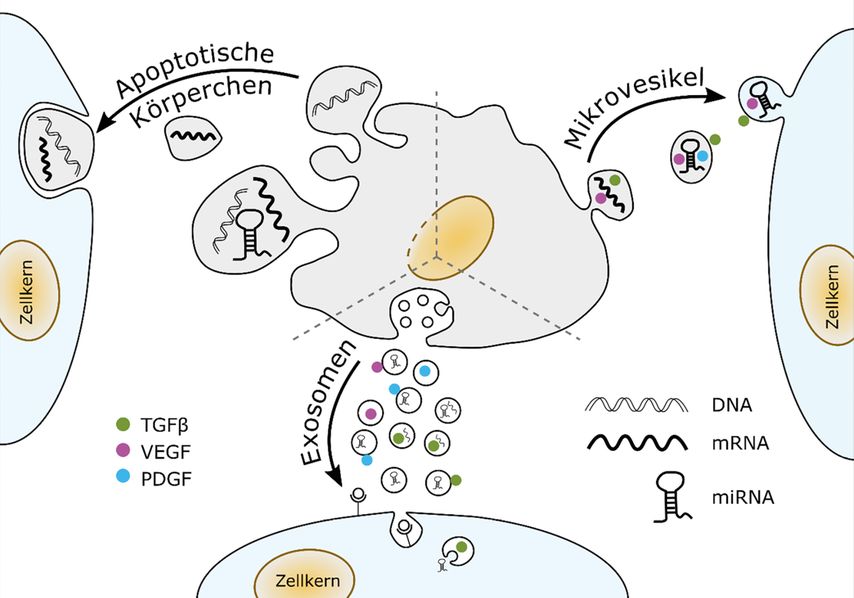
Extrazelluläre Vesikel („extracellular vesicles“, EVs) ist ein Sammelbegriff für membranumschlossene biogene Nanopartikel mit etwa 30–1000 Nanometer Größe. Man unterscheidet verschiedene Kategorien von EVs, abhängig vom Biosyntheseweg in der Zelle. Exosomen werden 30–150nm große EVs genannt, die in intrazellulären Kompartimenten durch intralumenale Abschnürung generiert und durch Fusion der dabei entstehenden multivesikulären Körperchen mit der Plasmamembran freigesetzt werden. Mikrovesikel mit 100–1000nm Größe entstehen durch Abschnürung an der Plasmamembran. Die genannten EV-Kategorien und transportierte Cargos werden von Zielzellen durch Endozytose oder Membranfusion aufgenommen (Abb.1). Apoptotische Zellen können ebenfalls Partikel in diesem Größenbereich oder größer freisetzen, welche als apoptotische Körperchen bezeichnet und phagozytotisch aufgenommen werden.1
Abb. 1: Biosynthesewege von verschiedenen Kategorien extrazellulärer Vesikel, deren Aufnahmerouten und typische Arten von enthaltenen Signalmolekülen, wie verschiedene Sorten von Nukleinsäuren oder Wachstumsfaktor
Molekulare Signalträger
Die meisten Zelltypen, wie zum Beispiel Blutzellen, Endothelzellen, neuronale Zellen, aber auch Bindegewebszellen oder Tumorzellen können EVs produzieren. Deshalb findet man EVs auch in allen Körperflüssigkeiten wie Blut und verschiedenen Blutprodukten, Urin, Milch oder Speichel.1,2 EVs wurden als „platelet dust“ bereits vor Jahrzehnten erstmalig beschrieben, ohne dessen Ursprung oder Mechanismen der Biosynthese zu kennen.3 Erst mit der Entdeckung von EV-assoziierten microRNAs (miRNAs) wandelte sich die Perspektive und die ursprünglich als Abfall bezeichneten Partikel wurden als Träger von Signalmolekülen erkannt.4,5 Dadurch etablierte sich das Konzept von EVs als interzelluläre Botenstoffe oder Signalshuttles, die eine Reihe bioaktiver Moleküle – wie verschiedene Arten von RNA wie miRNA oder mRNA, aber auch DNA, Proteine und spezifische Lipide – zwischen Zellen durch den ganzen Körper transportieren können.1 Dadurch gewannen EVs große Bedeutung in der Forschung und in zunehmendem Maß in einer Vielzahl präklinischer Studien und klinischer Anwendungen.
Nanokosmos von Blutprodukten
Die intraartikuläre Injektion von plasma- oder serumbasierten Blutprodukten ist eine häufig angewandte Behandlung in der Orthopädie und Traumatologie. Dabei kommen meistens autologe Präparate wie autologes konditioniertes Plasma (ACP), autologes konditioniertes Serum (ACS) oder verschiedene plättchenreiche Plasmapräparate wie zum Beispiel Citrat-antikoaguliertes plättchenreiches Plasma (CPRP) zum Einsatz. Die Forschung zu den Wirkungsweisen dieser Produkte fokussierte sich in der Vergangenheit auf enthaltene Wachstumsfaktoren wie PDGF, VEGF oder TGF-β,6–8 aber auch Gehalte von antiinflammatorischen Zytokinen wie IL-1ra.9 Eine neuere Studie legt nahe, dass die EVs in diesen Blutprodukten ausreichend sind, um die Expression von chondrozytenspezifischen Genen wie SOX9 sowie Kollagen Typ II in vitro zu fördern und proinflammatorische Zytokinfreisetzung zu verhindern.2 Es zeigte sich, dass der Großteil der Blut-EVs sowohl in einem plasma- als auch in einem serumbasierten Blutprodukt von Thrombozyten abgeleitet war und die Aktivierung des NF-κB-Signaltransduktionsweges in Chondrozyten, der in der Arthrose eine zentrale Rolle spielt und ein therapeutisches Ziel darstellt,10,11 im Vergleich zum kompletten Blutprodukt effektiv inhibiert werden konnte. In weiterer Folge wurde nach einer mechanistischen Erklärung dieser regenerativen Effekte auf molekularer Ebene gesucht und es wurden Populationen von EV-assoziierten miRNAs identifiziert, die unter anderem gegen mehrere Komponenten des NF-κB-Signaltransduktionsweges und IL-6-Expression gerichtet sind.12
Kooperative Proteinkorona
Regenerative Effekte werden nicht nur durch Faktoren bestimmt, die im Inneren eines EV transportiert werden, sondern auch durch extralumenale Signalmoleküle, wie zum Beispiel Wachstumsfaktoren, die an der Oberfläche von EVs in einer sogenannten Proteinkorona adsorbiert sind. Die Rekonstituierung der Proteinkorona von gereinigten EVs mit Wachstumsfaktoren wie VEGF, IGF und EGF steigerte die regenerativen Eigenschaften, während die gereinigten EVs allein weniger funktional waren.13 Diese Ergebnisse unterstreichen den Charakter von EVs als Transportplattform für unterschiedliche molekulare Botschaften.
Mediatoren der Zelltherapie
Eine stark beforschte Quelle für therapeutische EVs sind mesenchymale Stamm-/Stromazellen (MSCs), die unter anderem aus verschiedenen Geweben wie Knochenmark (BM-MSCs), Nabelschnur (UC-MSCs), aber auch Fettgewebe (AD-MSCs) gewonnen werden können.14 Die Zellen werden extrakorporal in speziellen Medien kultiviert, in welche die MSCs ihre EVs abgeben und aus denen die EVs angereichert werden. MSC-EVs induzieren immunmodulierende und entzündungshemmende Effekte und stabilisieren das Gleichgewicht anaboler und kataboler Prozesse in der Gewebshomöostase, die bei verschiedenen Erkrankungen dereguliert ist. Diese regenerativen Effekte sind möglicherweise spezifisch abhängig vom jeweiligen Ursprung der EVs (Cai et al., 2020). Im Kontext der Arthrose konnte gezeigt werden, dass BM-MSC-EVs die Expression von COX2 und proinflammatorischer Interleukine wie IL-1α, IL-1β, IL-6, IL-8, IL-17 unterdrücken. Durch die BM-MSC-EV-basierte Hemmung von TNF-α-vermittelter Entzündung von Chondrozyten konnte die Expression von Knorpelmatrix-abbauenden Enzymen (Matrixmetalloproteinasen) reduziert werden, was in weiterer Folge die Nettoproduktion von Kollagen Typ II und Proteoglykanen förderte.15 Diese Wirkungen von BM-MSC-EVs könnten durch miRNAs vermittelt werden wie miR-146a, welche den proinflammatorischen NF-κB-Signaltransduktionsweg hemmt und in BM-MSC-EVs transportiert werden kann.16,17
Ein weiterer regenerativer Effekt, der durch UC-MSC-EVs – aber auch andere MSC-EVs – angestoßen werden kann, ist Angiogenese.18,19 Die proangiogenetischen Eigenschaften von MSC-EVs können verstärkt werden, indem MSCs in Kultur Hypoxie ausgesetzt werden, was die Freisetzung einer EV-basierten Gegenantwort stimuliert, um Gefäßneubildung in unterversorgten Geweben zu fördern.20,21
AD-MSC-EVs zeichneten sich durch Verhinderung von Fibrose in verschiedenen Organen bei chronischen Erkrankungen wie diabetischer Nephropathie,22 pulmonarer Fibrose oder Leberzirrhose23 aus. Auch in Studien zur Behandlung chronischer Wunden konnten AD-MSC-EVs erfolgreich eingesetzt werden und durch Wiederherstellung von Gewebshomöostase und Förderung verschiedener Phasen der Wundheilung, wie Regulation von Inflammation, Zellproliferation und Matrixremodelling, die Regeneration fördern.24 Am Beispiel der Behandlung von mit IL-1β stimulierten Chondrozyten und synovialen Zellen mit AD-MSC-EVs in einer In-vitroStudie zeigte sich, dass verschiedene Zelltypen unterschiedlich in Art und Stärke auf eine EV-basierte Therapie reagieren können.25
Integration von Botschaften
Die genauen Wirkmechanismen der EVs und EV-assoziierter Signalmoleküle und deren Beiträge zum therapeutischen Erfolg sind derzeit noch wenig bekannt. Aufgrund der Vielzahl unterschiedlicher Signalmoleküle sind bestimmte Effekte vermutlich nicht mit einer oder wenigen Komponenten erklärbar, da es sich um ein pleiotropes Zusammenspiel von Faktoren handelt. Beispielsweise kann eine Vielzahl unterschiedlicher miRNAs in einer EV-Population enthalten sein. Jede Sorte von miRNA reguliert dabei eine oder mehrere mRNAs in einer Zielzelle, während die Proteintranslation einer Art von mRNA von einer oder mehreren miRNAs beeinflusst werden kann. Dadurch ergibt sich ein hochkomplexes Netzwerk möglicher Regulationsstufen. Dabei könnten synergistische Effekte von Gruppen von miRNAs von essenzieller Bedeutung sein, wenn mehrere Komponenten desselben Signaltransduktionsweges gleichzeitig reguliert werden. Auch wenn die Menge einzelner EV-assoziierter miRNAs für sich allein keinen relevanten Effekt hat, könnten durch dieses Zusammenspiel klinisch relevante Resultate erreicht werden unter gleichzeitiger Vermeidung von Nebeneffekten, die einzelne hochkonzentrierte miRNAs in anderen Zellen des Gewebeverbands mit sich bringen könnten.
Potenzial EV-basierter Therapien
Nichtsdestotrotz sind EVs vermutlich die Basis für die Wirkungsweise von MSC-basierten Zelltherapien, die in der orthopädischen und traumatologischen Praxis angewandt werden.26 Ein Vergleich von BM-MSCs und BM-MSC-EVs erbrachte den Nachweis, dass es ausreicht, BM-MSC-EVs intraartikulär zu injizieren, um Knorpelregeneration in einem Mausmodell zu fördern.27 Da intraartikulär verabreichte MSCs sich selten bis gar nicht in defektes Knorpelgewebe integrieren,28 aber dennoch regenerative Effekte bei dieser Zelltherapie auftreten, bieten MSC-EVs als Boten der Regeneration eine oder die Erklärung für klinisch beobachtbare Effekte. Die Entwicklung rein auf EVs basierter Therapien würde einige Nachteile von Zelltherapien umgehen, welche in möglichen Abstoßungsreaktionen oder unkontrollierter Differenzierung an der Implantationsstelle bestehen, was komplizierte Zulassungsverfahren mit sich bringt. Zusätzlich bieten die Lagerfähigkeit und bessere Standardisierbarkeit weitere Argumente für den Einsatz von EVs in der regenerativen Medizin. Einige Fragen bleiben allerdings noch offen, besonders in Bezug auf die Aufklärung von Wirkungsmechanismen, optimale Applikationsrouten und Dosierung, um EVs als Botenstoffe der Regeneration in der Klinik effektiv anwendbar zu machen.
Literatur:
1 Yáñez-Mó M et al.: Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles 2015; 4: 27066 2 Otahal A et al.: Characterization and chondroprotective effects of extracellular vesicles from plasma- and serum-based autologous blood-derived products for osteoarthritis therapy. Front Bioeng Biotechnol 2020; 8(1114): 584050 3 O’Brien JR: The platelet-like activity of serum. Br J Haematol 1955; 1(2): 223-8 4 Johnstone RM et al.: Exosome formation during maturation of mammalian and avian reticulocytes: evidence that exosome release is a major route for externalization of obsolete membrane proteins. J Cell Physiol 1991; 147(1): 27-36 5Valadi H et al.: Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol 2007; 9(6): 654-9 6 Cavallo C et al.: Platelet-rich plasma: the choice of activation method affects the release of bioactive molecules. Biomed Res Int 2016; 2016: 6591717 7 Klatte-Schulz F et al.: Comparative analysis of different platelet lysates and platelet rich preparations to stimulate tendon cell biology: an in vitro study. Int J Mol Sci 2018; 19(1): 212 8 Amable PR et al.: Platelet-rich plasma preparation for regenerative medicine: optimization and quantification of cytokines and growth factors. Stem Cell Res Ther 2013; 4(3): 67 9 Kardos D et al.: The composition of hyperacute serum and platelet-rich plasma is markedly different despite the similar production method. Int J Mol Sci 2019; 20(3): 721 10 Rigoglou S et al.: The NF-κB signalling pathway in osteoarthritis. Int J Biochem Cell Biol 2013; 45(11): 2580-4 11 Roman-Blas JA et al.: NF-κB as a potential therapeutic target in osteoarthritis and rheumatoid arthritis. Osteoarthritis Cartilage 2006; 14(9): 839-48 12 Otahal A et al.: Functional repertoire of EV-associated miRNA profiles after lipoprotein depletion via ultracentrifugation and size exclusion chromatography from autologous blood products. Sci Rep 2021; 11(1): 5823 13 Wolf M et al.: A functional corona around extracellular vesicles enhances angiogenesis, skin regeneration and immunomodulation. J Extracell Vesicles 2022; 11(4): e12207 14 De Luna A et al.: Mesenchymal stromal cell-derived extracellular vesicles – silver linings for cartilage regeneration? Front Cell Dev Biol 2020; 8: 593386 15 Vonk LA et al.: Mesenchymal stromal/stem cell-derived extracellular vesicles promote human cartilage regeneration in vitro. Theranostics 2018; 8(4): 906-20 16 Wu H et al.: Extracellular vesicles containing miR-146a attenuate experimental colitis by targeting TRAF6 and IRAK1. Int Immunopharmacol 2019, 68: 204-12 17 Mann M et al.: An NF-κB-microRNA regulatory network tunes macrophage inflammatory responses. Nat Commun 2017; 8(1): 851 18 Divband S et al.: Human umbilical cord mesenchymal stem cells-derived small extracellular vesicles can be considered as cell-free therapeutics for angiogenesis promotion. Cell J 2022; 24(11): 689-96 19 Rautiainen S et al.: Angiogenic effects and crosstalk of adipose-derived mesenchymal stem/stromal cells and their extracellular vesicles with endothelial cells. Int J Mol Sci 2021; 22(19): 10890 20 Almeria C et al.: Hypoxia conditioned mesenchymal stem cell-derived extracellular vesicles induce increased vascular tube formation in vitro. Front Bioeng Biotechnol 2019; 7: 292 21 Pulido-Escribano V et al.: Role of hypoxia preconditioning in therapeutic potential of mesenchymal stem-cell-derived extracellular vesicles. World J Stem Cells 2022; 14(7): 453-72 22 Grange C et al.: Stem cell-derived extracellular vesicles inhibit and revert fibrosis progression in a mouse model of diabetic nephropathy. Sci Rep 2019; 9(1): 4468 23 Rong X et al.: Human bone marrow mesenchymal stem cells-derived exosomes alleviate liver fibrosis through the Wnt/β-catenin pathway. Stem Cell Res Ther 2019, 10(1): 98 24 Long C et al.: Therapeutic potential of exosomes from adipose-derived stem cells in chronic wound healing. Front Surg 2022; 9: 1030288 25 Cavallo C et al.: Small extracellular vesicles from adipose derived stromal cells significantly attenuate in vitro the NF-κB dependent inflammatory/catabolic environment of osteoarthritis. Sci Rep 2021; 11(1): 1053 26 Berebichez-Fridman R et al.: The holy grail of orthopedic surgery: mesenchymal stem cells – their current uses and potential applications. Stem Cells Int 2017; 2017: 2638305 27 Cosenza S et al.: Mesenchymal stem cells derived exosomes and microparticles protect cartilage and bone from degradation in osteoarthritis. Sci Rep 2017; 7(1): 16214 28 Satué M et al.: Intra-articularly injected mesenchymal stem cells promote cartilage regeneration, but do not permanently engraft in distant organs. Sci Rep 2019; 9(1): 10153
Das könnte Sie auch interessieren:
Rekonstruktionsmöglichkeiten bei Nervenläsionen
Die Rekonstruktion peripherer Nervenläsionen bleibt eine Herausforderung – besonders bei langen Defektstrecken, verzögerter Diagnostik oder ausgeprägter Denervierung. Der Artikel ...
Nervenkompressionssyndrome an Sprunggelenk und Fuß
Nervenkompressionssyndrome im Bereich des Sprunggelenks sowie des Fußes stellen eine komplexe Herausforderung dar. Nicht selten sind sie schwer zu diagnostizieren und können bei ...
Die geburtstraumatische Plexusläsion
Sowohl bei einer Spontangeburt als auch bei einer Sectio caesarea kann es zu einem Dehnungsschaden des Armnervengeflechts kommen. Die entstehende Läsion kann unter Umständen ...