Ein Einblick in mesenchymale Stromazellen und neue zellfreie Therapien zur Knochenregeneration
Autoren:
Dominik Hanetseder, MSc
Prof. Dr. Heinz Redl
Dr. Darja Marolt Presen
Ludwig Boltzmann Institut für experimentelle und klinische Traumatologie, AUVA Forschungszentrum, Wien
Austrian Cluster for Tissue Regeneration, Wien
Korrespondierende Autorin:
Dr. Darja Marolt Presen
E-Mail:
Darja.Marolt@trauma.lbg.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Zellbasierte Therapien mit adulten mesenchymalen Stromazellen (MSZ) werden derzeit in registrierten klinischen Studien eingesetzt. MSZ werden durch Zellinjektion oder Implantation in Kombination mit Knochenersatzmaterialien eingesetzt. Eine alternative Option ist die Konstruktion und Implantation von MSZ-bioengineertem Gewebe. MSZ-Sekretom und extrazelluläre Vesikel (EV) werden derzeit noch nicht in klinischen Studien eingesetzt, sind aber vielversprechende Kandidaten für zukünftige zellfreie regenerative Therapien. Es sind jedoch weitere Forschungsarbeiten erforderlich, um verschiedene therapeutische Optionen innerhalb spezifischer klinischer Indikationen zu verbessern.
MSZ-basierte Therapien und Knochen-Tissue-Engineering
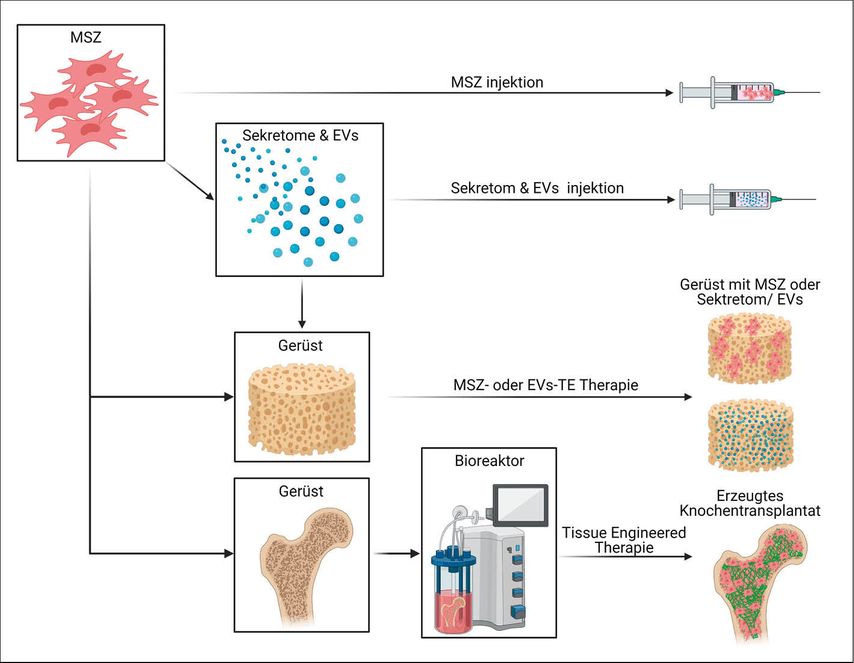
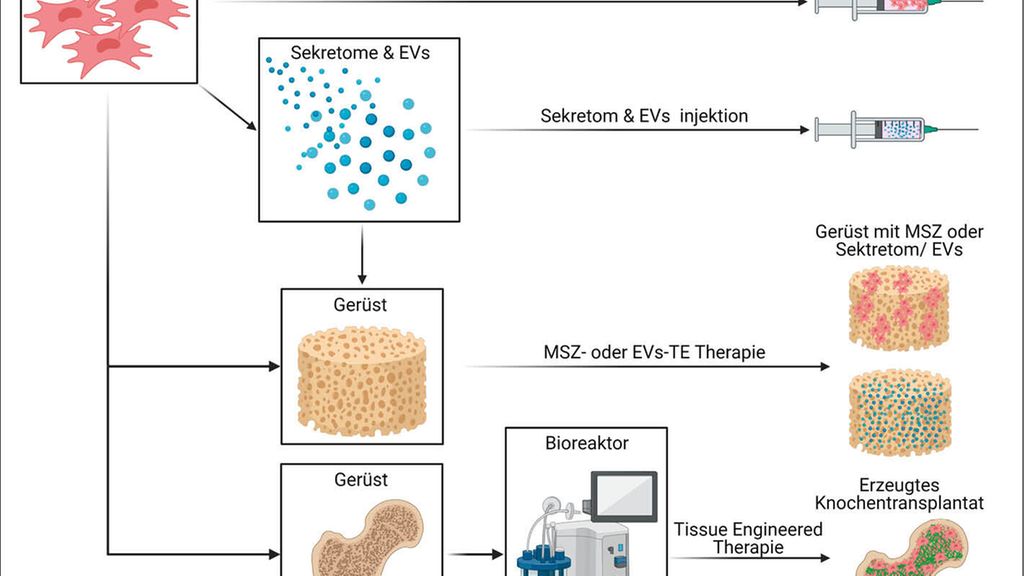
Knochendefekte sind eines der häufigsten Probleme in der orthopädischen und unfallchirurgischen Praxis und ihre Regeneration ist oft eine große Herausforderung.1 Der Standard für die Behandlung ist nach wie vor die autologe Knochentransplantation, bei der das implantierte Material allein oder in Kombination mit Knochenersatzmaterialien verwendet wird, um die Knochenheilung durch Osteogenese, Osteoinduktion und Osteokonduktion zu unterstützen.2 „Fortgeschrittenere“ Ansätze beinhalten zellbasierte Therapien mit adulten mesenchymalen Stromazellen (MSZ), wobei am häufigsten aus Knochenmark und Fettgewebe stammende MSZ verwendet werden (Abb.1).
Abb. 1: MSZ-basierte Therapieoptionen für die Knochenregeneration: MSZ aus Knochenmark/Fett stammend oder deren Sekrete/EVs werden als injizierbare Therapien eingesetzt. Alternativ werden MSZ oder EV zusammen mit biokompatiblen Gerüsten implantiert. Eine „fortgeschrittenere“ Option ist das Erzeugen von lebensfähigen patientenspezifischen Transplantaten in Bioreaktoren zur Behandlung von komplexeren Knochendefekten
Wie kürzlich überprüft wurde, werden in klinischen Studien MSZ durch Injektion oder Implantation in Kombination mit Knochenersatzmaterialien eingesetzt.1 In diesen Studien werden nicht zusammenwachsende Röhrenknochen, Frakturen mit Pseudoarthrose, Kieferknochendefekte und Knochenosteonekrosen behandelt.
Hernigou et al. berichteten, dass die fluoroskopiegesteuerte perkutane Injektion von konzentrierten, autologen, mononukleären Zellen aus dem Knochenmark bei 53 von 60 Patienten zu einer erfolgreichen Knochenvereinigung führte.3 Die Transplantate dieser Patienten enthielten eine signifikant höhere Konzentration an osteogenen Vorläuferzellen im Vergleich zu den 7 Patienten, die keine Knochenvereinigung erreichten.
Gomez-Barrena et al. führten die erste multizentrische europäische Studie mit der Verwendung von MSZ aus dem Knochenmark durch, in Kombination mit biphasischem Kalziumphosphat-Biokeramikgranulat, zur Behandlung von Röhrenknochen mit verzögerten Frakturheilungen und Pseudoarthrosen. Sie fanden die Behandlung sicher und praktikabel und ein Jahr nach der Behandlung wiesen 26 von 28 Patienten eine radiologische Heilung auf.4
Liebergall et al. verwendeten einen prophylaktischen minimal invasiven Eingriff mit der Injektion von magnetisch abgetrennten MSZ aus dem Knochenmark, gemischt mit plättchenreichem Plasma und demineralisierter Knochenmatrix, für distale Tibiafrakturen bei 12 Patienten. Die Behandlung führte in kürzerer Zeit zur Schließung der Frakturen im Vergleich zur Kontrollgruppe mit 12 Patienten, welche mit einer konventionellen Methode zur Heilung der Fraktur behandelt worden waren.5
Castillo-Cardiel et al. berichteten in ähnlicher Weise, dass die Behandlung von Unterkieferfrakturen mit autologen, aus dem Fettgewebe stammenden MSZ (12 Patienten) zu höheren Ossifikationsraten nach 12 Wochen im Vergleich zur Kontrollgruppe ohne Zelltherapie (12 Patienten), führte.6
Allerdings hat sich noch keine dieser zellbasierten Therapien in der Klinik als Standardbehandlung durchgesetzt.7
Ansätze des Knochen-Tissue-Engineering, die sich überwiegend noch in der präklinischen Forschungsphase befinden, umfassen verschiedene Kombinationen von Zellen, Biomaterialgerüsten, Signalfaktoren und Transplantatkultur-/Reifungsverfahren (in vitro und in vivo) in Richtung „funktioneller“ Knochenersatzmaterialien.8,9 Um mehrere Zentimeter großes Gewebe für die Behandlung von Defekten kritischer Größe zu züchten, hat sich die Forschung auf fortschrittliche Technologien zur Gerüstherstellung10 und auf die dynamische Gewebekultur in Bioreaktorsystemen konzentriert.11–15 Der vielversprechendste Ansatz für das Erzeugen von funktionellem, lebensfähigem Knochengewebe aus autologen MSZ sind Perfusionsbioreaktorsysteme, die den interstitiellen Fluss des Kulturmediums durch zellbesiedelte Knochengerüste ermöglichen.16–19 Dies sorgt für eine geeignete biophysikalische Stimulation und ein biochemisches Milieu, die zusammen für das Zellwachstum und die Bildung von neuem Knochengewebe erforderlich sind.20–22
Grayson et al. berichteten als erste über das Erzeugen von klinisch großen, lebensfähigen Knochentransplantaten aus Knochenmark-MSZ, die genau auf die komplexe Anatomie des Kiefergelenkknochens zugeschnitten wurden.15 In einer Folgestudie entwickelten Bhumiratana et al. ein in vitro personalisiertes Knochentransplantat für die Rekonstruktion von Gesichtsknochen aus Schweinefettgewebe-MSZ. 6 Monate nach der Implantation in Yukatan-Minischweinen hatten die hergestellten Transplantate ihre anatomische Struktur beibehalten, sich in das native Gewebe integriert und ein größeres Volumen an neuem Knochen und eine stärkere vaskuläre Infiltration erzeugt als nicht besiedelte Gerüsten oder unbehandelte Defekten.23 Dieser Ansatz befindet sich nun in der klinischen Erprobung (https://clinicaltrials.gov/ct2/show/NCT03678467).
MSZ-basierte zellfreie Therapieansätze
In den letzten Jahren hat die Anwendung von MSZ zur Knochenregeneration stark an Interesse gewonnen. Es gibt jedoch keine therapeutischen Lösungen, die eine breite klinische Anwendung erreichen würden. Präklinische Studien haben gezeigt, dass nur eine begrenzte Anzahl von transplantierten Zellen überlebt und in die Defektstellen einwächst. Zusätzlich sind die genauen Mechanismen exogener MSZ zur Bildung neuen Gewebes noch nicht klar.23–26 Andererseits wurde festgestellt, dass die transplantierten MSZ mehrere parakrine Wirkungen auf endogene Zellpopulationen haben können, darunter die Modulation von Immunzellen, angiogene Aktivität, Rekrutierung von benachbarten MSZ und endothelialen Vorläuferzellen, Zellproliferation, Stammzelldifferenzierung, antiapoptotische Effekte und Wundheilung.26–30 Die therapeutischen Effekte können auf trophische Wirkungen zurückgeführt werden, die vom Sekretom der MSZ bereitgestellt werden, einschließlich löslicher Faktoren wie Zytokine, Wachstumsfaktoren31–33 und extrazellulärer Vesikel (EV).
EV enthalten Proteine, Lipide und Nukleinsäuren mit potenziell proregenerativen Eigenschaften34 und werden daher als vielversprechende Kandidaten für zukünftige zellfreie regenerative Therapien angesehen. Außerdem scheinen MSZ-abgeleitete EV prima facie sicherer zu sein, da sie keine lebensfähigen Zellen enthalten. Es ist auch unwahrscheinlicher, dass systemisch applizierte EV-Präparate in der Lunge oder Leber eingeschlossen werden, und sie sind höchstwahrscheinlich weniger immunogen.35 Darüber hinaus können sie über einen längeren Zeitraum gelagert werden und bieten die Option eines kommerziellen Produkts zur Heilung von Knochendefekten.36
Studien haben bereits gezeigt, dass unfraktioniertes MSZ-Sekretom sowie MSZ-abgeleitete EV, in Kombination mit verschiedenen Gerüstmaterialien, in vivo an ektopischen Stellen Knochen generieren37 sowie die Knochenreparatur in Calvariadefekten von Nagetieren fördern.38–40 Idealerweise sollten die für die EV-Abgabe verwendeten biokompatiblen Gerüste die parakrine Funktion der Zellen durch eine langsame/kontrollierte Freisetzung imitieren, da bei einer explosionsartigen Freisetzung die proregenerativen Effekte weniger effizient sein könnten.40
Zukünftige Ausrichtung und Herausforderungen für MSZ- und EV-basierte therapeutische Ansätze zur Knochenregeneration
Es besteht ein deutlicher Bedarf an verbesserten Therapien in Fällen, bei denen die natürliche Knochenheilung beeinträchtigt ist. Wie beschrieben, haben mehrere MSZ-basierte Ansätze das Stadium der klinischen Prüfung erreicht. Die Fragen der Dosierung, der Verwendung autologer vs. allogener Zellen und der Wirksamkeit im Vergleich zur Standardbehandlung mit autologer Knochentransplantation werden derzeit untersucht.
Viele Herausforderungen bestehen noch in der Standardisierung, der Qualitätskontrolle, dem Scale-up, der GMP-Herstellung, der Logistik und den Unterschieden zwischen den MSZ-Quellen. Zusätzlich wird die Variabilität zwischen den Patienten aufgrund von Alter, Gesundheit und anderen Risikofaktoren den Erfolg von MSZ-basierten Therapieansätzen beeinflussen.
Während EV-Therapien viele Vorteile gegenüber Zelltherapien bieten, stehen sie vor ähnlichen Problemen wie Zelltherapien, wenn es um die Umsetzung der vielversprechenden Forschungsdaten in klinische Studien und die anschließende Anwendung am Patienten geht. Um die Vergleichbarkeit zwischen präklinischen Studien zu gewährleisten und eine zukünftige Translation in die Klinik zu ermöglichen, müssen die Aufreinigung und Charakterisierung von EV harmonisiert werden.41 So wurden bereits von mehreren Gruppen GMP-konforme Produktionsverfahren für aus Knochenmark stammende MSZ berichtet.41–45 Um die Produktion von MSZ-abgeleiteten Sekreten und EV zu erhöhen und effizienter und reproduzierbarer zu machen, wurden Bioreaktorsysteme und zugehörige analytische Ansätze im Vergleich zur statischen Kultur untersucht.46,47 Es sind jedoch weitere Forschungsarbeiten erforderlich, um unser mechanistisches Verständnis verschiedener Zell-, EV- und Tissue-Engineering-basierter Therapien innerhalb spezifischer klinischer Indikationen zu verbessern.
Danksagung:
Diese Arbeit wurde von der österreichischen FFG Industrienahe Dissertationen gefördert (Projektnummer 867803, SINEM). Abbildung 1 wurde mit BioRender.com erstellt.
Literatur:
1 Marolt Presen D et al.: Mesenchymal stromal cell-based bone regeneration therapies: from cell transplantation and tissue engineering to therapeutic secretomes and extracellular vesicles. Front Bioeng Biotechnol 2019; 7: 352 2 Fröhlich M et al.: Tissue engineered bone grafts: biological requirements, tissue culture and clinical relevance. Curr Stem Cell Res Ther 2008, 3(4): 254-64 3 Hernigou P et al.: Percutaneous autologous bone-marrow grafting for nonunions: influence of the number and concentration of progenitor cells. J Bone Joint Surg Am 2005; 87(7): 1430-7 4 Gómez-Barrena E et al.: Feasibility and safety of treating non-unions in tibia, femur and humerus with autologous, expanded, bone marrow-derived mesenchymal stromal cells associated with biphasic calcium phosphate biomaterials in a multicentric, non-comparative trial. Biomaterials 2019; 196: 100-8 5 Liebergall M et al.: Stem cell-based therapy for prevention of delayed fracture union: A randomized and prospective preliminary study. Mol Ther 2013; 21(8): 1631-8 6 Castillo-Cardiel G et al.: Bone regeneration in mandibular fractures after the application of autologous mesenchymal stem cells, a randomized clinical trial. Dent Traumatol 2017; 33(1): 38-44 7 Stegemann JP et al.: Cell therapy for bone repair: Narrowing the gap between vision and practice. Eur Cells Mater 2014; 27: 1-4 8 Correia C et al.: Development of silk-based scaffolds for tissue engineering of bone from human adipose-derived stem cells. Acta Biomater 2012; 8(7): 2483-92 9 Meinel L et al.: Osteogenesis by human mesenchymal stem cells cultured on silk biomaterials: Comparison of adenovirus mediated gene transfer and protein delivery of BMP-2. Biomaterials 2006; 27(28): 4993-5002 10 Forrestal DP et al.: Challenges in engineering large customized bone constructs. Biotechnol Bioeng 2017; 114(6): 1129-39 11 Meinel L et al.: Engineering bone-like tissue in vitro using human bone marrow stem cells and silk scaffolds. J Biomed Mater Res A 2004; 71(1): 25-34 12 Meinel L et al.: Silk implants for the healing of critical size bone defects.. Bone 2005;37(5): 688–98 13 Marolt D et al.: Bone and cartilage tissue constructs grown using human bone marrow stromal cells, silk scaffolds and rotating bioreactors. Biomaterials 2006; 27(36): 6138-49 14 Grayson WL et al.: Effects of initial seeding density and fluid perfusion rate on formation of tissue-engineered bone. Tissue Eng Part A 2008; 14(11): 1809-20 15 Grayson WL et al.: Engineering anatomically shaped human bone grafts. Proc Natl Acad Sci U S A 2010; 107(8): 3299-304 16 de Peppo GM et al.: Engineering bone tissue substitutes from human induced pluripotent stem cells Proc Natl Acad Sci U S A 2013; 110(21): 8680-5 17 Vetsch JR et al.: The influence of curvature on threedimensional mineralized matrix formation under static and perfused conditions: An in vitro bioreactor model. J R Soc Interface 2016; 13(123): 20160425 18 Mitra D et al.: Bioreactor culture duration of engineered constructs influences bone formation by mesenchymal stem cells. Biomaterials 2017; 146: 29-39 19 Sladkova M et al.: Segmental additive tissue engineering. Sci Rep 2018; 8: 10895 20 Sikavitsas VI et al.: Mineralized matrix deposition by marrow stromal osteoblasts in 3D perfusion culture increases with increasing fluid shear forces. Proc Natl Acad Sci U S A 2003; 100(25): 14683-8 21 Grayson WL et al.: Optimizing the medium perfusion rate in bone tissue engineering bioreactors. Biotechnol Bioeng 2011; 108(5): 1159-70 22 Zhao F et al.: Flow rates in perfusion bioreactors to maximise mineralisation in bone tissue engineering in vitro. J Biomech 2018; 79: 232-37 23 Bhumiratana S et al.: Tissue-engineered autologous grafts for facial bone reconstruction. Sci Transl Med 2016; 8(343): 343ra83 24 Geuze RE et al.: Luciferase labeling for multipotent stromal cell tracking in spinal fusion versus ectopic bone tissue engineering in mice and rats. Tissue Eng Part A 2010; 16(11): 3343-51 25 Manassero M et al.: Comparison of survival and osteogenic ability of human mesenchymal stem cells in orthotopic and ectopic sites in mice. Tissue Eng Part A 2016; 22(5-6): 534-44 26 Oryan A et al.: Role of mesenchymal stem cells in bone regenerative medicine: what is the evidence? Cells Tissues Organs 2017; 204(2): 59-83 27 Ponte AL et al.: The in vitro migration capacity of human bone marrow mesenchymal stem cells: comparison of chemokine and growth factor chemotactic activities. Stem Cells 2007; 25(7): 1737-45 28 Chen L et al.: Paracrine factors of mesenchymal stem cells recruit macrophages and endothelial lineage cells and enhance wound healing. PLoS One 2008; 3(4): e1886 29 Hofer HR, Tuan RS: Secreted trophic factors of mesenchymal stem cells support neurovascular and musculoskeletal therapies. Stem Cell Res Ther 2016; 7(1): 131 30 Ando Y et al.: Stem cell-conditioned medium accelerates distraction osteogenesis through multiple regenerative mechanisms. Bone 2014; 61: 82-90 31 Gnecchi M et al.: Paracrine mechanisms in adult stem cell signaling and therapy. Circ Res 2008; 103(11): 1204-19 32 Williams AR, Hare JM: Mesenchymal stem cells: biology, pathophysiology, translational findings, and therapeutic implications for cardiac disease. Circ Res 2011; 109(8): 923-40 33 Almeria C et al.: Hypoxia conditioned mesenchymal stem cell-derived extracellular vesicles induce increased vascular tube formation in vitro. Front Bioeng Biotechnol 2019; 7: 292 34 Andaloussi S et al.: Extracellular vesicles: Biology and emerging therapeutic opportunities. Nat Rev Drug Discov 2013; 12(5): 347-57 35 Laiet RC al.: Exosomes for drug delivery - a novel application for the mesenchymal stem cell. Biotechnol Adv 2013; 31(5): 543-51 36 Webber J, Clayton A: How pure are your vesicles? J Extracell Vesicles 2013; 2: 10.3402/jev.v2i0.19861 37 Xie H et al.: Extracellular vesicle-functionalized decalcified bone matrix scaffolds with enhanced pro-angiogenic and pro-bone regeneration activities. Sci Rep 2017; 7: 45622 38 Qi X et al.: Exosomes secreted by human-induced pluripotent stem cell-derived mesenchymal stem cells repair critical-sized bone defects through enhanced angiogenesis and osteogenesis in osteoporotic rats. Int J Biol Sci 2016; 12(7): 836-49 39 Qin Y et al.: Bone marrow stromal/stem cell-derived extracellular vesicles regulate osteoblast activity and differentiation in vitro and promote bone regeneration in vivo. Sci Rep 2016; 6: 21961 40 Li W et al.: Tissue-engineered bone immobilized with human adipose stem cells-derived exosomes promotes bone regeneration. ACS Appl Mater Interfaces 2018; 10(6): 5240-54 41 Witwer KW et al.: Defining mesenchymal stromal cell (MSC)-derived small extracellular vesicles for therapeutic applications. J Extracell Vesicles 2019; 8(1): 1609206 42 Schallmoser K et al.: Platelet-derived growth factors for GMP-compliant propagation of mesenchymal stromal cells. Biomed Mater Eng 2009; 19(4-5): 271-6 43 Fekete N et al.: GMP-compliant isolation and large-scale expansion of bone marrow-derived MSC. PLoS One 2012; 7(8): e43255 44 Andriolo G et al.: Exosomes from human cardiac progenitor cells for therapeutic applications: Development of a GMP-grade manufacturing method. Front Physiol 2018; 9: 1169 45 Mendt M et al.: Generation and testing of clinical-grade exosomes for pancreatic cancer. JCI Insight 2018; 3(8): e99263 46 Carmelo JG et al.: A xeno-free microcarrier-based stirred culture system for the scalable expansion of human mesenchymal stem/stromal cells isolated from bone marrow and adipose tissue. Biotechnol J 2015; 10(8): 1235-47 47 Mizukami A et al.: Proteomic identification and time-course monitoring of secreted proteins during expansion of human mesenchymal stem/stromal in stirred-tank bioreactor. Front Bioeng Biotechnol 2019; 7: 154
Das könnte Sie auch interessieren:
Rekonstruktionsmöglichkeiten bei Nervenläsionen
Die Rekonstruktion peripherer Nervenläsionen bleibt eine Herausforderung – besonders bei langen Defektstrecken, verzögerter Diagnostik oder ausgeprägter Denervierung. Der Artikel ...
Nervenkompressionssyndrome an Sprunggelenk und Fuß
Nervenkompressionssyndrome im Bereich des Sprunggelenks sowie des Fußes stellen eine komplexe Herausforderung dar. Nicht selten sind sie schwer zu diagnostizieren und können bei ...
Die geburtstraumatische Plexusläsion
Sowohl bei einer Spontangeburt als auch bei einer Sectio caesarea kann es zu einem Dehnungsschaden des Armnervengeflechts kommen. Die entstehende Läsion kann unter Umständen ...