Das sogenannte „leichte“ Schädel-Hirn-Trauma im Kindes- und Jugendalter
Autor:
Dr. Axel Gänsslen
Klinik für Unfallchirurgie, Orthopädie und Handchirurgie
Klinikum Wolfsburg
E-Mail: dr.gaensslen@gmx.de
Gehirnerschütterungen zählen in Deutschland zu den häufigsten Gründen für eine Krankenhausbehandlung. Sowohl bei Mädchen als auch bei Jungen unter 15 Jahren ist es die Top-1-Diagnose.21 Gerade Kinder und Jugendliche im Alter zwischen 12 und 19 Jahren sind durch die Entwicklung und Anpassung des Gehirns besonders gefährdet.2,10,47,49
Keypoints
-
Gehirnerschütterungen sind eine relevante, aber oft noch unterschätzte Verletzung.
-
Symptome umfassen sowohl klassische klinische Symptome als auch neurokognitive Symptome, Verhaltens- und Schlafveränderungen.
-
Eine akute orientierende Untersuchung soll erfolgen.
-
Die medizinische Beurteilung erfolgt anhand festgelegter Standards.
-
Eine zusätzliche neuropsychologische Untersuchung kann hilfreich sein.
-
In >85% findet eine vollständige Symptomerholung innerhalb von 1 Woche statt.
-
„Return to school/learn“ und „return to play“ helfen im Rahmen der Wiedereingliederung.
Der Begriff „Gehirnerschütterung“ wird teilweise mit dem leichten Schädel-Hirn-Trauma (SHT) gleichgesetzt und ist nach der American Medical Society for Sports Medicine (AMSSM) folgendermaßen definiert:41
Eine Gehirnerschütterung ist eine durch ein Trauma (Unfall) hervorgerufene vorübergehende Störung der Gehirnfunktion mit einem auf zellulärer Ebene ablaufenden komplexen pathophysiologischen Prozess.
Die neurologische Funktionsstörung ist dabei die Grundbedingung einer Gehirnerschütterung. Entsprechende Zeichen müssen erkannt werden, bevor die Diagnose einer Gehirnerschütterung gestellt werden kann.
Im Alltag wird das leichte SHT anhand der Glasgow Coma Scale (CGS) klassifiziert.22 Ein leichtes SHT entspricht einer GCS von 13–15 Punkten. In der Regel kann der Patient sprechen und es liegt keine relevante Bewusstseinsstörung vor. Die gesellschaftspolitische Relevanz von Gehirnerschütterungen zeigt sich u.a. durch eine über die letzten 1,5 Jahrzehnte 4,2-fache Zunahme berichteter Gehirnerschütterungen (1997–2008)53 und an der hohen Rate von 15–20%, bezogen auf alle erlittenen Verletzungen in Hochrisikosportarten.58
Risiko, Schweregrad sowie mögliche (Langzeit-)Folgen von Gehirnerschütterungen werden regelhaft unterschätzt.19,27,64 Die Rate der übersehenen oder nicht gemeldeten Gehirnerschütterungen wird mit durchschnittlich 40% angegeben (30,5%–81,5%).33
Gehirnerschütterungen sind ein Trauma des Gehirns und kein Trauma des Kopfes.41,65,66
Verletzungsmechanismus
Ein genauer Verletzungsmechanismus ist nicht bekannt, da interindividuell völlig unterschiedliche Kräfte auf das Gehirn einwirken. Der Verletzungsvektor kann linear sein oder Rotationsbewegungen des Kopfes und des Gehirns initiieren. Meist liegen jedoch kombinierte Karfteinwirkungen vor.46 Es werden die direkte Krafteinwirkung auf den Kopf mit Gefahr einer direkten Hirnschädigung und die indirekte Krafteinwirkung durch Kraftübertragung aus der Peripherie des Körpers mit vergleichbaren mechanischen Konsequenzen unterschieden.65,67 Dabei kommt es definitiv zu Verletzungen der grauen und weißen Substanz. Diese sind aber normalerweise so minimal, dass sie im Rahmen radiologischer Standardbildgebungsverfahren (CCT, MRT) nicht erkannt werden können.
Pathophysiologische Folgen
Die Pathophysiologie des leichten SHT ist nicht vollständig geklärt. Es findet regelhaft eine Krafteinwirkung statt, die zu einer Dehnung der neuronalen Zellmembranen und Axone führt und eine komplexe Kaskade von ionischen, metabolischen und pathophysiologischen Ereignissen nach sich zieht.3
Klinische Zeichen und Symptome
Nach einer Gehirnerschütterung besteht in der Regel ein vielfältiger Symptomenkomplex, bestehend aus klinischen und neurokognitiven Symptomen sowie Verhaltens- und Schlafveränderungen. Typische klinische Zeichen können Verwirrtheit, Bewusstlosigkeit, Verlangsamung, Beeinträchtigung der Gangsicherheit, Pupillendifferenz und der „leere Blick“ sein. Klassische historische Symptome, wie Bewusstlosigkeit und Amnesie, finden sich nur in 20% bei Profisportlern4 und bei weniger als 10% im Freizeitsport.68
-
Typische klinische Symptome sind Kopfschmerzen (70–80%), Schwindel (34–70%), Übelkeit/Erbrechen (20–40%), Nackenschmerzen (20%), Schwäche/Müdigkeit (20–50%), Sehstörungen (ca. 20%) und Empfindlichkeit gegenüber Licht und Lärm (10–60%).4,51
-
Zu den kognitiven Symptomen zählen ein „Nebel“-Gefühl, geistige Einschränkungen, Konzentrationsprobleme und Gedächtnisprobleme, Verwirrtheit, verlangsamtes Antworten auf Fragen oder wiederholtes Fragen (gleicher Inhalte).
-
Verhaltenssymptome können eine erhöhte Reizbarkeit, Nervosität oder Traurigkeit sein, eine eingeschränkte Emotionalität, Verlust der Impulskontrolle und mangelndes Interesse an Aktivitäten.
-
Schlafstörungen umfassen vermehrte Schläfrigkeit, weniger oder mehr Schlaf und Einschlafstörungen.
Akut-(Sideline-)Evaluation
In der Akutsituation ist eine schnelle Beurteilung nach standardisierten Kriterien erforderlich und empfehlenswert.29,41
Das sogenannte „Concussion Recognition Tool“ fahndet nach sichtbaren Zeichen und Symptomen einer vermuteten Gehirnerschütterung (Abb.1).24,71 Weitere Analyseinstrumente sind die Glasgow Coma Scale (GCS), die Post Concussion Symptom Scale (PCSS), das Standardized Assessment of Concussion (SAC), das Balance Error Scoring System (BESS), der King-Devick-Test und das Testen der Reaktionszeit. GCS, PCSS, SAC und BESS wurden in das SCAT-Konzept (Sport Concussion Assessment Tool 1–3 und 5) integriert.25,66
Abb. 1: Concussion Recognition Tool (mit freundlicher Genehmigung der ZNS – Hannelore Kohl Stiftung)
Auf eine detaillierte Darstellung aller Analyseinstrumente muss in diesem Beitrag verzichtet werden. Es wird auf die entsprechende Literatur verwiesen.37
King-Devick-Test
Der King-Devick-Test zählt zu den immer häufiger verwendeten Tests zur Spielfeldrand-Beurteilung einer Gehirnerschütterung.23 Er ist ein visuell basierter Test, bei dem Zahlen zeilenweise durch Testung sakkadischer Augenbewegungen schnell gelesen und erkannt werden müssen.32,52 Dieser Test kann ideal akut angewendet werden, die vollständige Durchführung benötigt nur etwa 1–2 Minuten.30,31 Eine Beeinträchtigung durch Müdigkeit bzw. körperliche Anstrengung spielt keine Rolle.48 Jede Verlangsamung der Testzeit (Einzeltests ca. 14s, Gesamttestzeit ca. 42s) deutet auf eine Gehirnerschütterung hin.31,59
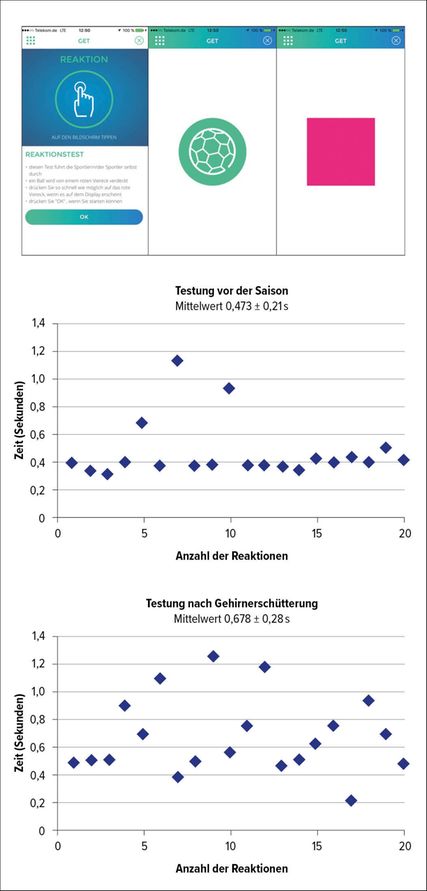
Reaktionszeit
Abb. 2: App-basierte Testung der Reaktionszeit (GET-App der ZNS – Hannelore-Kohl-Stiftung, mit freundlicher Genehmigung)
Die Prüfung der Reaktionszeit (Abb. 2) dient als Maß für die Verarbeitungsgeschwindigkeit und wird als wertvolle Ergänzung in der neuropsychologischen Akutbeurteilung angesehen, da die Reaktionszeit nach SHT regelhaft beeinträchtigt ist.5,15,28,77 Kürzlich wurde ein einfacher App-basierter 70-Sekunden-Test (GET-App, www.schuetzdeinenkopf.de; ZNS Hannelore Kohl Stiftung) als geeignete Alternative vorgeschlagen (normale Reaktionszeit 0,3–0,4sek.).34
Es gibt Hinweise darauf, dass die Kombination verschiedener Test, die einzeln verschiedene Hirnfunktionen analysieren, die Sensitivität und Spezifität für die Diagnose verbessern.8,14,73
Die subjektiven (teils auch objektiven) Symptome sind der empfindlichste Indikator für das Vorliegen einer Gehirnerschütterung und sollten regelmäßig abgefragt werden. Eine ärztliche Beurteilung sollte immer dann anschließen, wenn der Verdacht auf eine Gehirnerschütterung besteht, entweder durch einen entsprechend erfahrenen Arzt direkt im Stadion oder (besser) im Krankenhaus.
Primäre medizinische Behandlung im Krankenhaus
Die klinische und neurologische Beurteilung des Patienten mit einer Gehirnerschütterung wird häufig unzureichend durchgeführt. Die allgemeine klinische Evaluation basiert auf einem standardisierten ABCDE-Konzept.29
Im subakuten Verlauf nach Evaluation im Sportbereich sollten bei diagnostizierter Gehirnerschütterung folgende Aspekte zusätzlich evaluiert werden:41 umfassende Vorgeschichte, neurologische Untersuchung, Einzelheiten des Verletzungsmechanismus, Symptomverlauf, neurokognitive Funktionsanalyse, Schlaf-/Wachzustand-Störungen, Augenfunktion, Vestibularfunktion, Gang, Gleichgewicht, Untersuchung der Halswirbelsäule (HWS).
Die HWS-Distorsion und die Gehirnerschütterung haben ähnliche Ursachen und vergleichbare Symptome. Deshalb ist die rechtzeitige Differenzierung von wesentlicher Bedeutung für die Einleitung einer adäquaten Therapie.13
Radiologische Diagnostik
Eine radiologische Diagnostik wird durchgeführt, um strukturelle Verletzungen auszuschließen oder zu bestätigen. Bei bestehenden Risikofaktoren oder „Red flag“-Symptomen wird eine radiologische Diagnostik obligatorisch empfohlen.22,29 Das klassische Röntgen des Schädels ist nicht hilfreich und soll nicht erfolgen.74
Eine routinemäßige CT-Abklärung ist bei Kindern mit leichtem SHT nicht erforderlich. Es sollten vor einer möglichen CT-Diagnostik klinische Entscheidungsregeln zur Anwendung kommen, um Kinder mit geringem und erhöhtem Risiko für intrazerebrale strukturelle Verletzungen sicher zu identifizieren, um das Risiko der Strahlenbelastung für das kindliche Gehirn so weit wie möglich zu reduzieren.54 Diese umfassen überwiegend die Konzepte PECARN, CATCH, CHALICE (Übersicht in Gännslen, Neubauer 2021; Huscsava et al. 2013).35,44
Serum-Biomarker
Die Rolle flüssiger Biomarker wird nach wie vor kontrovers betrachtet, weil eindeutige Ergebnisse fehlen.41 Derzeit besteht keine routinemäßige Indikation zur Verwendung von Serum-Biomarkern zur Diagnostik und Therapiesteuerung beim kindlichen leichten SHT.54
Neuropsychologische Analyse
Ein zusätzlicher neuropsychologischer (NP) Test kann die Verlaufsbeurteilung (Schweregrad-Beurteilung und Return-to-play-Empfehlungen) nach Gehirnerschütterung unterstützen und erleichtern,65 sollte aber die medizinisch-klinische Standardbeurteilung der Patienten nicht ersetzen.
Akuter Verlauf und Risikofaktoren
In der Regel kommt es innerhalb kurzer Zeit zu einer vollständigen Erholung der Patienten. Die komplette klinische (subjektive Symptome) und kognitive Erholung sowie die Wiederherstellung des Gleichgewichts werden in der Regel innerhalb einer Woche nach der Verletzung beobachtet,62,63 sodass 80–90% der Betroffenen innerhalb von 2 Wochen ihr normales Funktionsniveau wieder erreichen. In 85% der Fälle verschwinden die Symptome nach einer Gehirnerschütterung innerhalb einer Woche und in 97% innerhalb eines Monats vollständig. Spätestens nach 3–12 Monaten sollte die Erholungsphase abgeschlossen sein.11,61,63
Bei jüngeren Kindern kann die klinische Erholung verzögert ablaufen, mit durchschnittlich 4 Wochen Erholungsphase.84
Häufig verläuft die klinische Erholung schneller als die neurokognitive Erholung. Neurokognitive Symptome sind wie die klinischen Symptome selbstlimitierend und verschwinden normalerweise nach 2–14 Tagen vollständig.15,57
Primäre Symptome, die zu einer längeren Erholungsphase führen können, sind: starke primäre Kopfschmerzen, Schwäche/Müdigkeit, das Vorhandensein einer Amnesie sowie eine pathologische neurologische Untersuchung.61 Der relevanteste Prädiktor für die Erholung nach Gehirnerschütterung sind Anzahl und Schweregrad der akuten und subakuten Symptome.45 Subakute Kopfschmerzen und depressive Symptome wurden als Risikofaktoren für ein Symptom-Fortbestehen >1 Monat identifiziert.45
Return to school/work/learn
Durch zu frühe und zu ausgedehnte Teilnahme am Unterricht oder am Arbeitsleben können Symptome verschlechtert werden. Eine – wie im Erwachsenbereich bereits etablierte – gestaffelte, schrittweise Belastungserprobung muss deshalb als Option angedacht werden.36 Insbesondere Kinder können in ihrer Erholungsphase deutliche Verzögerungen aufweisen.12 Deshalb wird ein abgestuftes Konzept der schulischen Reintegration unter Berücksichtigung der kognitiven Leistungen favorisiert.20,65,75 Eine Wiederaufnahme ist dann sinnvoll, wenn durch die Unterrichtseinheiten keine kognitiven Symptome provoziert werden.56,76
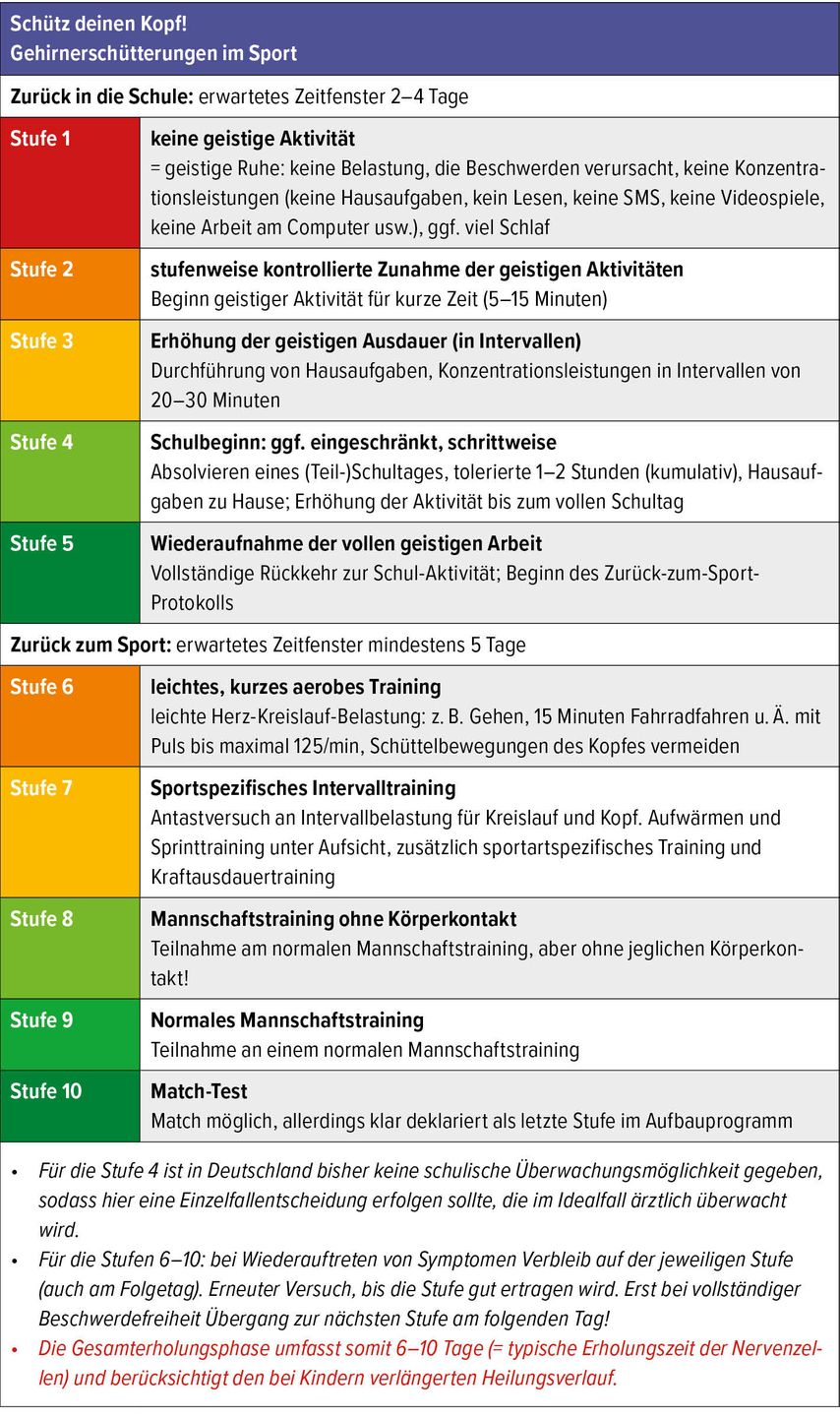
Return to sport/play
Vor jedem kompletten „return to play“ sollte das „return to school“ abgeschlossen sein!41,65,66 Meist wird ein 6-stufiges „Return to play“-Protokoll angewendet, das die pathophysiologischen Veränderungen nach Gehirnerschütterung berücksichtigt (Abb. 3).26,29,60,65,66
Abb. 3: Kombiniertes „return to school/learn“ und „return to sport“, idealisiert im Sinne eines Schritt-für-Schritt-Vorgehens (nach: Initiative „Schütz Deinen Kopf“ der ZNS – Hannelore Kohl Stiftung, www.schuetzdeinenkopf.de)
Eine Wiederaufnahme des Sports am Tag des Unfalls sollte die absolute Ausnahme sein und darf nach ärztlicher Einschätzung nur erfolgen, wenn die neurokognitive Beurteilung eine vollständige klinische und kognitive Erholung zeigt.65,66 Bei jungen Sportlern (<18 Jahre) sollte wegen des Risikos für eine prolongierte Erholung hierbei eher zurückhaltend gehandelt werden. In den graduellen Phasen des Fortschritts sollte für mindestens 24 Stunden jeweils keine Rückkehr von Symptomen zu beobachten sein, bevor zur nächsten Stufe übergegangen wird.
Therapie
Die initiale Therapie der Gehirnerschütterung umfasst die primäre Ruhephase und die Phase der symptomabhängigen körperlichen Aktivitätssteigerung. Eine zu strenge und zu lange kognitive und körperliche Ruhe ist aber für die Erholung nachteilig und erhöht die Wahrscheinlichkeit für anhaltende Symptome.38–40 Entsprechend wird die „totale“ geistige und körperliche Abschirmung nicht mehr empfohlen. Konsensus-Empfehlungen propagieren einen maximalen Zeitraum von 24–48 Stunden für symptombegrenzte kognitive und körperliche Aktivitäten, gefolgt von einer allmählichen Zunahme der Aktivitäten unterhalb der Schwelle der Entwicklung körperlicher und geistiger Symptome.41,66
Verlauf
In der unmittelbar posttraumatischen Phase nach einer Gehirnerschütterung ist das Gehirn aufgrund der Verletzung vermutlich besonders anfällig für längerfristige pathophysiologische Veränderungen.72,82,83 Es besteht prinzipiell ein erhöhtes Risiko, frühzeitig eine weitere Gehirnerschütterung zu erleiden. Eine weitere Gehirnerschütterung erhöht dann zusätzlich das Risiko für einen prolongierten Verlauf. Gerade im Kindesalter zeigen verschiedene Analysen kurz- bis mittelfriste Probleme:
-
verzögerte Erholung9,17
-
Sehstörungen
-
Einschränkungen der Herzfrequenzvariabilität unter körperlicher Belastung über Wochen bis Monate1
-
1,7-fach höhere Rate von Kopfschmerzen 3 Monate nach dem Trauma6
Mittelfristige Risiken nach Gehirnerschütterung sind überwiegend persistierende Symptomatiken sowie weitere gesundheitsbeeinträchtigende Risiken. Letztere umfassen v.a. ein höheres Risiko für muskuloskelettale Verletzungen.55
Aktuelle systematische Analysen befürworten ein multimodales Behandlungskonzept, wenn längerfristige Symptome vorliegen, einschließlich vestibulärer, okulomotorischer, psychischer, schlafstabilisierender, zervikaler und modulativer Behandlung des autonomen Nervensystems.16,41,78,79
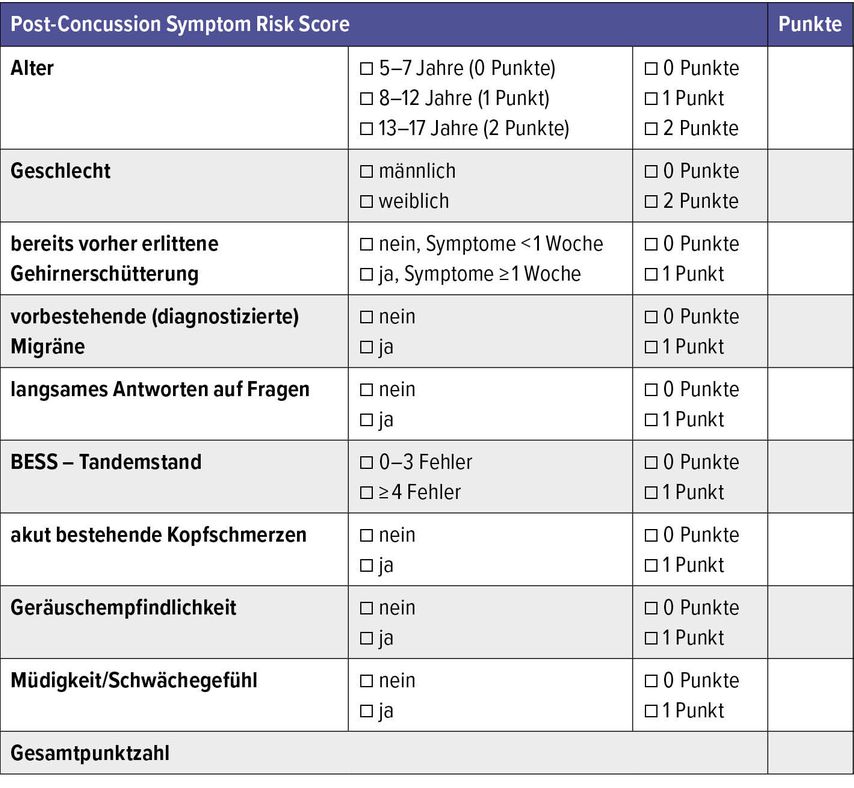
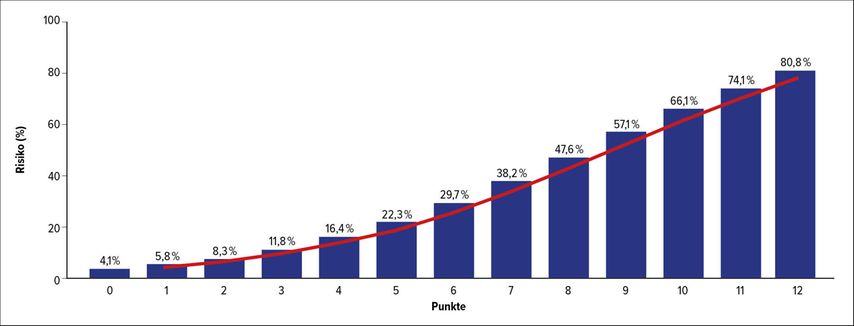
Zamek et al. haben einen Risiko-Score zur Prädiktion von persistierenden Symptomen nach Gehirnerschütterung und leichtem SHT entwickelt (Abb. 4), der eine Symptomatikprognose für 1 Monat nach dem Trauma ermöglicht.84 Schlafstörungen wurden als Risikofaktor für eine verzögerte Erholung und eine überschießende, verstärkte Symptomatik identifiziert. Vermehrtes Schlafen kann aber auch ein Zeichen der Erholung sein, während weniger Schlaf (>1h) die Reaktionszeit negativ beeinflussen kann.7,42,43,50 Posttraumatische Sehstörungen sind als Risikofaktor für zusätzliche Lernstörungen, Lesestörungen, Kopfschmerzen (bis 84%!), schlechtere neurokognitive Ergebnisse und vermehrte Symptome identifiziert worden.18,70,80,81
Abb. 4a: Risiko-Score zur Prädiktion von persistierenden Symptomen nach Gehirnerschütterung und leichtem SHT (aus Gänsslen et al. 2021)37
Neurokognitive Beeinträchtigungen
Neurokognitive Beeinträchtigungen können lange Zeit bestehen. So wurden derartige Beeinträchtigungen bei Jugendlichen 7 Jahre nach dem Trauma nachgewiesen.69 Es sollte versucht werden, die Ursache der kognitiven Dysfunktionen in Zusammenschau mit anderen Symptomen des leichten SHT bzw. der Gehirnerschütterung einzuschätzen.54 Eine Therapie sollte ursachenabhängig erfolgen. Bei anhaltenden Störungen wird eine neuropsychologische Mitbetreuung empfohlen.54 Bei Beschwerdepersistenz sollte auch an eine Hormondysfunktion gedacht werden.37
Präventions-, Schutz- und Bildungsstrategien
In Deutschland wurde vor Kurzem ein Bildungs- und Lehrkonzept in Bezug auf Gehirnerschütterungen mithilfe der ZNS – Hannelore Kohl Stiftung und der Verwaltungs-Berufsgenossenschaft gestartet (Initiative „Schütz Deinen Kopf“ der ZNS Hannelore Kohl Stiftung, www.schuetzdeinenkopf.de ).
Literatur:
1 Abaji J et al.: J Neurotrauma 2016; 33: 811-7 2 Bakhos L et al.: Pediatrics 2010; 126(3): e550-6 3 Barkhoudarian G et al.: Phys Med Rehabil Clin N Am 2016; 27: 373-93 4 Benson B et al.: CMAJ 2011; 183: 905-11 5 Blackburn H, Benton A: Confinia Neurologica 1955; 15: 327-38 6 Blume H: Curr Pain Headache Rep 2015; 19: 42 7 Bramley H et al.: Clin Pediatr 2017; 56: 1280-5 8 Broglio S et al.: J Athl Train 2007; 42: 509-14 9 Brown N et al.: Pediatrics 2014; 133: e299-304 10 Browne G, Lam L: Br J Sports Med 2006; 40: 163-8 11 Carroll L et al.: J Rehabil Med 2004; 43(Suppl): 84-105 12 Carson J et al.: Can Fam Phys 2014; 60: e310-5 13 Cheever K et al.: J Athl Train 2016; 51: 1037-44 14 Chin E et al.: Am J Sports Med 2016; 44: 2276-85 15 Collins L, Long C: Arch Clin Neuropsychol 1996; 11: 613-23 16 Collins M et al.: Knee Surg Sports Traumatol Arthrosc 2014; 22: 235-46 17 Corwin D et al.: J Pediatr 2015; 166: 1221-5 18 DeCarlo D et al.: Optom Vis Sci 2016; 93: 459-65 19 Delaney J et al.: Clin J Sports Med 2002; 12: 331-8 20 DeMatteo C et al.: Clin Pediatr 2015; 54: 783-92 21 Destatis, Robert Koch-Institut (Hrsg).: Gesundheit in Deutschland. Gesundheitsberichterstattung des Bundes. Gemeinsam getragen von RKI und Destatis. RKI, Berlin 2015 22 DGN, Leitlinie Leichtes Schädel-Hirn-Trauma. Leitlinien der Deutschen Gesellschaft für Neurologie: Leitlinien für Diagnostik und Therapie in der Neurologie, 4. überarbeitete Auflage, Stuttgart: Georg Thieme Verlag 2008: 654ff 23 Dziemianowicz M et al.: Curr Neurol Neurosci Rep 2012; 12: 547-9 24 Echemendia R et al.: Br J Sports Med 2017. 51: 870-1 25 Echemendia R et al.: Br J Sports Med 2017; 51: 848-50 26 Echlin P et al.: Neurosurg Focus 2010; 29: E5 27 EishockeyNews, Ausgabe 01, 2012 28 Elsass E:Acta Neurologica Scandinavica 1986; 73: 225-46 29 Feddermann-Demont N et al.: J Sports Sci 2014; 32(2): 1217-28 30 Galetta K et al.: Neurology 2011; 76: 1456-62 31 Galetta K et al.: J Neurol Sci 2011; 309: 34-9 32 Galetta M et al.:JNeurol Sci 2013; 328: 28-31 33 Gänsslen A et al.: Dtsch Ärztebl 2016; 113(15): doi: 10.3238/PersNeuro.2016.04.15.03 34 Gänsslen A, Krutsch W: Feasibility study of a simple reaction test for immediate sideline-analysis – preliminary results. Poster presented at the 5th International Consensus Conference on Concussion in Sport, Berlin, 2016 35 Gänsslen A, Neubauer T: Kindliches Schädel-Hirn-Trauma – Allgemeines und Besonderheiten des leichten SHT. In: Engelhardt M, Raschke M (eds): Orthopädie und Unfallchirurgie. Springer Reference Medizin. Berlin, Heidelberg: Springer 2021 36 Gänsslen A et al.: Unfallchirurg 2017; 120: 442-8 37 Gänsslen A et al.: Kindliches Schädel-Hirn-Trauma – Gehirnerschütterung. In: Engelhardt M, Raschke M (eds): Orthopädie und Unfallchirurgie. Springer Reference Medizin. Berlin, Heidelberg: Springer 2021 38 Griesbach G et al.: Neuroscience 2004; 125: 129-39 39 Griesbach G et al.: J Neurotrauma 2014. 31: 674-82 40 Griesbach G et al.: J Neurotrauma 2012. 29: 1426-33 41 Harmon K et al.: Br J Sports Med 2019; 53: 213-25 42 Hinds A et al.: Concussion 2016; 1(3): CNC15 43 Hoffman N et al.: Clin J Sport Med 2020; 30 (Suppl 1): S29-35 44 Huscsava H et al.: JATROS Unfallchirurgie & Sporttraumatologie 2013; 1: 14-8 45 Iverson G et al.: Br J Sports Med 2017; 51: 941-8 46 Jordan B: Nat Rev Neurol 2013; 9: 222-30 47 Karlin A: C PM R 2011; 3: S369-79 48 King D et al.: J Neurol Sci 2013; 326: 59-63 49 Konrad C et al.: Psychol Med 2011; 41(6): 1197-211 50 Kostyun R et al.: Am J Sports Med 2015; 43: 633-40 51 Lau B et al.: Am J Sports Med 2011; 39(11): 2311-8 52 Leong D et al.: J Sports Med Phys Fitness 2014. 54: 70-7 53 Lincoln A et al.: Am J Sports Med 2011; 39(5): 958-63 54 Lumba-Brown A et al.: JAMA Pediatr 2018; 172(11): e182853 55 Lynall R et al.: Med Sci Sports Exerc 2015; 47: 2487-92 56 Makdissi M et al.: Br J Sports Med 2013; 47: 308-13 57 Makki A et al.: Global Pediatric Health 2016; 3: 1-3 58 Marar M et al.: Am J Sports Med 2012; 40(4): 747-55 59 Master C et al.: Ann Int Med 2014; 160: ITC2-1-1 60 May K et al.: Int J Sports Phys Ther 2014; 9(2): 242-55 61 McCrea M: Mild traumatic brain injury and postconcussion syndrome. Oxford: Oxford University Press, 2008 62 McCrea M et al.: JAMA 2003; 290: 2556-63 63 McCrea M et al.: J Int Neuropsychol Soc 2013; 19: 22-33 64 McCrea M et al.: Clin J Sports Med 2004; 14: 13-7 65 McCrory P et al.: Br J Sports Med 2013; 47(5): 250-8 66 McCrory P et al.: Br J Sports Med 2017; 51: 838-47 67 Meaney D, Smith D: Clin Sports Med 2011; 30: 19-31 68 Meehan WP et al.: Am J Sports Med 2010; 38(12): 2405-9 69 Moore RC et al.: J Athl Train 2014; 49: 24-35 70 Pearce K et al.: Am J Sports Med 2015; 43: 3055-61 71 Pocket CRT, Pocket Concussion Recognition Tool. Br J Sports Med 2013; 47(5): 267 72 Prins M et al.: J Neurotrauma 2013; 30: 30-8 73 Randolph C et al.: J Athl Train 2005; 40: 139-52 74 Rickels E: Chirurg 2009; 80: 153-63 75 Rose S et al.: Concussion 2015; 1(1): CNC4 76 Sady M et al.: Phys Med Rehabil Clin N Am 2011; 22: 701-19 77 Sarno S et al. Brain Inj 2003; 17: 413-26 78 Schaan M et al.: Trauma Berufskrankh 2016; 18: 139-43 79 Schmehl I et al.:Trauma Berufskrankh 2011; 13: 12-7 80 Storey E et al.: Optom Vis Sci 2017; 94: 96-100 81 Tannen B et al.: Vis Dev Rehabil 2015; 3: 206-13 82 Vagnozzi R et al.: Brain 2010; 133(11): 3232-42 83 Weil Z et al.: Neurobiol Dis 2014; 70: 108-16 84 Zemek R et al.: JAMA 2016; 315: 1014-25
Das könnte Sie auch interessieren:
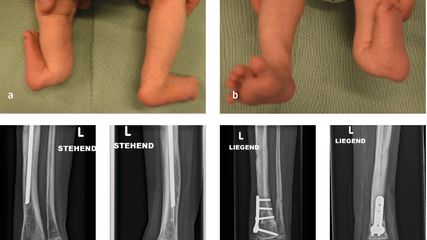
Angeborene Fehlstellungen des Unterschenkels
Kongenitale Deformitäten des Unterschenkels gehören zu den seltenen, aber medizinisch bedeutenden und operativ herausfordernden Diagnosen der Kinderorthopädie. Eine differenzierte ...
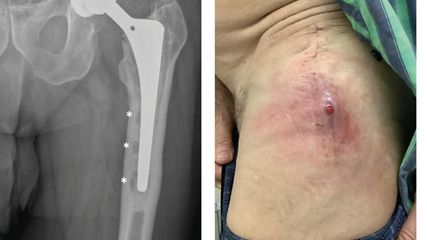
Einzeitiger und mehrzeitiger septischer Endoprothesenwechsel
Die periprothetische Infektion (PPI) stellt eine der gefürchtetsten Komplikationen im Bereich der Orthopädie und Traumatologie dar. Sie ist verbunden mit hohen Morbiditäts- und ...
Hochgradige ACG-Luxationen – wann konservativ behandeln, wann nicht?
Verletzungen des Akromioklavikulargelenks (ACG) gehören zu den häufigsten Schulterverletzungen bei jungen und aktiven Menschen, insbesondere auch aufgrund der zunehmenden Beliebtheit von ...