Das anterolaterale Eck des Kniegelenkes
Autoren:
Dr. Jürgen Mandl
UKH Steiermark, Standort Graz, Senior Consultant Spezialambulanz Knie
Dr. Sebastian Sorger
UKH Steiermark, Standort Graz
Dr. Peter Hausbrandt
UKH Steiermark, Standort Graz
Daniel Resch
Medizinische Universität Graz
Korrespondierender Autor:
Dr. Sebastian Sorger
E-Mail: dr.sorger@sera.at
Im Jahre 2013 brachten Claes et al.1 die Anatomie des anterolateralen Ecks des Kniegelenkes wieder in den Fokus der Wissenschaft, wodurch auch die klinischen Anwender sich wieder zunehmend mit der Thematik und der operativen Sanierung zu beschäftigen begannen.
Keypoints
-
Die VKB-Ruptur ist keine isolierte Verletzung.
-
An das anterolaterale Eck bei VKB-Verletzungen denken.
-
Ein Pivot-Shift Grad III benötigt anterolateralen Zusatzeingriff.
-
Die hohe Rerupturrate nach VKB-Rekonstruktion verlangt nach additiven Stabilisatoren.
-
Tenodese und ALL zeigen ähnlich gute klinische Ergebnisse im Follow-up.
-
Vergessen Sie nicht, auf Wurzelläsionen, Beinachse und Slope zu achten!
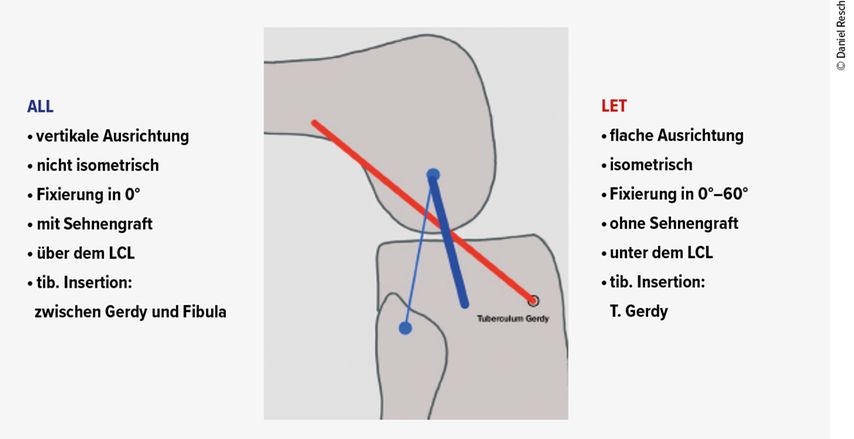
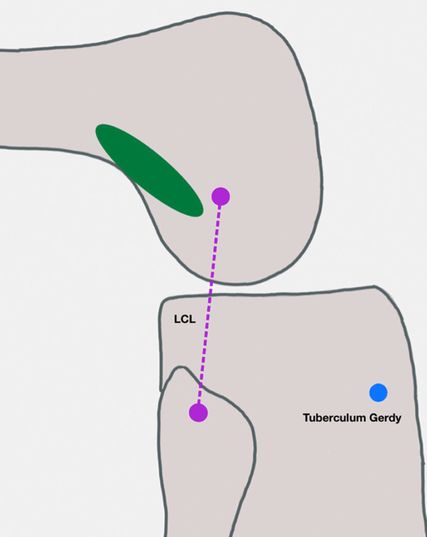
Claes et al. beschrieben das „anterolaterale Ligament“ (ALL), welches vom lateralen Femurepikondylus an die Pars intermedia des lateralen Meniskus und an die Tibia zwischen Tuberculum gerdyi und dem Fibulakopf zu ziehen scheint.1 Bereits davor wurden anterolaterale Strukturen als „perlmuttartiges fibröses Band“2, „anteriorer Anteil des lateralen Kollateralbandes“3 oder „laterales Kapselband“4 beschrieben.
Zahlreiche anatomische Studien der letzten Jahre diskutierten immer wieder das Vorhandensein des ALL, da in einigen Kadaverstudien ein regelhaftes Vorkommen nicht sicher nachgewiesen werden konnte.5 Herbst et al.6 führten die unterschiedlichen anatomischen Beschreibungen auf unterschiedliche Einbettungs- und Dissektionsmethoden zurück und stellten die Möglichkeit in den Raum, dass es sich lediglich um eine Kapseldoppelung des oberflächlichen und tiefen Kapselbandes handeln könnte, welches sich durch die Einbalsamierung der Präparate als Ligament darstellt.7
Landreau et al.8 aus der Arbeitsgruppe von Smigielski zeigten in einer Analyse des anterolateralen Ecks eine weitere Struktur, den sogenannten „condylar strap“. Diese Verbindung der lateralen Kondylarregion mit dem Iliotibialband (ITB) liegt distal der Kaplanfasern und dürfte ein weiterer Innenrotationshemmer sein. Sie wiesen in ihrer Arbeit jedoch auch eindeutig auf die eigenständige Struktur des ALL in all ihren Präparaten hin. Des Weiteren gibt es auch histologische Arbeiten, die das ALL klar von der Kapsel unterscheiden und eine Ähnlichkeit mit dem inferioren glenohumeralenBand (IGHL) zeigen, welches ja auch einem in die Kapsel eingelassenen Band an der Schulter entspricht.9
Aus unserer Sicht ist die Definition eines „anterolateralen Komplexes“ (ALC), wie es die Gruppe von Herbst und Musahl 2017 tat, für das anterolaterale Eck am sinnvollsten.6 Der Komplex wird als funktionelle Einheit beschrieben, welche aus den oberflächlichen und tiefen Anteilen des ITB, den Kaplanfasern als knöcherner Verankerung des ITB am lateralen Femurkondyl, der anterolateralen Gelenkskapsel sowie dem „mid-third capsule ligament“, dem ALL entsprechend, besteht.
Aus klinischer Sicht spielt das anterolaterale Eck vor allem bei der persistierenden „anterolateralen Rotationsinstabilität“ (ALRI) nach Rekonstruktion des vorderen Kreuzbandes (VKB) eine Rolle. Bei einer Kreuzbandruptur verschiebt sich das Rotationszentrum des Kniegelenkes nach medial, wodurch es bei Innenrotation des Unterschenkels zu einer vermehrten Translation des lateralen Tibiaplateaus kommt. Warum es bei primären Verletzungen des anterolateralen Komplexes oft zu keiner suffizienten Ausheilung bei konservativer Therapie kommt, ist nicht geklärt. Für den primären Repair des anterolateralen Kapselbandapparates gibt es derzeit keine Evidenz. Bei chronischen VKB-Insuffizienzen und im VKB-Revisionsfall spielt der Mechanismus der sekundären Auslockerung des Gewebes eine Rolle. Daher erscheint in diesen Fällen eine additive Rekonstruktion der anterolateralen Bandstrukturen sinnvoll. Festzuhalten ist, dass auch Außenmeniskus-Wurzelläsionen, Korbhenkelrisse des Außenmeniskus und ein erhöhter tibialer Slope zu einer ALRI führen können.10 Laut Literatur findet man eine ALRI in bis zu 25% nach erfolgreicher VKB-Rekonstruktion.11
Um die biomechanischen Grundlagen des ALC besser zu verstehen, wurden von verschiedenen Autoren biomechanische Dissektionsstudien an Kadavern durchgeführt, mit zum Teil sehr divergierenden Ergebnissen und Interpretationen. Kittl et al.12 zeigten in ihrer Studie, dass die tiefen Anteile des ITB mit den Kaplanfasern in einer Flexionsstellung von 30° bis 90° die entscheidenden Innenrotationsantagonisten bei VKB-intakten und VKB-defizienten Knien sind, wohingegen sie dem ALL keine signifikante Rolle zusprachen. Geeslin et al.13 hingegen zeigten in ihrer Kadaverstudie, dass sowohl das ALL als auch die Kaplanfasern eine signifikante Rolle bei der Innenrotationshemmung spielen, wobei bei höheren Flexionsgraden (60–90°) die Kaplanfasern die Innenrotation signifikant mehr hemmen als das ALL.
Huser et al.14 untersuchten die Strukturen des ALC bei einem simulierten Pivot-Shift-Manöver. Sie zeigten, dass eine isolierte Dissektion des ALL in einem VKB-intakten Knie zu keiner signifikanten Zunahme der tibiofemoralen Translation führte, womit das ALL offensichtlich kein primärer Stabilisator eines Pivot-Shifts ist. Weiters zeigte dieselbe Gruppe, dass in einem VKB-insuffizienten Knie eine Dissektion des ITB und des ALL in 71% zu einem Pivot-Shift Grad III führte.
Inderhaug et al.15 publizierten übereinstimmende Daten und zeigten, dass bei VKB-Läsion und Verletzung des ALC eine isolierte Rekonstruktion des VKB die Kinematik des Kniegelenkes nicht wiederherstellt. Sie zeigten jedoch auch, dass eine VKB-Rekonstruktion mit zusätzlicher lateraler extraartikulärer Stabilisation (Tenodese oder ALL-Rekonstruktion) die Kinematik des Kniegelenkes wiederherstellen konnte.
Diagnostik
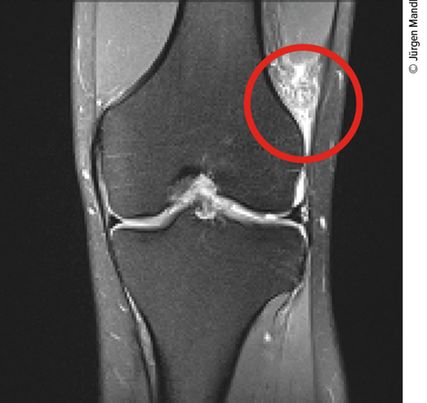
Diagnostisch werden zur Evaluierung von Verletzungen des ALC sowohl Ultraschall als auch das MRT verwendet. Sonografisch werden in der Literatur divergierende Ergebnisse publiziert. Cavaignac et al.16 publizierten eine gute Beurteilbarkeit des ALL mit Ursprung und Ansatz sowie eine Sensitivität von 100%. Capo et al.17 fanden das ALL in nur 60% ihrer Fälle und stellten die Diagnostik mit Ultraschall infrage. Aber auch in MRT-Studien wird eine Prävalenz des ALL zwischen 50% und 100% angegeben.18–20 Unsere Arbeitsgruppe schaut jedoch in erster Linie auf die Kaplanfasern, da diese, wie bereits erörtert, im Vergleich mit dem ALL der größere Innenrotationshemmer sind.
In einer Arbeit von 2020 postulieren Berthold et al.21, dass eine Verletzung der im MRT sehr gut abgrenzbaren Kaplanfasern in die Entscheidung für anterolaterale Zusatzeingriffe einbezogen werden sollte und diese routinemäßig inspiziert werden sollten. Dieselbe Arbeitsgruppe zeigte in einem 2021 rezent publizierten Paper, dass bei knapp mehr als 50% der „isolierten“ VKB-Verletzungen retrospektiv eine Beteiligung der Kaplanfasern vorhanden war.
Die Klassifikation von Verletzungen des anterolateralen Ecks ist etwas schwierig, da wie bereits erwähnt auch die Fachwelt bezüglich der Anatomie und der biomechanischen Wichtigkeit nicht ganz eins ist. Ferretti et al.22 publizierten 2016 eine Klassifikation samt Prävalenzen, wobei sie hier nicht auf die Strukturen des ITB, im Speziellen die Kaplanfasern, eingingen. Somit ist eine allgemein akzeptierte und etablierte Klassifikation noch ausständig.
Indikationen für anterolaterale Zusatzeingriffe
Die Indikationen für anterolaterale Zusatzeingriffe wurden im Rahmen einer internationalen Experten-Round-Table-Diskussion erörtert23 und wie folgt definiert:
-
VKB-Revisionseingriffe
-
Chronische VKB-Verletzungen
-
Grad-III-Pivot-Shift in der klinischen Untersuchung
-
Hoher sportlicher Anspruch bei „Pivot-Shift-Sportarten“
-
>5mm tibiale Translation und/oder 10m/s2 Rotationsbeschleunigung
-
Generalisierte Hyperlaxizität
Derzeit versucht unsere Arbeitsgruppe, bei primären VKB-Rupturen ein Scoring-System einzuführen, um standardisiert laterale Zusatzeingriffe zu indizieren. Faktoren, die wir dabei in Betracht ziehen, sind unter anderem das weibliche Geschlecht, Transplantatwahl, tibialer Slope, Alter, Segond-Fraktur, Hyperlaxizität oder vermehrte tibiale Innenrotation.
Therapieoptionen
Therapeutisch stehen beim ALC einige operative Verfahren zur Auswahl. Generell kann man zwischen zwei Arten der operativen Versorgung unterscheiden. Zum einen gibt es die extraartikulären Tenodesen, bei denen in den meisten Techniken ein Teil des ITB proximal abgesetzt und auf unterschiedliche Arten an unterschiedlichen Positionen am lateralen Femurepikondylus refixiert wird. Bei den extraartikulären Tenodesen handelt es sich in der Regel um eine transplantatfreie Technik, bei der keine anatomische Rekonstruktion des ALL stattfindet.24 Zum anderen gibt es die neueren anatomischen ALL-Rekonstruktionen mit Sehnengrafts, bei denen das ALL meist mit Semitendinosus- oder Gracilissehne rekonstruiert wird. Hier unterscheiden sich die Techniken hauptsächlich durch die Transplantatpositionierungen femoral und tibial.25
Die extraartikuläre Versorgung von anterolateralen Instabilitäten wurde bereits 1967 von Lemaire beschrieben. Zu dieser Zeit wurde die laterale extraartikuläre Tenodese (LET) isoliert bei kreuzbandinsuffizienten Kniegelenken eingesetzt, um der Innenrotations- und ventralen Instabilität entgegenzuwirken. Frühe Ergebnisse bei VKB-insuffizienten Kniegelenken mit LET-Versorgung zeigten schlechte Ergebnisse.26–28 Zusätzlich hat sich bei der isolierten Versorgung mittels LET (aufgrund des häufigen Overconstrainments bei Fixierung der LET in hochgradiger Außenrotation) ein erhöhtes Risiko für die Entstehung einer Arthrose gezeigt.24 Erst durch die Kombination der lateralen extraartikulären Versorgung mit den modernen Techniken der VKB-Plastik konnten biomechanisch und klinisch gute Ergebnisse erzielt werden.13,29–32 Zusätzlich zeigt die Publikation von Trojani et al.30 kein erhöhtes Langzeitrisiko für die Entwicklung einer Arthrose bei Patienten, die mit einer Revisions-VKB-Plastik kombiniert mit einer LET versorgt wurden.
Betrachtet man die biomechanische Arbeit von Inderhaug et al.,15 in der mehrere LET-Techniken und die ALL-Rekonstruktion verglichen wurden, so zeigte sich bei der modifizierten Lemaire-Technik, bei welcher der Traktusstreifen unter das Ligamentum collaterale laterale (LCL) geshuttelt wird, eine bessere Wiederherstellung der ursprünglichen Kniekinematik im Vergleich zur ALL-Rekonstruktion. Darüber hinaus konnte die Arbeitsgruppe bei der modifizierten Lemaire-Technik kein Overconstrainment erkennen.
Klinisch konnten Sonnery-Cottet et al.33 in einer prospektiven Studie mit 502 Patienten 2 Jahre postoperativ eine signifikante Reduktion der Rerupturrate bei Patienten, die mit einer VKB-Plastik (Hamstrings) + ALL-Rekonstruktion versorgt wurden (4,13% Rerupturrate), zeigen, im Vergleich zu Patienten, die eine isolierte VKB-Plastik erhielten (Hamstrings 10,77% Rerupturrate, BTB 16,77% Rerupturrate).
Analog dazu hat die Arbeitsgruppe von Getgood et al.32 in einer ebenso prospektiv randomisierten klinischen Studie die Rerupturrate von 589 Patienten nachuntersucht, die entweder mit einer VKB-Plastik + LET (modifizierte Lemaire-Technik) oder einer isolierten VKB-Plastik versorgt wurden. Auch hier zeigten sich vergleichbare Ergebnisse. Patienten, die mit VKB-Plastik und LET versorgt wurden, zeigten nach 2 Jahren eine Rerupturrate von 4%. Hingegen zeigte sich in der Kontrollgruppe mit isolierter VKB-Versorgung eine Rerupturrate von 11%.
Aufgrund der oben genannten biomechanischen und klinischen Datenlage haben sich in der Praxis zwei Operationstechniken herauskristallisiert, die die besten Ergebnisse versprechen. Im Folgenden werden die modifizierte Lemaire-Technik und die ALL-Rekonstruktion kurz dargestellt und erläutert.
Laterale extraartikuläre Tenodese (LET) – modifizierte Lemaire-Technik
Die folgende Technik basiert auf der Beschreibung von Wagner et al.34 und Getgood et al.32, welche anhand unserer Erfahrungen modifiziert wurde. Die Operation wird in der Standardlagerung für die Arthroskopie durchgeführt. Wir verwenden standardmäßig eine elektrische Beinhalterung. Das Knie wird in ca. 70° Flexion gelagert, um die Vorspannung des Traktus und des LCL zu reduzieren. Es folgen Anzeichnen des lateralen Epikondylus, des Fibulaköpfchens und des Tuberculum gerdy als Landmarken, Anlage eines ca. 4cm langen Hautschnittes beginnend 1cm proximal und dorsal des lateralen Epikondylus mit Schnitt Richtung Tuberculum gerdy, Darstellung des Traktus und Anlegen einer Stichinzision knapp über dem Tuberculum gerdy, im mittleren Drittel des ITB, Spalten des Traktus im Faserverlauf nach proximal. Aufsuchen der Höhe des LCL-Ursprungs, um die Länge für den Traktusstreifen abzuschätzen.
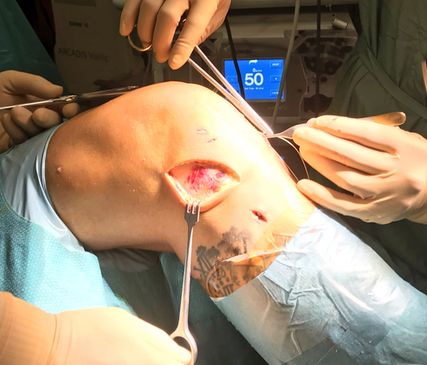
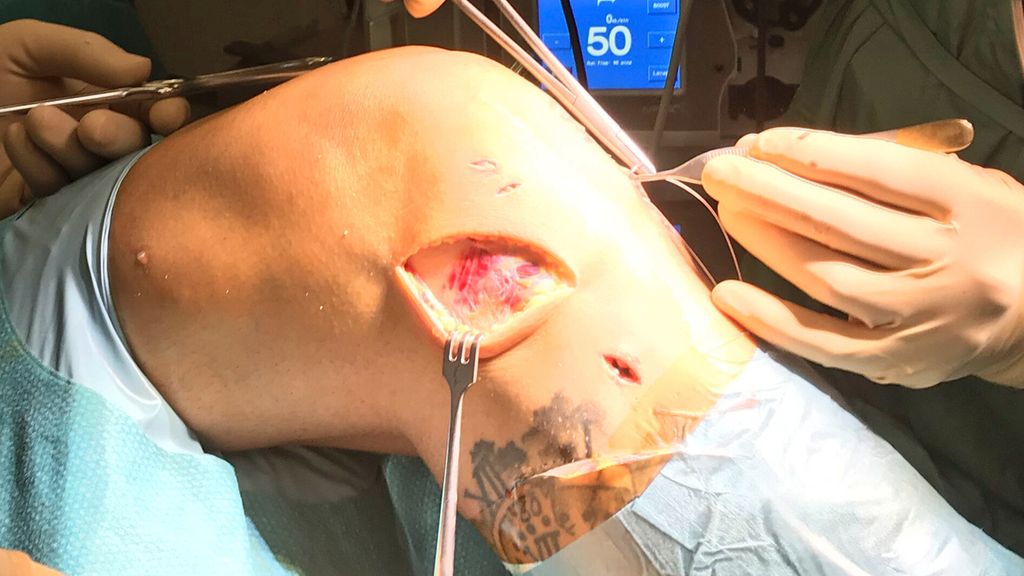
Abb. 4: Intraoperatives Bild von modifizierter Lemaire-Technik mit Einbringung des Fadenankers im Bereich des isometrischen Feldes
Als nächster Schritt wird der zweite Schnitt in Faserverlauf durchgeführt, um einen ca. 1cm breiten Streifen des ITB zu erhalten. Nach Absetzen des Traktusstreifens proximal Darstellung des LCL in Varusstress. Anschließend Unterfahren des LCL mit einer Overhold-Klemme und Präparation des femoralen Ursprungs des LCL. Daraufhin wird das Ende des Trakturstreifens mittels Fiberwire armiert und mit der Overhold-Klemme unter das LCL durch geshuttelt.Es folgen Aufsuchen des lateralen Epikondylus, nach lokaler Deperiostierung Einbringen eines doppelt armierten Titanfadenankers (4,5mm) im isometrischen Feld (SafeZone), welches sich proximal und knapp dorsal des lateralen Epikondylus befindet,35 Vernähen des Traktusstreifens mittels Krakow-Technik über den ersten Faden. In 30° Knieflexion und Neutralrotation wird nun die Fixierung des Traktusstreifens durchgeführt, ohne dabei ein Overconstrainment zu erzeugen.15 Der Traktusstreifen wird nun über die zwei Fäden an den Anker fixiert. Es folgt ein schichtweiser Wundverschluss mit fortlaufender Naht des Tractus iliotibialis.
ALL-Rekonstruktion nach Sonnery-Cottet
Aufgrund der guten klinischen Resultate wird im Folgenden die ALL-Rekonstruktion nach Sonnery-Cottet beschrieben.33 Neben dieser gibt es auch noch weitere Techniken, die sich hauptsächlich in der Art und Weise der Fixierungstechnik unterscheiden.
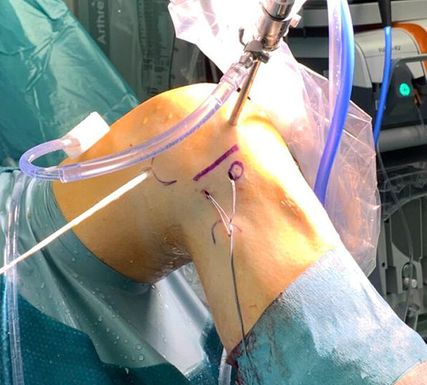
Die Operation wird in der Standardlagerung für die Arthroskopie durchgeführt und das Kniegelenk wird in 90° gelagert. Es folgen das Markieren der drei knöchernen Landmarken, wie bereits oben beschrieben, und die Entnahme der Gracilissehne in üblicher Art. Anschließend wird über drei Stichinzisionen die Isometrie ausgemessen. Hierfür wird die erste Stichinzision am superolateralen Rand des Tuberculum gerdyi angelegt. Die zweite Stichinzision wird in der Mitte zwischen Fibulaköpfchen und Tuberculum gerdyi angelegt, auf der Position des tibialen ALL-Ansatzes. Die dritte Stichinzision wird proximal und dorsal des lateralen Femurepikondylus angelegt. Drei Bohrdrähte werden über die drei Stichinzisionen eingebracht. Zur Überprüfung der Isometrie wird eine Vicrylfadenschlaufe um die drei Drähte gelegt und mittels Klemme fixiert.
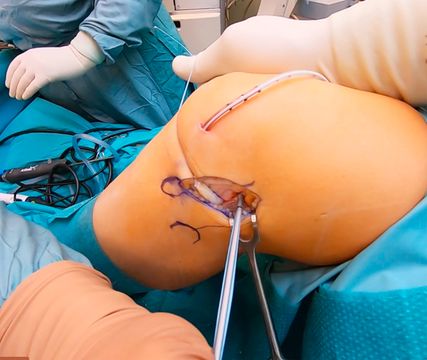
Abb. 6: Intraoperatives Bild bei ALL-Rekonstruktion mit Markierung der Landmarken (Danke für die Bereitstellung des Bildes an Dr. K. Röder, DKH Schladming, Leiter Prim. Dr. G. Mattiassich)
Nun wird das Knie frei durchbewegt und auf die Spannungsverhältnisse des Fadens geachtet. Hier sollte die Spannung über die gesamte ROM relativ konstant sein, lediglich bei einer Beugung über 90° darf der Faden etwas lockerer erscheinen. Bei korrekter Positionierung der Bohrdrähte werden diese mit einem 6,0mm-Bohrer überbohrt. Es sollte eine Bohrkanaltiefe von 20mm angestrebt werden. Als Erstes wird nun die Sehne einfach gefaltet und im Bereich der Umschlagfalte kurzstreckig mittels nicht resorbierbaren Fadens armiert und danach mittels SwiveLock-Anker (Arthrex) im femoralen Kanal fixiert. Dadurch ergibt sich eine verkehrte V-Form, die einen punktuellen Ansatz femoral und einen breiten Ansatz tibial bietet. Die zwei Transplantatschenkel werden nun unter dem Tractus iliotibialis zu den zwei tibialen Bohrdrähten durch geshuttelt. In voller Streckung wird die Länge der Transplantatstümpfe auf Höhe der Bohrdrähte markiert und pro Sehnenstumpf werden weitere 15mm ergänzend nach distal eingezeichnet. Es folgen Absetzen der Sehnenstümpfe an der distalen Markierung und Armieren der Enden mittels nicht resorbierbaren Fadens. Beide Transplantate werden mittels SwiveLock-Anker (Arthrex) in voller Streckung in den tibialen Bohrkanälen fixiert. Die Wunde wird schichtweise verschlossen.
An unserer Abteilung bevorzugen wir die modifizierte LET nach Lemaire aus zwei Gründen. Einerseits ist es ein simpler Eingriff ohne weitere Bohrkanäle und andererseits ist kein weiteres Sehnengraft notwendig. Die biomechanischen Daten sprechen aus unserer Sicht auch eher für eine Tenodese und aufgrund der operativen Safe Zone am lateralen Femurkondyl35 ist es ein sehr sicheres operatives Verfahren.
Generell muss bei allen VKB-Rekonstruktionen immer an periphere und intraartikuläre Begleitpathologien gedacht werden, damit am Ende der Operation wieder eine normale Kniekinematik erreicht werden kann. Eine genaue präoperative Planung mit exakter Ermittlung des Unfallmechanismus, des Verletzungsausmaßes unter sorgfältiger Analyse der MRT-Bilder, des klinischen Zustandsbildes und der individuellen Patientenbedürfnisse stellt immer die Basis aller operativen Maßnahmen dar.
Des Weiteren sollte auch der anterolaterale meniskokapsuläre Komplex nicht außer Acht gelassen werden und er sollte auch im Fokus von weiterführenden wissenschaftlichen Arbeiten stehen.
Literatur:
1 Claes S et al.: J Anat 2013; 223(4): 321-8 2 Segond P-F: Recherches cliniques et expérimentales sur les épanchements sanguins du genou par entorse. Progrès médical, Paris 1879: 1-85 3 Irvine GB et al.: J Bone Joint Surg Br 1987; 69(4): 613-4 4 Hughston JC et al.: J Bone Joint Surg Am 1976; 58(2): 173-9 5 Dodds AL et al.: Bone Joint J 2014; 96-B(3): 325-31 6 Herbst E et al.: Orthop J Sports Med 2017; 5(10): 2325967117730805 7 Brenner E: J Anat 2014; 224(3): 316-44 8 Landreau P et al.: Orthop J Sports Med 2019; 7(1): 2325967118818064 9 Smeets K et al.: Arthroscopy 2017; 33(5): 1028-35 10 Song GY et al.: Am J Sports Med 2016; 44(2): 362-9 11 Chambat P et al.: Int Orthop 2013; 37(2): 181-6 12 Kittl C et al.: Am J Sports Med 2016; 44(2): 345-54 13 Geeslin AG et al.: Am J Sports Med 2018; 46(3): 607-16 14 Huser LE et al.: Arthroscopy 2017; 33(3): 595-604 15 Inderhaug E et al.: Am J Sports Med 2017; 45(2): 347-54 16 Cavaignac E et al.: Arthroscopy 2016; 32(1): 120-6 17 Capo J et al.: Knee Surg Sports Traumatol Arthrosc 2017; 25(10): 3134-9 18 Taneja AK et al.: Skeletal Radiol 2015; 44: 403-10 19 Hartigan DE et al.: Arthroscopy 2016: 32(10): 2061-5 20 Helito CP et al.: Orthop J Sports Med 2015; 3(12): 2325967115621024 21 Berthold DP et al.: Am J Sports Med 2020; 48(8): 1929-36 22 Ferretti A et al.: Arthroscopy 2017; 33(1): 147-54 23 Musahl V et al.: J Am Acad Orthop Surg 2018; 26(8): 261-7 24 Slette EL et al.: Arthroscopy 2016; 32(12): 2592-611 25 DePhilippo NN et al.: Arthroscopy 2017; 33(8): 1575-83 26 Dahlstedt LJ et al.: Acta Orthop Scand 1988; 59(6): 687-91 27 Neyret P et al.: Br J Sports Med 1994; 28(1): 31-4 28 Fox JM et al.: Clin Orthop Relat Res 1980; (147): 56-61 29 Inderhaug E et al.: Am J Sports Med 2017; 45(13): 3089-97 30 Trojani C et al.: Knee Surg Sports Traumatol Arthrosc 2012; 20(8): 1565-70 31 Sonnery-Cottet B et al.: Am J Sports Med 2017; 45(7): 1547-57 32 Getgood AJM et al.: Am J Sports Med 2020; 48(2): 285-97 33 Sonnery-Cottet B et al.: Arthrosc Tech 2016; 5(1): e211-5 34 Wagner M, Weiler A : Arthroskopie 2014; 27: 198-201 35 Kittl C et al.:Am J Sports Med 2015; 43(2): 354-62
Das könnte Sie auch interessieren:
Mehr kardiovaskuläre Ereignisse und Malignome?
Mit Tofacitinib, einem Strukturanalogon von ATP, wurde 2013 erstmals ein Januskinase-Inhibitor (JAKi) in der Schweiz zugelassen. Die Vertreter dieser Medikamentenklasse haben sich gut ...
Seltene Kleingefässvaskulitiden im Fokus
Bei Vaskulitiden der kleinen Gefässe liegt eine nekrotisierende Entzündung der Gefässwand von kleinen intraparenchymatösen Arterien, Arteriolen, Kapillaren und Venolen vor. Was gilt es ...
Elektive Hüft-TEP bei Adipositas Grad III
Übergewichtige Patient:innen leiden früher als normalgewichtige Personen an einer Hüft- oder Kniearthrose. Allerdings sieht die aktuelle S3-Leitlinie zur Behandlung der Coxarthrose in ...