Bioresorbierbare Implantate in der Kindertraumatologie
Autoren:
Dr. Christoph Röder
Univ.-Prof. DDr. Thomas Klestil
Abteilung für Orthopädie und Traumatologie, Landesklinikum Baden-Mödling
Romy Linda Marek, MSc, BSc
Universitätsklinik für Orthopädie und Traumatologie, Medizinische Universität Graz
Korrespondierender Autor:
Dr. Christoph Röder
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
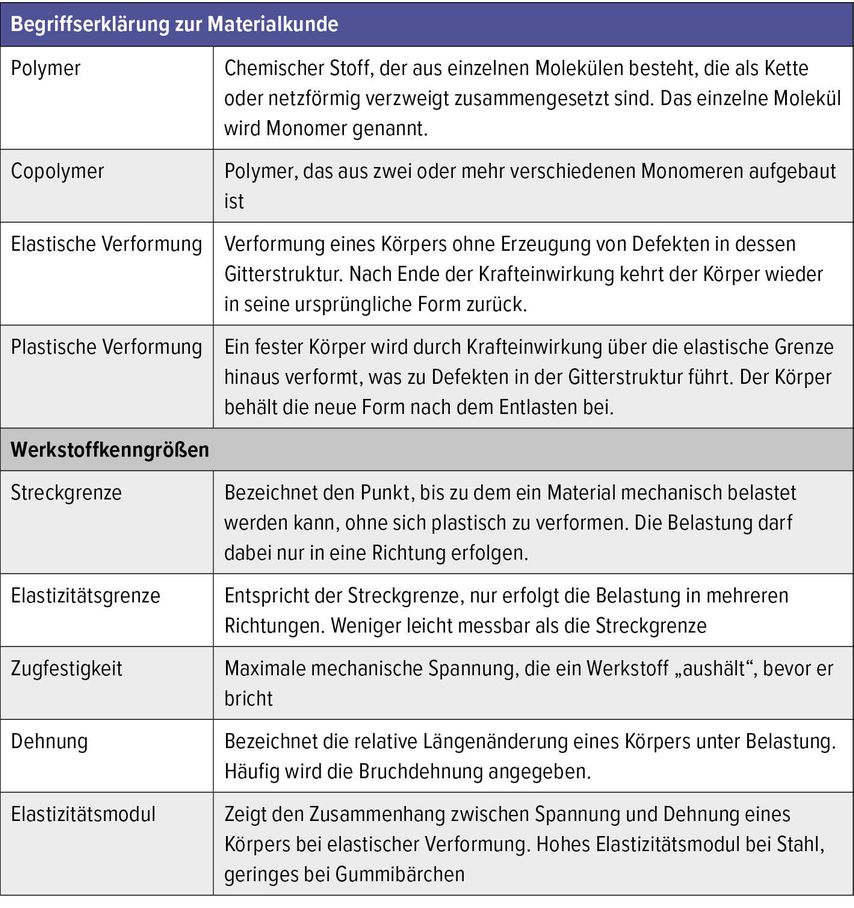
Resorbierbare Materialien in der Orthopädie und Traumatologie haben einen besonderen Stellenwert bei der Behandlung von Kindern, da hier der Aufwand der Implantatentfernung groß ist und Langzeitschäden bei verbliebenen Implantaten heute noch nicht absehbar sind. Ihr Einsatz ist limitiert, da präklinische Studien an wachsenden Tieren selten sind und Studien an Kindern bisher nur über kleine Fallzahlen berichten.
In den letzten 20 Jahren hat sich die operative Versorgung von Frakturen im Kindesalter in vielen Bereichen verbessert. Kürzere Hospitalisierungen, schonende Anästhesie- und minimal invasive Operationsverfahren, wie zum Beispiel Markdrahtung, haben die Therapie und den Heilungsverlauf optimiert. Resorbierbare Materialien in der Kindertraumatologie haben das Potenzial, die Behandlung unserer jungen Patienten zu verbessern, werden aber derzeit wenig angewendet.
Der Vorteil dieser Materialien besteht darin, dass keine zweite Operation zur Materialentfernung notwendig ist und trotzdem keine Fremdkörper im Organismus zurückbleiben. Für jeden Patienten und insbesondere für Kinder geht ein operativer Eingriff mit Stress, Angst, Schmerz und der Gefahr von Komplikationen einher, was durch resorbierbare Implantate verringert werden könnte.
Das Gesundheitssystem profitiert von freiwerdenden Ressourcen im OP, da Kindernarkosen aufwendig und zeitintensiv sind.
Das Ziel für unsere kleinen Patienten ist es, ein Implantat zu entwickeln, welches auf lange Sicht keinen Schaden verursacht und sich vollständig auflöst, damit keine Implantatentfernung mehr notwendig ist. Gleichzeitig muss das Material für die Dauer der Knochenheilung ausreichend stabil sein.
Dieser Beitrag beschäftigt sich mit den bisher eingesetzten Materialien zur Stabilisierung von kindlichen Frakturen bzw. osteochondralen Defekten. Der Beitrag weist am Ende auf eine laufende multizentrische europäische Studie hin, die von den Autoren initiiert und ein CE-zugelassenes, resorbierbares Implantat im Kindesalter evaluiert.
Biomechanik
Bei der Auswahl des richtigen Implantatmaterials gilt es, verschiedene Faktoren zu beachten. Für traumatologisch-orthopädische Indikationen sollte das ideale Implantat eine gewisse biomechanische Stabilität aufweisen, um im lasttragenden Bereich eine Fraktur adäquat stabilisieren zu können. Aber bereits die Frage, welche Last wann im Kindesalter in der Frakturheilung getragen werden muss, ist in der Literatur nicht definiert.
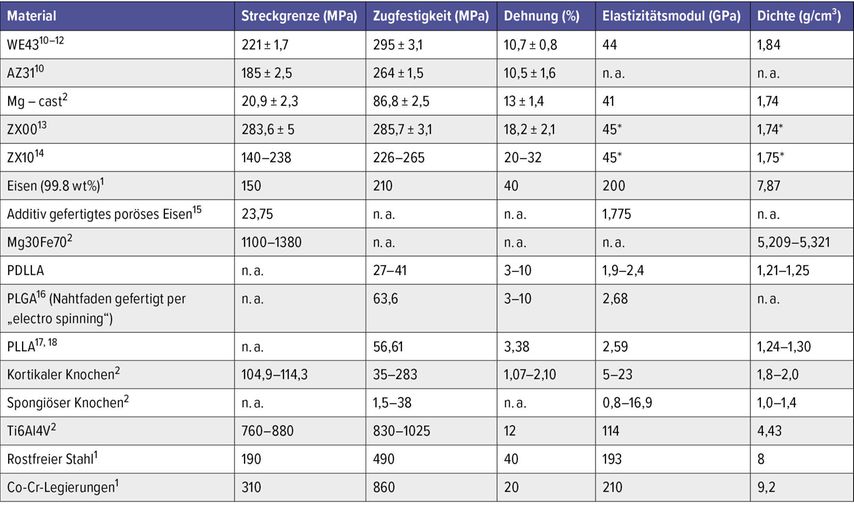
Generell gilt im Materialbereich (Tab. 2): Ist die Zugfestigkeit des Materials zu gering, besteht die Gefahr einer Refraktur durch Bruch des Implantats beim Einwirken einer kritischen Kraft vor Eintreten einer vollständigen Heilung. Weiters muss das Material eine suffiziente Elastizitätsgrenze aufweisen. Ist der elastische Anteil bei der Verformung eines Materials zu gering, resultiert dies in einer plastischen Verformung des Materials unter Bildung von Defekten in der Gitterstruktur, welche zu einer Versprödung des Werkstoffs führen. Dadurch verringert sich auch die Dauerfestigkeit des Materials. Werkstoffe wie Stahl oder Titan-Legierungen weisen sowohl eine hervorragende Zugfestigkeit als auch Elastizitätsgrenze auf.1,2 Jedoch verfügen diese Werkstoffe auch über ein hohes Elastizitätsmodul. Das führt beim Einsatz im orthopädischen Bereich zum „StressShielding“.3–7 Hierbei bildet sich der Knochen um das Implantat herum zurück. Da der Knochen auf Höhe des Implantats von einwirkenden Kräften abgeschirmt ist, werden die Osteozyten nicht mehr genügend stimuliert und in diesem Bereich wird mehr Knochen abgebaut als neu gebildet.8,9 Um das zu verhindern, wird nach Materialien gesucht, die ein vergleichbares Elastizitätsmodul wie Knochen haben.
Tab. 2: Mechanische Eigenschaften verschiedener Biomaterialien (n.a.=not available, *=unpublizierte Daten)
Materialentfernung: indiziert oder nicht?
In immer mehr Ländern ist es üblich, Implantate auch nach Frakturheilung im Knochen zu belassen. Damit verbleibt das Fremdmaterial viele Jahrzehnte im Körper, ohne dass wir mögliche Langzeitfolgen ausschließen können. Mehrere Studien haben gezeigt, dass bisher verwendete Materialien, wie Titan, zu adversen Langzeitreaktionen führen können.19–22 Der Hintergrund ist, dass bei inerten Materialien immer freie Ionen in die Umgebung abgegeben werden. Diese Präzipitation wird für chronische immunologische Reaktionen verantwortlich gemacht. Um diese Gefahren zu vermeiden, ist es aus Sicht der Autoren nach wie vor indiziert, konventionelle Implantate – meist aus Titan- oder Stahllegierungen – zumindest bei Kindern wieder zu entfernen.
Resorbierbare Materialien und deren Eigenschaften
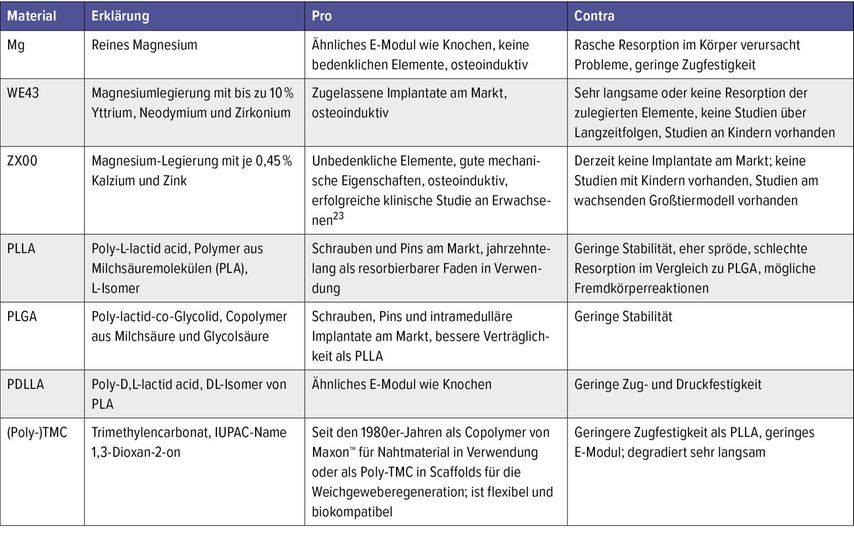
Eine Alternative sind resorbierbare Implantate. Bisher werden Magnesium und Polymere in der Klinik eingesetzt. Einen Überblick darüber gibt Tabelle 3. Bioresorbierbare Polymere weisen ein sehr geringes E-Modul auf.1,2,17,24 Ihre Zugfestigkeit liegt weit unter der von kortikalem Knochen.2,25 Die bisher verwendeten Polymere können daher im lasttragenden Bereich nicht eingesetzt werden. Ein vielversprechendes metallisches Material ist Magnesium (Mg). Reinmagnesium verfügt über ein vergleichbares E-Modul wie Knochen, jedoch sind Zugfestigkeit und Elastizitätsgrenze recht gering (Tab. 2).2 Um die biomechanischen Eigenschaften zu verbessern und die Degradation zu verlangsamen, erfolgt die Zulegierung von Elementen wie Kalzium (Ca) und Zink (Zn). Ca wirkt sich positiv auf die Kornverfeinerung der Legierung aus wie auch auf deren Zugfestigkeit und Kriechresistenz. Zn verbessert die Zugfestigkeit.26 Der Anteil an Zn darf nicht zu hoch sein, da sich dies negativ auf die Degradationsrate auswirkt.23 Das einzige zugelassene Mg-System (WE43) auf dem Markt weist als Zulegierung seltene Erden, wie zum Beispiel Yttrium, mit bis zu 10% auf. Da diese sich als Komplexe vor Ort nicht oder nur sehr langsam auflösen, bleibt die Frage, welche Langzeiteffekte diese metallischen Präzipitationen auf den menschlichen Körper haben. Eine wissenschaftliche Aufarbeitung dieser Langzeiteffekte ist bisher nicht durchgeführt worden. Es gibt Legierungen, welche gänzlich auf seltene Erden verzichten, aber derzeit liegen keine zugelassenen Implantate aus diesen Materialien vor.
Tab. 3: Zusammenfassung von resorbierbaren Materialien, die für eine Osteosynthese infrage kommen oder bereits verwendet werden
Präklinische Studien
Präklinische Studien, die den Fokus auf das wachsende Skelett richten, finden sich leider nur selten in der Literatur. Von der Arbeitsgruppe Biomaterialien der Universität Graz gibt es Publikationen über Magnesiumimplantate im Tiermodell. Grün et al. führten einen Vergleich von Klein- und Großtieren im wachsenden Modell durch und fanden keinen negativen Effekt auf die Knochenheilung.27 Die Studiendauer betrug 24 Monate. Sie verwendeten ZX00, eine Magnesiumlegierung ohne seltene Erden. Holweg et al. prüften das gleiche Implantat im wachsenden Schaf und konnten aufzeigen, dass keine Wachstumsstörungen oder Beinlängenalterationen eingetreten waren.13 Insgesamt zeigten diese Arbeiten aber, dass sich je nach Design und verwendeter Legierung das Degradationsverhalten ändert. Im Bereich der Polymere finden sich in den letzten 5 Jahren keine Studien in wachsenden Tiermodellen.
Klinische Studien im Kindesalter
Bei allen Implantaten, welche bei Kindern eingesetzt werden, muss auch die Auswirkung auf die Wachstumsfuge beachtet werden. Das betrifft nicht nur den vorzeitigen Fugenschluss, etwa durch Verletzung bei der Operation, oder die Materialeigenschaften eines Implantates, das die Wachstumsfuge kreuzt, sondern es muss auch die mögliche Wirkung von Abbauprodukten eines resorbierbaren Materials oder von Metallionen aus dem Implantat auf die Wachstumsfuge beachtet werden.
Magnesium
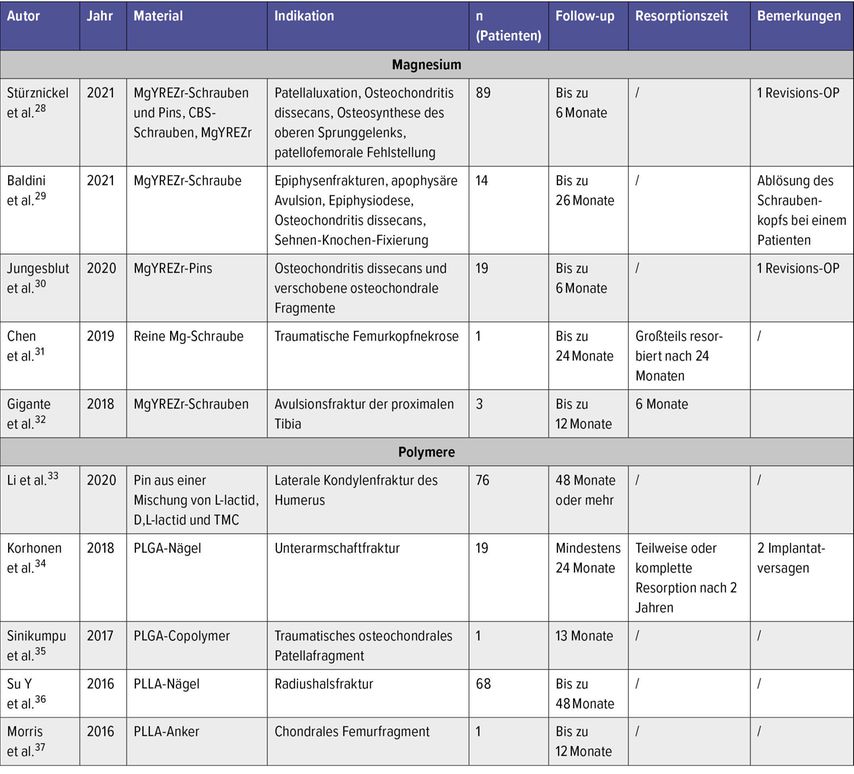
Bei unserer Literaturrecherche konnten nur 5 klinische Studien zu magnesiumbasierten Implantaten bei Kindern und Jugendlichen gefunden werden (Tab.4).28–32 Stürznickel et al. evaluierten MgYREZr-Implantate in 89 Kindern mit einer Nachuntersuchungszeit (NUZ) von durchschnittlich 8,2 Monaten.28 Diese wurden zur Refixation osteochondraler Fragmente, für Osteosynthesen und Osteotomien verwendet. 6 Schrauben zeigten im Verlauf eine Verformung ohne klinische Relevanz. Als Ursache dafür vermuten die Autoren eine zu frühe Vollbelastung oder eine zu schnelle Degradation des Materials. Es erfolgte eine Revisionsoperation bei einem instabilen osteochondralen Defekt des medialen Femurkondyls mit gebrochenem Pin.
Tab. 4: Studien der letzten 5 Jahre zu Implantaten aus Magnesiumlegierungen und Polymeren bei Kindern
Eine weitere Studie von Baldini et al. verwendete bei 14 Patienten eine MgYREZr-Schraube.29 In dieser retrospektiven Studie wiesen die Patienten ein Durchschnittsalter von 10,8 Jahren auf. Es wurden epiphysäre Frakturen am Ellenbogen, apophysäre Frakturen und eine Osteochondritis dissecans behandelt sowie eine Epiphysiodeseund eine Refixation einer Sehne durchgeführt. Die durchschnittliche NUZ betrug 13,8 Monate und keiner der Patienten wies Komplikationen im Sinne einer Revisionsoperation auf.
Jungesblut et al. refixierten in 19 Patienten eine instabile Osteochondritis dissecans oder dislozierte osteochondrale Fragmente mit MgYREZr-Pins. Das Durchschnittsalter betrug 13,7 Jahre (30). Die NUZ betrug 6 bis 20 Monate. Einmal erfolgte eine Revisionsoperation aufgrund eines Implantatversagens.
Ein Case Report von Chen et al. berichtet über die Refixation eines vaskularisierten Knochenspans mit einer Reinmagnesiumschraube bei einem 17-jährigen Patienten.31 Nach 24 Monaten kam es zu keinem Kollaps des Femurkopfs und die Schraube war nahezu vollständig degradiert.
Gigante et al. behandelten 3 Patienten mit einem knöchernen Kreuzbandausriss durch eine arthroskopische Refixation mit einer MgYREZr-Schraube.32 Nach 12 Monaten zeigte keiner der Patienten Komplikationen, die verwendeten Schrauben waren nahezu aufgelöst und es hatte sich neuer Knochen gebildet.
Polymer-Implantate
In der Kindertraumatologie werden ebenso resorbierbare Polymere verwendet. In einer Studie von Li et al. mit 76 Patienten wurden Condylus-radialis-Frakturen mit biodegradierbaren Pins aus einem Copolymer aus LLA, DLLA und Trimethylencarbonat (TMC) fixiert und mit Kirschner-Draht-versorgten Frakturen verglichen.33 Die Autoren berichten über zufriedenstellende Ergebnisse, 2 Patienten entwickelten einen Cubitus varus und 6 eine Fischschwanzdeformität. Der Unterschied zu Kirschner-Draht-fixierten Condylus-radialis-Frakturen war nicht signifikant.
2018 publizierten Korhonen et al. eine Studie, bei der Unterarmschaftfrakturen mit resorbierbaren Marknägeln aus PLGA versorgt wurden. In dieser randomisierten Studie wurden 19 Patienten mit dem neuen Implantat operiert und mit 16 Patienten verglichen, die mit Titannägeln versorgt wurden.34 Die Studienteilnehmer waren zwischen 5 und 15 Jahre alt und die NUZ war 2 Jahre. Es gab 2 Implantatversagen in der Gruppe der resorbierbaren Nägel. Diese beiden Patienten waren über 13 Jahre alt. Alle anderen Frakturen heilten primär und die Nägel waren nach zwei Jahren teilweise oder komplett resorbiert.
Sinikumpu et al. publizierten einen Case Report über einen 11-jährigen Patienten mit traumatischer Kniescheibenluxation. Das osteochondrale Fragment wurde mit einer Schraube aus PLGA fixiert.35 Die NUZ nach 13 Monaten zeigte eine exzellente Heilung in der radiologischen Auswertung.
Su Y et al. behandelten 68 Patienten mit PLLA-Nägeln bei Radiusköpfchenfrakturen.36 3 Wochen postoperativ wurde der Gips entfernt und eine funktionelle Nachbehandlung erlaubt. Das Durchschnittsalter in dieser Studie war 8,4 Jahre, die NUZ lag zwischen 6 und 40 Monaten. Es wurden keine schweren Komplikationen berichtet.
Morris et al. publizierten 2016 einen Case Report eines 14-jährigen Jungen, der eine Refixation eines chondralen femoralen Fragments mit einem Dart aus PLLA erhielt.37 Nach einem Jahr zeigte der Patient eine freie Kniebeweglichkeit und keine Residuen des Traumas mehr.
Alle Studien weisen gute Ergebnisse auf, aber die Anzahl der eingeschlossenen Teilnehmer ist meist gering, was die Anwendung kritisch erscheinen lässt.
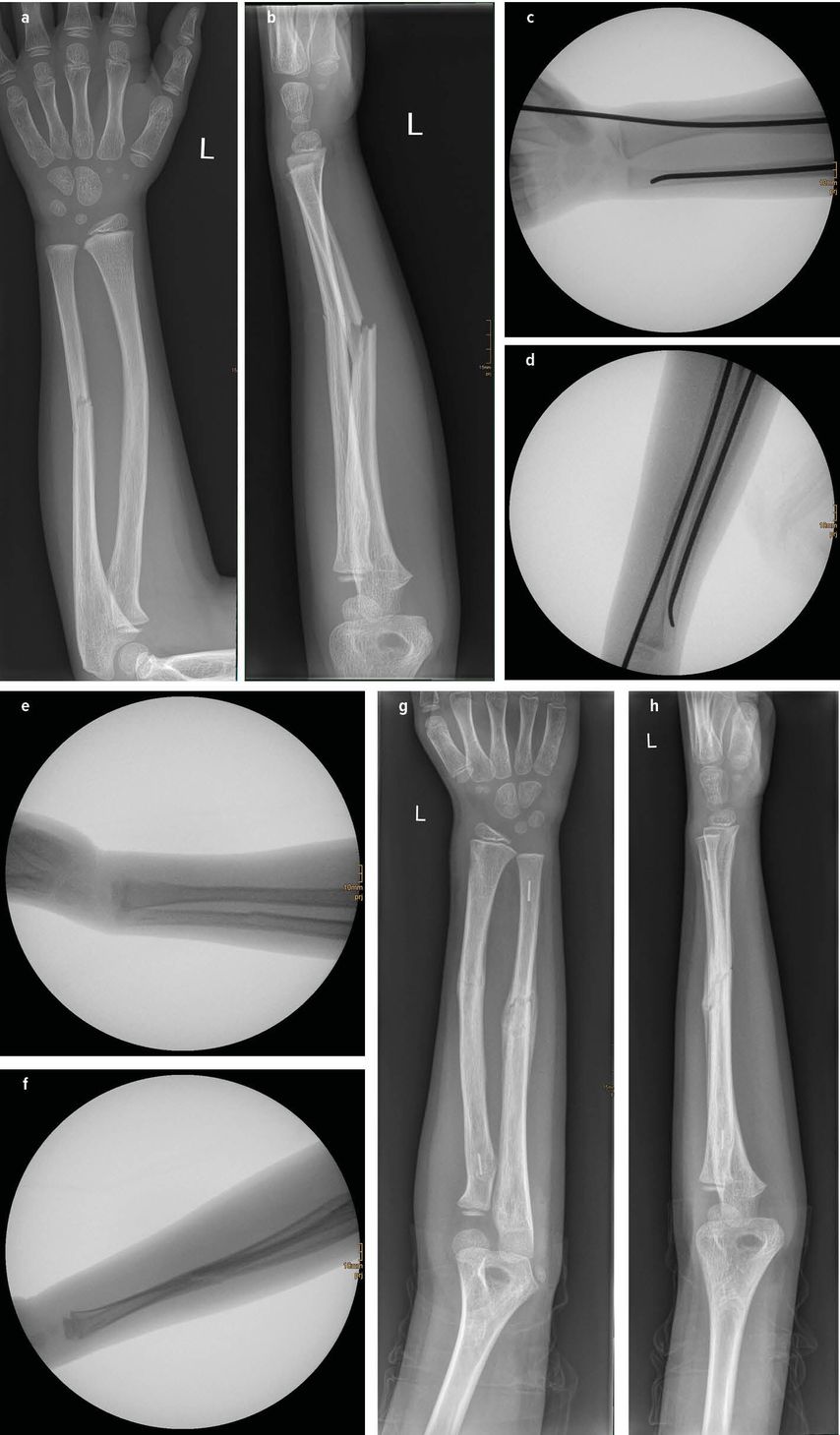
Die in den Studien von Sinikumpu und Korhonen verwendeten Markdrähte aus PLGA wurden von der finnischen Firma Bioretec Oy CE-zertifiziert und unter dem Namen Activa IM-Nail vermarktet, in Österreich vertreibt die Fa. Hofer diese Implantate. In einer europaweiten Multicenterstudie mit aktuell 9 beteiligten Kliniken unter der Leitung der Donau-Universität Krems wird dieses Implantat an einer großen Studienpopulation (>200) evaluiert. Es werden Patienten im Alter zwischen 3 und 13 Jahren mit Unterarmschaftfrakturen nach Einwilligung aufgenommen. Die Einschlusskriterien und damit die Indikation zur operativen Stabilisierung entsprechen der Indikation der bisher verwendeten Titanmarkdrähte. Ein Ziel der Studie ist es, die Anzahl der Refrakturen zu erheben. In der Literatur wird bei konventionell behandelten pädiatrischen Unterarmfrakturen eine Refrakturrate zwischen 1,1% und 16,7% angegeben.38–42 In Österreich startete die Studie im März 2021 im Krankenhaus Mödling. Bisher konnten 6 Patienten in Mödling eingeschlossen werden, europaweit sind 24 Patienten im Rahmen dieser Studie bis jetzt operiert worden. Abgesehen von der Resorption des Materials ist der größte Unterschied des PLGA-Implantats zum bisher üblichen Titanmarkdraht die deutlich geringere Stabilität des Polymers. Aufgrund dessen muss bei der Implantation zunächst ein konventioneller Stahl- oder Titandraht als Dilatator in den Markraum eingebracht werden, der in einem zweiten Schritt durch das PLGA-Implantat ersetzt wird (Abb. 1). Eine postoperative Gipsruhigstellung ist notwendig. Alle Patienten waren bei der Kontrolle nach 2 Wochen schmerzfrei. Die postoperative Gipsruhigstellung ist für die Studienteilnehmer ein geringerer Nachteil als eine zweite Operation zur Metallentfernung, welche bei der konventionellen Operationsmethode notwendig wäre.
Abb. 1: Frakturversorgung mit Activa IM-Nail: a, b) Verletzung; c, d) intraoperativ Fraktur reponiert, Dilatatoren eingebracht; e, f) intraoperativ mit liegenden Implantaten; g, h) Röntgenkontrolle nach 25 Tagen
Zusammenfassung
Bioresorbierbare Implantate wären im Kindes-und Jugendalter von besonders großem Vorteil, da die Versorgung der Verletzungen oft minimalinvasiv erfolgt und die Metallentfernung nach wie vor einen großen Aufwand bedeutet. Das Belassen von konventionellen Implantaten erscheint nicht sinnvoll, da die Langzeitfolgen nicht abgeschätzt werden können. Mittlerweile gibt es ausgewogene PLGA-, aber auch PLLA-Copolymere, die einen Einsatz im Kindesalter möglich erscheinen lassen. Leider fehlen Langzeitstudien mit größeren Patientenkollektiven, um die Technologie besser beurteilen zu können. Magnesium kann derzeit nicht abschließend beurteilt werden, da vor allem Großtierstudien zur Beurteilung von möglichen Wachstumsstörungen fehlen und Magnesium als Kirschner-Draht und damit fugenkreuzend implantiert werden könnte. Erste Ergebnisse erscheinen aber vielversprechend. Generell sollten wir als Fachgesellschaften versuchen, die fehlende Datenlage durch multizentrische Studien zu verbessern.
Literatur:
1 Chen J et al.: Mechanical properties of magnesium alloys for medical application: a review. J Mech Behav Biomed Mater 2018; 87: 68-79 2 Gu XN, Zheng YF: A review on magnesium alloys as biodegradable materials. Front Mater Sci China 2010; 4(2): 111-5 3 Chanlalit C et al.: Stress shielding around radial head prostheses. J Hand Surg Am 2012; 37(10): 2118-25 4 Sumner DR: Long-term implant fixation and stress-shielding in total hip replacement. J Biomech 2015; 48(5): 797-800 5 Noyama Y et al.: Bone loss and reduced bone quality of the human femur after total hip arthroplasty under stress-shielding effects by titanium-based implant. Mater Trans 2012; 53(3): 565-70 6 Zhang QH et al.: Stress shielding in bone of a bone-cement interface. Med Eng Phys 2016; 38(4): 423-6 7 Ridzwan MIZ et al.: Problem of stress shielding and improvement to the hip implant designs: a review. J Med Sci (Faisalabad, Pakistan) 2007; 7(3): 460-7 8 Tatsumi S et al.: Targeted ablation of osteocytes induces osteoporosis with defective mechanotransduction. Cell Metab 2007; 5(6): 464-75 9 Iolascon G et al.: Periprosthetic bone density as outcome of therapeutic response. Clin Cases Miner Bone Metab 2010; 7(1): 27-31 10 Zhang X et al.: Biocorrosion properties of as-extruded Mg-Nd-Zn-Zr alloy compared with commercial AZ31 and WE43 alloys. Mater Lett 2012; 66(1): 209-11 11 Xiang C et al.: Effect of microstructure on tensile and compressive behavior of WE43 alloy in as cast and heat treated conditions. Mater Sci Eng A Struct Mater 2018; 710: 74-85 12 Hyer H et al.: High strength WE43 microlattice structures additively manufactured by laser powder bed fusion. Materialia (Oxf) 2021; 16: 101067 13 Holweg P et al.: A lean magnesium-zinc-calcium alloy ZX00 used for bone fracture stabilization in a large growing-animal model. Acta Biomater 2020; 113: 646-59 14 Hofstetter J et al.: Processing and microstructure-property relations of high-strength low-alloy (HSLA) Mg-Zn-Ca alloys. Acta Mater 2015; 98: 423-32 15 Li Y et al.: Additively manufactured biodegradable porous iron. Acta Biomater 2018; 77: 380-93 16 Haghighat F, Ravandi SAH: Mechanical properties and in vitro degradation of PLGA suture manufactured via electrospinning. Fibers and Polymers 2014; 15(1): 71-7 17 Eawwiboonthanakit N et al.: Tensile properties of poly(L-lactic) acid(PLLA) blends. Adv Mat Res 2014; 1024: 179-83 18 Yu B et al.: The structure and properties of biodegradable PLLA/PDLA for melt-blown nonwovens. J Polym Environ 2017; 25(2): 510-7 19 Thomas P et al.: Impaired wound-healing, local eczema, and chronic inflammation following titanium osteosynthesis in a nickel and cobalt-allergic patient: a case report and review of the literature. J Bone Joint Surg Am 2011; 93(11): e61 20 Thomas P et al.: Increased metal allergy in patients with failed metal-on-metal hip arthroplasty and peri-implant T-lymphocytic inflammation. Allergy 2009; 64(8): 1157-65 21 Lalor P et al.: Sensitivity to titanium. A cause of implant failure? J Bone Joint Surg Br 1991;73(1): 25-8 22 Comino-Garayoa R et al.: Allergies to titanium dental implants: What do we really know about them? A scoping review. Biology (Basel) 2020; 9(11): 404 23 Holweg P et al.: A lean bioabsorbable magnesium-zinc-calcium alloy ZX00 used for operative treatment of medial malleolus fractures: early clinical results of a prospective non-randomized first in man study. Bone Joint Res 2020; 9(8): 477-83 24 Gentile P et al.: An overview of poly(lactic-co-glycolic) acid (PLGA)-based biomaterials for bone tissue engineering. Int J Mol Sci 2014; 15(3): 3640-59 25 Morgan EF et al.: Bone mechanical properties in healthy and diseased states. Annu Rev Biomed Eng 2018; 20: 119-43 26 Li N, Zheng Y: Novel magnesium alloys developed for biomedical application: a review. J Mater Sci Technol 2013; 29(6): 489-502 27 Grün NG et al.: Comparison of a resorbable magnesium implant in small and large growing-animal models. Acta Biomater 2018; 78: 378-86 28 Stürznickel J et al.: Safety and performance of biodegradable magnesium-based implants in children and adolescents. Injury 2021; S0020-1383(21)00255-2. doi: 10.1016/j.injury.2021.03.037. Online ahead of print 29 Baldini M et al.: Use of resorbable magnesium screws in children: systematic review of the literature and short-term follow-up from our series. J Child Orthop 2021; 15(3): 1-10. doi: 10.1302/1863-2548.15.210004 30 Jungesblut OD et al.: Fixation of unstable osteochondritis dissecans lesions and displaced osteochondral fragments using new biodegradable magnesium pins in adolescents. Cartilage 2020; 194760352094294. doi: 10.1177/1947603520942943. Online ahead of print 31 Chen L et al.: Treatment of trauma-induced femoral head necrosis with biodegradable pure Mg screw-fixed pedicle iliac bone flap. J Orthop Translat 2019; 17: 133-7 32 Gigante A et al.: Intercondylar eminence fracture treated by resorbable magnesium screws osteosynthesis: acase series. Injury 2018; 49: S48-53 33 Li J et al.: Is biodegradable pin a good choice for lateral condylar fracture of humerus in children. Medicine (Baltimore) 2020; 99(33): e21696 34 Korhonen L et al.: Intramedullary nailing of forearm shaft fractures by biodegradable compared with titanium nails: results of a prospective randomized trial in children with at least two years of follow-up. Biomaterials 2018; 185: 383-92 35 Sinikumpu JJ, Serlo W: Biodegradable poly-L-lactide-co-glycolide copolymer pin fixation of a traumatic patellar osteochondral fragment in an 11-year-old child: a novel surgical approach. Exp Ther Med 2017; 13(1): 242-6 36 Su Y et al.: Internal fixation with absorbable rods for the treatment of displaced radial neck fractures in children. J Pediatr Orthop 2016; 36(8): 797-802 37 Morris JK et al.: Adolescent femoral chondral fragment fixation with poly-L-lactic acid chondral darts. Orthopedics 2016; 39(2): e362-6 38 Rousset M et al.: Risk factors for re-fracture in children with diaphyseal fracture of the forearm treated with elastic stable intramedullary nailing. Eur J Orthop Surg Traumatol 2016; 26(2): 145-52 39 Lascombes P et al.: Use and abuse of flexible intramedullary nailing in children and adolescents. J Pediatr Orthop 2006; 26(6): 827-34 40 Dinçer R et al.: Surgical treatment of pediatric forearm fractures with intramedullary nails: is it a disadvantage to leave the tip exposed? J Pediatr Orthop B 2020; 29(2): 158-63 41 Makki D et al.: Elastic stable intramedullary nailing in paediatric forearm fractures: the rate of open reduction and complications. J Pediatr Orthop B 2017; 26(5): 412-6 42 Makki D et al.: Refractures following removal of plates and elastic nails from paediatric forearms. J Pediatr Orthop B 2014; 23(3): 221-6
Das könnte Sie auch interessieren:
Mehr kardiovaskuläre Ereignisse und Malignome?
Mit Tofacitinib, einem Strukturanalogon von ATP, wurde 2013 erstmals ein Januskinase-Inhibitor (JAKi) in der Schweiz zugelassen. Die Vertreter dieser Medikamentenklasse haben sich gut ...
Seltene Kleingefässvaskulitiden im Fokus
Bei Vaskulitiden der kleinen Gefässe liegt eine nekrotisierende Entzündung der Gefässwand von kleinen intraparenchymatösen Arterien, Arteriolen, Kapillaren und Venolen vor. Was gilt es ...
Elektive Hüft-TEP bei Adipositas Grad III
Übergewichtige Patient:innen leiden früher als normalgewichtige Personen an einer Hüft- oder Kniearthrose. Allerdings sieht die aktuelle S3-Leitlinie zur Behandlung der Coxarthrose in ...