.jpg)
Zulassung für Erstlinientherapie mit Pembrolizumab plus Chemotherapie
Bericht: Dr. Ine Schmale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Pembrolizumab hat von der Europäischen Arzneimittel-Agentur (EMA) eine Zulassungserweiterung für die Behandlung des Ösophaguskarzinoms erhalten. Der PD-1(„programmed cell death protein1“)- Inhibitor ist nun in Kombination mit einer Platin- und Fluoropyrimidin-basierten Chemotherapie für die Erstlinienbehandlung des lokal fortgeschrittenen nicht resezierbaren oder metastasierenden Ösophaguskarzinoms oder des HER2-negativen Adenokarzinoms des gastroösophagealen Übergangs bei Erwachsenen mit PD-L1 exprimierenden Tumoren (CPS [„combined positive score“] ≥10) indiziert.1 DieZulassung basiert auf den Daten der Phase-III-Studie KEYNOTE-590, die erstmals bei der Jahrestagung der European Society of Medical Oncology (ESMO) 2020 präsentiert wurden.2
Die Immuntherapie mit PD-1-gerichteten Checkpoint-Inhibitoren führt bereits bei vielen Patienten mit diversen Tumorentitäten zu einer Verbesserung der Prognose. In der doppelblinden, randomisierten, placebokontrollierten Phase-III-Pivotalstudie KEYNOTE-590 wurde die Wirksamkeit von Pembrolizumab in Kombination mit einer Platin- und Fluoropyrimidin-basierten Chemotherapie nun auch für die Erstlinientherapie von lokal fortgeschrittenen nicht resezierbaren oder metastasierten Karzinomen der Speiseröhre oder des gastroösophagealen Übergangs (GEJ) Siewert Typ I gegenüber der alleinigen Chemotherapie bestätigt.1
OS-Verlängerung durch Pembrolizumab-Gabe
In der KEYNOTE-590-Studie erhielten jeweils 373 Patienten randomisiert bis zu 35 Zyklen Pembrolizumab (200mg, q3w) sowie bis zu 35 Zyklen 5-FU (800mg/m2, d1–5, q3w) und bis zu 6 Zyklen Cisplatin (80mg/m2, q3w) oder im Kontrollarm Placebo plus Chemotherapie. Zu den Ausschlusskriterien gehörten eine aktive Autoimmunerkrankung, eine Erkrankung, die eine Immunsuppression erforderte, oder ein bekanntes HER2-positives Adenokarzinom des GEJ. Als duale primäre Endpunkte wurden das Gesamtüberleben (OS) und das progressionsfreie Überleben (PFS) gemäß RECIST-1.1-Kriterien durch den Prüfarzt untersucht. Die beiden primären Endpunkte wurden in hierarchischer Reihenfolge bei Patienten mit Plattenepithelkarzinom der Speiseröhre, PD-L1 CPS ≥10, und schließlich bei allen Patienten geprüft.1
Bei 383 der insgesamt 749 eingeschlossenen Patienten wurde eine PD-L1-Tumorexpression von CPS ≥10 festgestellt. Das mediane Alter dieser Patientengruppe betrug 63 Jahre, 41% der Patienten waren 65 Jahre oder älter. Bei 82% der Studienteilnehmer handelte es sich um Männer, 56% waren asiatischer Herkunft. Bei 75% der Tumoren handelte es sich um ein Plattenepithelkarzinom und bei 25% um ein Adenokarzinom.1 Die erste Interimsanalyse der KEYNOTE-590-Studie wurde mit einer medianen Nachbeobachtungszeit von 10,8 Monaten präsentiert.2
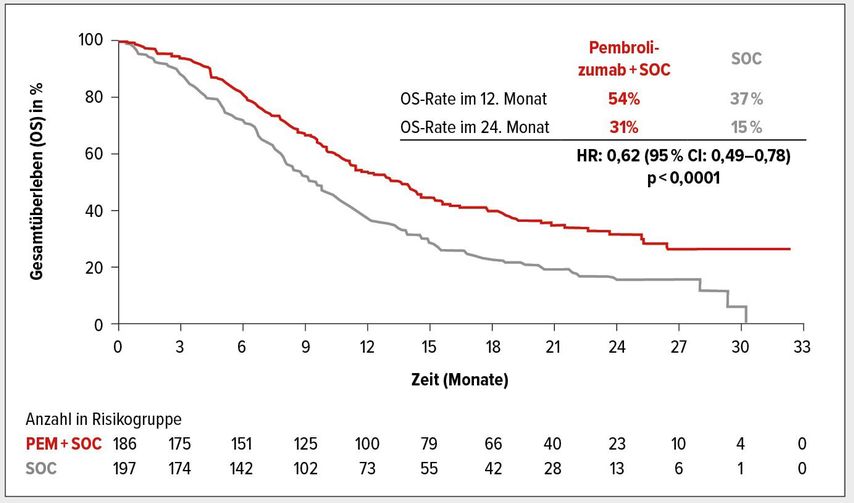
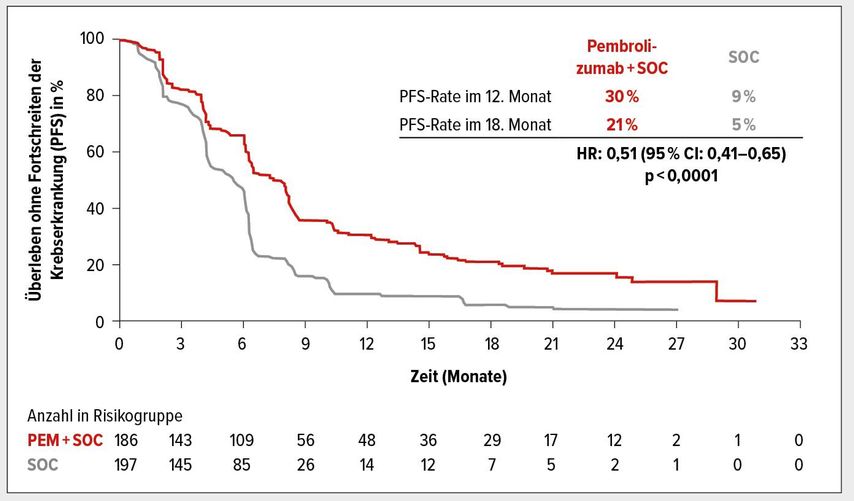
Das OS betrug innerhalb der PD-L1-CPS ≥10 Population 13,5 Monate vs. 9,4 Monate unter Standardtherapie (HR: 0,62; 95% CI: 0,49–0,78; p<0,0001; Abb. 1). Das mediane PFS betrug unter Standardtherapie 5,5 Monate, im Pembrolizumab-haltigen Arm wurden im Median 7,5 Monate erreicht (Abb. 2). Nach 12 Monaten lebten 30 versus 9% der Patienten ohne Fortschreiten der Erkrankung, nach 18 Monaten 21 versus 5%. Das Risiko für eine Progression wurde um 49% reduziert (HR: 0,51; 95% CI: 0,41–0,65; p<0,0001).
Abb. 1: Gesamtüberleben (OS) von Patienten mit einer PD-L1-Expression CPS ≥10 unter Therapie mit Pembrolizumab + Chemotherapie vs. Placebo + Chemotherapie. Mod. n. Fachinformation KEYTRUDA1
51,1% der Patienten mit CPS≥10 im Pembrolizumab-Arm versus 26,9% der Patienten im Chemotherapie-Arm sprachen auf die Studienmedikation an. Die Dauer des Ansprechens betrug median 10,4 versus 5,6 Monate.1
Abb. 2: Progressionsfreies Überleben (PFS) von Patienten mit PD-L1-Expression CPS ≥10 unter Therapie mit Pembrolizumab + Chemotherapie vs. Placebo + Chemotherapie. Mod. n. Fachinf. KEYTRUDA1
Es brachen 19% der Patienten im Pembrolizumab-Arm versus 12% im Kontrollarm die Studienmedikation aufgrund von therapieassoziierten Nebenwirkungen ab. Nebenwirkungen Grad 3–5 traten bei 72% der Patienten mit Pembrolizumab + Chemotherapie vs. 68% der Patienten mit alleiniger Chemotherapie auf.2
Erhalt der gesundheitsbezogenen Lebensqualität unter Pembro
Da die Lebensqualität der Patienten eine immer größere Bedeutung auch in den klinischen Studien hat, wurde beim ASCO GI (American Society of Clinical Oncology Gastrointestinal Cancers Symposium) 2021 die Auswertung der Fragebögen EORTC QLQ-C30, EORTC QLQ-OES18 und EQ-5D-5L als eigener Vortrag präsentiert. Die Sicherheitspopulation schloss 711 Patienten ein, von denen mehr als 90% bei Studienbeginn und alle Patienten in Woche 18 Fragebögen ausfüllten. Die gesundheitsbezogene Lebensqualität blieb über mindestens 18 Wochen in beiden Studienarmen erhalten. Die zusätzliche Behandlung mit Pembrolizumab verschlechterte somit die Lebensqualität im Vergleich mit der alleinigen Chemotherapie nicht.3
Fazit für die Praxis
Die zusätzliche Pembrolizumab-Gabe zu einer Platin- und Fluoropyrimidin-basierten Chemotherapie kann für Patienten mit fortgeschrittenem, nicht resezierbarem oder metastasiertem Karzinom der Speiseröhre oder des gastroösophagealen Übergangs das das Risiko zu sterben um 38% und das Risiko für Progress oder Tod um 49% reduzieren.1 Mit diesen überlegenen Wirksamkeitsergebnissen ist die Erstlinientherapie mit der Kombination aus Pembrolizumab und Chemotherapie eine wichtige Bereicherung des therapeutischen Portfolios. Die EMA hat Pembrolizumab in Kombination mit einer Platin- und Fluoropyrimidin-basierten Chemotherapie für die genannte Indikation für Patienten mit PD-L1-Expression CPS ≥10 am 29. 6. 2021 die Zulassungserweiterung erteilt.
Entgeltliche Einschaltung
Mit freundlicher Unterstützung durch Merck Sharp & Dohme GmbH
Literatur:
1 Fachinformation KEYTRUDA® , Stand: Juni 2021 2 Kato K et al.: ESMO 2020; Abstr. #LBA8_PR 3 Mansoor W et al.: ASCO GI 2021; Abstr. #168